Traitement non-CPAP de l’AOS – une véritable alternative?
Auteur:
Prof. Dr méd. Kurt Tschopp
Senior Consultant HNO Klinik
Kantonsspital Baselland
Liestal
E-mail: kurt.tschopp@ksbl.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
L’apnée obstructive du sommeil (AOS) (index apnée-hypopnée [IAH] >15/h) est fréquente chez les adultes. Dans une grande étude de population suisse (n=2021), 23% des femmes et 49% des hommes étaient concernés.1 Le traitement par pression positive continue (CPAP) autopilotée (aCPAP), longtemps considéré comme le «gold standard», est interrompu par 40 à 50% des patients.2 Des alternatives au traitement CPAP sont donc nécessaires. En raison du niveau de preuve élevé de l’efficacité des traitements alternatifs, ceux-ci ont été intégrés dans les directives actuelles révisées sur le traitement de l’AOS de l’adulte.3 Les directives suivantes présentent le traitement de l’AOS conforme aux directives et les alternatives à la CPAP.
Keypoints
-
Le traitement CPAP est interrompu par 40 à 50% des patients, d’où la nécessité de recourir à d’autres options thérapeutiques.
-
Des alternatives thérapeutiques dont l’efficacité a été prouvée avec un niveau de preuve élevé ont été intégrées dans les directives révisées pour le traitement de l’AOS chez l’adulte.
-
Dans de nombreuses situations, elles sont recommandées en première intention ou au moins comme équivalentes au traitement CPAP.
L’AOS se caractérise par un collapsus répétitif des voies respiratoires supérieures pendant le sommeil. Le pharynx doit résister à la pression négative engendrée pendant l’inspiration. Ceci est assuré par les muscles qui dilatent le pharynx; le plus important d’entre eux est le muscle génioglosse de la langue. La partie des voies respiratoires supérieures la plus étroite sur le plan anatomique est le palais. Le palais mou est l’endroit le plus fréquent où se produisent les ronflements. Plus l’AOS est sévère, plus l’obstruction est fréquente, même dans les parties les plus basses, par exemple en raison d’un affaissement de la base de la langue. Les parois latérales du pharynx jouent également un rôle important dans le collapsus des voies respiratoires supérieures. La localisation de l’obstruction peut varier pendant le sommeil. En particulier pendant le sommeil profond, le sommeil paradoxal (sommeil des rêves) ou même en décubitus dorsal, les parties inférieures du pharynx s’affaissent souvent également.4
L’AOS est une maladie affectant l’humain qui est due à la descente du larynx pendant la petite enfance. Cette descente est la condition préalable à la parole, une fonction qui, dans l’évolution, était manifestement plus importante que l’inconvénient d’une collapsibilité accrue des voies respiratoires supérieures. Alors que le nouveau-né peut encore respirer et boire en même temps, cette capacité disparaît avec l’acquisition de la parole. L’AOS n’existe pas dans le règne animal, sauf chez certaines races de chiens dont le museau a été supprimé par l’action de l’homme, comme le carlin ou le bouledogue.
Les facteurs qui contribuent au collapsus des voies respiratoires supérieures sont une activité insuffisante des muscles dilatateurs, des obstacles anatomiques tels que de grosses amygdales palatines, un crâne facial étroit ou un rétrécissement causé par le tissu adipeux parapharyngé, surtout en cas d’indice de masse corporelle (IMC) élevé. Une respiration nocturne par la bouche entraîne un relâchement des parois latérales du pharynx et un rétrécissement rétrolingual avec augmentation de la résistance des voies respiratoires. L’importance de la respiration nasale, en particulier la nuit, ne doit donc pas être sous-estimée.
Le traitement CPAP permet de maintenir les voies respiratoires supérieures ouvertes grâce à une pression positive et donc de remédier au collapsus. Hormis la trachéotomie, la CPAP reste le traitement le plus efficace de l’AOS. De nombreux patients ne tolèrent cependant pas le masque et le taux d’abandon est élevé. Après 5 ans, 40 à 50% des patients ont interrompu le traitement, et, même avant, la durée d’utilisation par nuit est souvent insuffisante.2
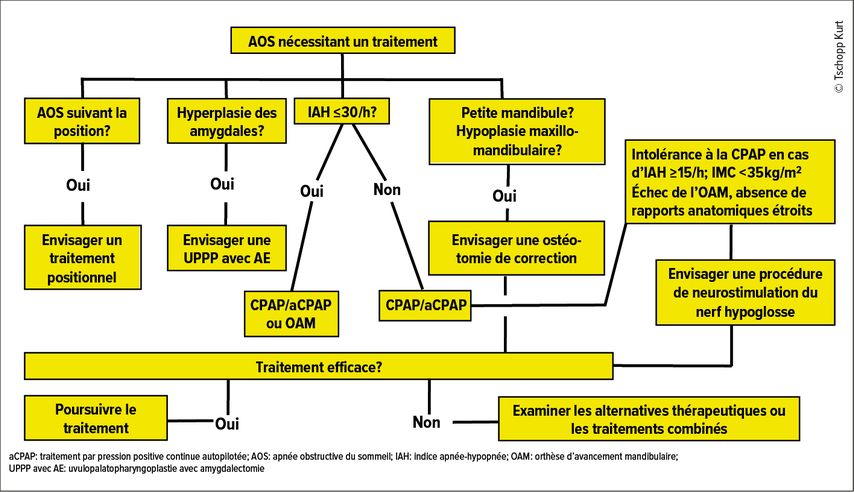
Il est donc nécessaire de trouver des alternatives au traitement CPAP. Celles-ci sont présentées ci-dessous en se référant aux directives actuelles sur le traitement de l’apnée obstructive du sommeil de l’adulte de la DGSM (Société allemande de recherche et de médecine du sommeil), résumées sous une forme légèrement modifiée dans la Figure 1. Pour la preuve de l’efficacité et les recommandations qui en découlent, les niveaux de preuve sont indiqués selon l’Oxford Center of Evidence Based Medicine (Tab. 1).5
Fig. 1: Directive partiellement actualisée de la DGSM pour le traitement de l’apnée obstructive du sommeil de l’adulte (adaptée selon Stuck et al., 2020)3
Mesures générales en cas d’apnée obstructive du sommeil
En cas d’obésité, une perte de poids ainsi qu’un traitement causal de l’AOS sont pertinents. Toutefois, cela ne doit pas retarder les autres traitements. Outre les mesures diététiques, un traitement médicamenteux, par exemple par des analogues du GLP-1, ou une chirurgie bariatrique doit être envisagé(e) à partir d’un IMC >33kg/m2, en particulier en cas de maladies concomitantes telles que le diabète sucré. Une perte de poids corporel de 10 à 15% diminue la valeur de l’IAH de 50%, les effets positifs de cette perte de poids ayant été démontrés à la fois dans des études contrôlées et dans une méta-analyse (niveau de preuve 1b).6
Il convient d’adopter de bonnes mesures d’hygiène du sommeil, par exemple dormir suffisamment, éviter les activités sur écran avant de dormir et se coucher à des heures régulières.
Traitement positionnel
On parle d’AOS associée au décubitus dorsal lorsque l’IAH est au moins deux fois plus élevé en décubitus dorsal que dans une autre position. Si la valeur de l’IAH dans une autre position se situe dans la norme, il est judicieux d’envisager un traitement positionnel. Cela est surtout valable dans les cas d’AOS de faible sévérité. Dans l’anamnèse, on trouve souvent l’indication que le ronflement ne se produit qu’en décubitus dorsal. Plus l’AOS est sévère et l’IMC élevé, moins l’association avec le décubitus dorsal est fréquente.
Pour le traitement positionnel, on distingue les méthodes actives et passives (Fig. 2). Parmi les méthodes passives, on trouve la méthode de la balle de tennis, des coussins spéciaux ainsi que des sacs à dos ou des gilets qui empêchent de se coucher sur le dos. Dans les méthodes actives, une vibration se déclenche en décubitus dorsal et se poursuit jusqu’à ce que la personne quitte cette position.
Fig. 2: a) Traitement positionnel passif et b) traitement positionnel actif pour éviter le décubitus dorsal
Une méta-analyse comprenant trois études randomisées comparant le traitement positionnel actif à la CPAP montre que la CPAP réduit davantage l’IAH (–6,4 événements/h en moyenne). En revanche, aucune différence n’a été constatée en ce qui concerne la réduction de la somnolence diurne ainsi que l’influence sur la qualité du sommeil et de la vie. Le traitement positionnel est nettement supérieur à l’absence de traitement.7
La durée d’utilisation de l’entraîneur de position était plus longue que celle du traitement CPAP. Les effets indésirables ont été moins nombreux sous traitement positionnel que sous CPAP. Les principaux effets indésirables du traitement positionnel peuvent être des douleurs au dos ou aux épaules.
L’observance du traitement positionnel actif est meilleure que celle des méthodes passives et était de 64% à 6 mois.8 Aucune donnée n’est disponible sur l’utilisation ultérieure à long terme du traitement positionnel. Chez les patients présentant une AOS associée à un décubitus dorsal, un traitement positionnel peut être recommandé (niveau de preuve 1b).
Uvulopalatopharyngoplastie avec amygdalectomie
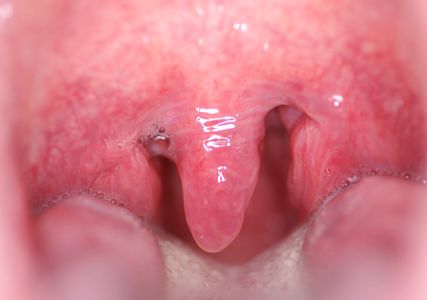
L’uvulopalatopharyngoplastie avec amygdalectomie (UPPP avec AE) est l’une des premières opérations qui ont été pratiquées pour l’AOS, et reste toujours la plus courante. Alors radicales, les opérations réalisées depuis la première description en 19819 appartiennent aujourd’hui au passé et ont été remplacées par des procédures qui préservent aussi bien les muscles que les muqueuses.10
La réduction de l’IAH dépend de la taille des amygdales retirées, de sorte que l’UPPP avec AE doit être envisagée surtout pour les grosses amygdales (Fig. 3).11 Deux études randomisées menées chez des patients ayant principalement de grosses amygdales ont montré une réduction de l’IAH d’environ 60%, ce qui est très significativement supérieur à l’attente seule.12,13
Une méta-analyse sur l’UPPP avec AE a mis en évidence une amélioration à long terme de la somnolence diurne et de la qualité du sommeil. La mortalité a pu être réduite par une UPPP avec AE par rapport à un groupe témoin non traité, de manière comparable au traitement CPAP.14
En raison du niveau de preuve élevé de l’efficacité et des effets secondaires nettement moins importants des procédures chirurgicales actuelles, l’UPPP avec AE pour les grosses amygdales a été intégrée comme recommandation dans les directives actualisées (niveau de preuve 1a).
Orthèses d’avancement mandibulaire
Une bonne dentition et l’absence d’antécédents de troubles de l’articulation temporo-mandibulaire sont une condition préalable à l’utilisation d’orthèses d’avancement mandibulaire (OAM). Il convient également d’exclure tout obstacle anatomique au niveau des voies respiratoires supérieures, tels que de grosses amygdales. Chez les patients présentant une AOS légère à modérée (IAH jusqu’à 30/h), une OAM peut être recommandée conformément aux directives comme alternative équivalente à un traitement CPAP (niveau de preuve 1b). Dans un essai randomisé contrôlé, le traitement CPAP a certes réduit davantage l’IAH qu’une OAM, mais l’effet sur la somnolence diurne, l’hypertension, la mortalité cardiovasculaire et la qualité de vie était comparable. De plus, une meilleure observance a été démontrée avec une OAM par rapport au traitement CPAP.15
Ostéotomies de correction (avancement maxillo-mandibulaire)
Les ostéotomies avec avancement du maxillaire et de la mandibule (MMA) sont surtout envisagées en cas de rétrognathie (mandibule reculée) et chez les patients jeunes (niveau de preuve 1b). L’effet ne repose pas seulement sur une modification des dimensions osseuses du crâne facial, mais aussi sur un repositionnement des muscles dilatateurs des voies respiratoires. Il s’agit généralement d’un avancement d’au moins 10mm. L’efficacité du MMA diminue avec l’âge. Une étude randomisée n’a montré aucune différence par rapport au traitement CPAP.16 Les effets secondaires sont des troubles de l’occlusion ainsi qu’une hypoesthésie permanente de la lèvre inférieure dans 14% des cas.
Le MMA est certes un traitement très efficace, même chez les patients normognathes, mais la stimulation des nerfs linguaux décrite dans le paragraphe suivant est beaucoup moins contraignante.
Stimulation des nerfs linguaux
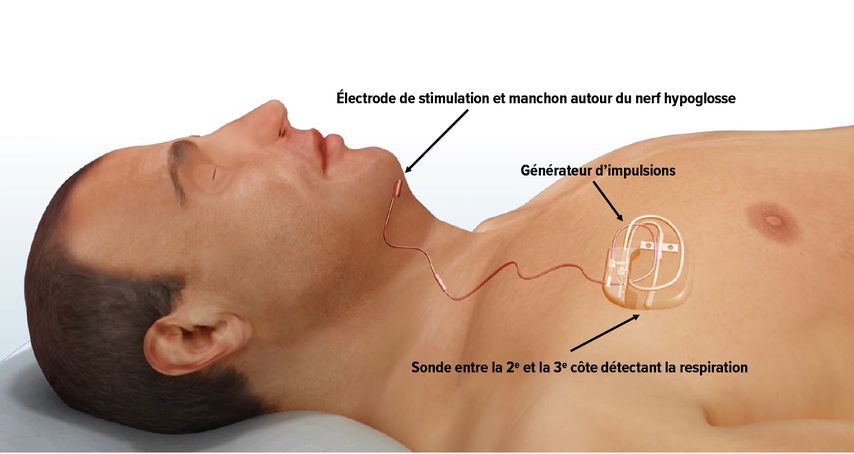
La stimulation du nerf hypoglosse a été introduite en Europe il y a environ 8 à 10 ans et est devenue une option incontournable pour les patients atteints d’AOS qui ne peuvent pas être traités autrement. Elle entraîne la contraction des muscles dilatateurs des voies respiratoires. Trois systèmes sont disponibles. En principe, il faut faire la distinction entre les systèmes synchronisés (Inspire) ou non (Aura6000, GenioSystem) avec la respiration. Le principe du système Inspire, le plus répandu, est illustré dans la figure 4. Lors de l’inspiration, les fibres nerveuses du nerf hypoglosse sont stimulées, ce qui entraîne une protrusion de la langue. La procédure est sûre et présente un taux de révision de seulement 1%. L’intervention est peu contraignante et ne nécessite qu’une courte hospitalisation de 1 à 2 jours.
Fig. 4: Représentation schématique de la neurostimulation du nerf hypoglosse avec le système Inspire (avec l’autorisation de la société Inspire Medical)
Une revue systématique montre des taux de réussite de 72 à 77% selon les critères de Sher (l’IAH initial est réduit de >50% et est <20/h).17 La stimulation du nerf hypoglosse peut être recommandée aux patients qui ne présentent aucun obstacle anatomique au niveau des voies respiratoires supérieures, tels que de grosses amygdales, qui n’ont pas toléré le traitement CPAP et chez qui une OAM a été un échec ou n’était pas possible en raison de l’état de leur dentition. Une évaluation minutieuse est nécessaire au préalable, avec une endoscopie sous sommeil induit. Un collapsus concentrique complet au niveau du palais doit être exclu. La proportion d’événements centraux doit être <25% de l’IAH.
Dans une étude croisée randomisée, en double aveugle avec stimulation active et factice, l’effet de la stimulation sélective du nerf hypoglosse a été clairement démontré.18 En respectant les critères d’indication, la stimulation du nerf hypoglosse chez les patients souffrant d’AOS modérée à sévère et ne tolérant pas la CPAP est une très bonne alternative thérapeutique avec un niveau de preuve élevé (1a).
Discussion
L’observance, c’est-à-dire l’utilisation d’un traitement, a une grande influence sur l’efficacité. Cela a conduit à la notion de «mean disease alleviation», qui prend en compte non seulement l’efficacité, mais aussi l’observance. Un traitement CPAP qui normalise certes l’IAH, mais n’est utilisé que la moitié de la nuit, conduit donc à la même «mean disease alleviation» qu’une opération qui réduit certes l’IAH de moitié, mais présente par nature une observance de 100%. Une «mean disease alleviation» comparable à celle du traitement CPAP a été démontrée pour une modification de l’UPPP avec AE.19
Ces dernières années, l’accent mis uniquement sur la valeur de l’IAH et sa réduction pour le succès du traitement a également été relativisé. Cette valeur est un mauvais prédicteur de la morbidité et de la mortalité cardiovasculaires. Il est bien établi dans des méta-analyses qu’un traitement CPAP ne diminue pas le risque cardiovasculaire malgré une réduction de l’IAH.20 Les paramètres physiologiques tels que la longueur des apnées, la variabilité du pouls et l’ampleur de la désaturation nocturne en O2 («oxygen burden») sont décisifs pour le risque cardiovasculaire.21 La somnolence diurne est également un facteur important pour le risque cardiovasculaire. Pour ces raisons, l’évaluation du succès thérapeutique ne repose pas uniquement sur la réduction de l’IAH, mais aussi sur l’amélioration des symptômes quotidiens, de la qualité de vie et de l’observance.
Fig. 5: Même si le traitement CPAP reste une pierre angulaire du traitement de l’AOS, les patients peuvent aujourd’hui s’attendre à être informés des alternatives conformes aux directives possibles
L’interdisciplinarité est importante dans l’évaluation et le traitement de l’AOS. Ainsi, les spécialistes en médecine du sommeil, les pneumologues, les ORL, les dentistes formés à la médecine du sommeil et les chirurgiens maxillo-faciaux devraient travailler en étroite collaboration.
Alors que le traitement CPAP était autrefois considéré comme le «gold standard» du traitement de l’AOS, il existe désormais des études avec un niveau de preuve élevé qui démontrent l’efficacité des traitements alternatifs. Ce niveau de preuve élevé a conduit à une révision appropriée des directives sur le traitement de l’AOS de l’adulte. Dans de nombreux cas, la CPAP n’est plus le traitement de première intention, ni même le seul traitement à recommander aux patients. Même si le traitement CPAP reste une pierre angulaire du traitement de l’AOS, les patients peuvent aujourd’hui s’attendre à être informés des différentes alternatives thérapeutiques conformes aux directives
Littérature:
1Heinzer R et al.: Prevalence of sleep-disordered breathing in the general population: the HypnoLaus study. J Lancet Respir Med 2015; 3: 310-8 2 Soose RJ et al.: OSA treatment history in an upper airway stimulation trial cohort. World J Otorhinolaryngol Head Neck Surg 2017; 3: 79-84 3 Stuck BA et al.: Teil-Aktualisierung S3-Leitlinie Schlafbezogene Atmungsstörungen bei Erwachsenen. Somnologie 2020; 24 : 176-208 4 Boudewyns AN et al.: Site of upper airway obstruction in obstructive apnoea and influence of sleep stage. Eur Respir J 1997; 10: 2566-72 5 Centre for Evidence-Based Medicine (CEBM): Oxford Centre for evidence-based medicine: levels of evidence. 2009. https://www.cebm.ox.ac.uk/resources/levels-of-evidence/oxford-centre-for-evidence-based-medicine-levels-of-evidence-march-2009 6 Anandam A et al.: Effects of dietary weight loss on obstructive sleep apnea: a meta-analysis. Sleep Breath 2013; 17: 227-34 7 Srijithesh PR et al.: Positional therapy for obstructive sleep apnoea Cochrane Database Syst Rev 2019; 5:CD010990 8 van Maanen JP, de Vries N: Long-term effectiveness and compliance of positional therapy with the sleep position trainer in the treatment of positional obstructive sleep apnea syndrome. Sleep 2014; 37: 1209-15 9 Fujita S et al.: Surgical correction of anatomic azbnormalities in obstructive sleep apnea syndrome: uvulopalatopharyngoplasty. Otolaryngol Head Neck Surger 1981; 89: 923-34 10 Verse T et al.: [Modern modifications of uvulopalatopharyngoplasty]. HNO 2017; 65: 90-8 11 Tschopp S et al.: Tonsil volume and outcome of radiofrequency uvulopalatoplasty with or without tonsillectomy in adults with sleep-disordered breathing. Eur Arch Otorhinolaryngol 2023; 280: 3005-13 12 Browaldh N et al.: SKUP3 randomised controlled trial: polysomnographic results after uvulopalatopharyngoplasty in selected patients with obstructive sleep apnoea. Thorax 2013; 68: 846-53 13 Sommer UJ et al.: Tonsillectomy with uvulopalatopharyngoplasty in obstructive sleep apnea. Dtsch Arztebl Int 2016; 113: 1-8 14 Stuck BA et al.: Uvulopalatopharyngoplasty with or without tonsillectomy in the treatment of adult obstructive sleep apnea – A systematic review. Sleep Med 2018; 50: 152-65 15 Phillips CL et al.: Health outcomes of continuous positive airway pressure versus oral appliance treatment for obstructive sleep apnea: a randomized controlled trial. Am J Respir Crit Care Med 2013; 187: 879-87 16 Vicini C et al.: Surgery vs ventilation in adult severe obstructive sleep apnea syndrome. Am J Otolaryngol 2010; 31: 14-20 17 Constantino A et al.: Hypoglossal nerve stimulation long-term clinical outcomes: a systematic review and meta-analysis. Sleep and Breath 2020; 24: 399-411 18 Heiser C et al.: Effect of Upper Airway Stimulation in Patients with Obstructive Sleep Apnea (EFFECT): A Randomized Controlled Crossover Trial. J Clin Med. 2021; 10: 2880 19 Huntley C: Comparison of CPAP and expansion sphincter pharyngoplasty using the mean disease alleviation concept. Laryngoscope 2023; 133: 1513-7 20 Yu J et al.: Association of positive airway pressure with cardio-vascular events and death in adults with sleep apnea: a systematic review and meta-analysis. JAMA 2017; 318: 156-66 21 Singh B: Physiology may be the key: cardiovascular risk stratification in obstructive sleep apnea. Am J Respir Crit Care Med 2021; 203: 1458-60
Das könnte Sie auch interessieren:
Les conjugués anticorps-médicament ont le vent en poupe
Actuellement, de nombreux conjugués anticorps-médicament sont en cours d’évaluation dans le cancer du poumon. Qu’ils soient utilisés seuls ou en combinaison avec d’autres thérapies ...
Effets sur la santé ainsi que risques liés au travail posté et de nuit
Le travail posté et de nuit entraîne un risque accru de multiples problèmes de santé en raison de la perte de sommeil et de la désynchronisation circadienne. Il s’agit notamment de ...
Les défis des interfaces interdisciplinaires
Face à un éventail croissant d’options ciblées et immunothérapeutiques, les tests moléculaires sont de plus en plus au centre de l’attention dans les tumeurs gastro-intestinales. Des ...