Symptômes de syndrome sec: approche pratique
Auteur·es:
Dre méd. Lisa Christ
PD Dr méd. Urs Steiner
Prof. Dre méd. Britta Maurer
Klinik für Rheumatologie und Immunologie, Inselspital, Universitätsspital Bern
E-mail: lisa.christ@insel.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Une femme de 30 ans présentant des symptômes de syndrome sec vous consulte pour savoir si elle souffre du syndrome de Sjögren. Une biopsie des glandes salivaires labiales a déjà été effectuée en externe et les résultats seraient compatibles avec un syndrome de Sjögren. Le diagnostic est-il désormais confirmé? Comment procédez-vous? L’article suivant donne une vue d’ensemble des causes des symptômes de syndrome sec et de la procédure de diagnostic.
Keypoints
-
Environ 1 patient sur 4 souffre de symptômes de syndrome sec ayant un impact considérable sur sa qualité de vie.
-
Les causes des symptômes de syndrome sec sont multiples et incluent le syndrome de Sjögren.
-
La mise en évidence d’auto-anticorps anti-SSA ne suffit pas à elle seule à poser le diagnostic de syndrome de Sjögren.
Les symptômes de syndrome sec touchent 20 à 30% de la population.1,2 Il est important de connaître les causes et les éléments de diagnostic permettant d’évaluer les symptômes de syndrome sec, non seulement en raison de leur fréquence, mais aussi de leur impact sur la qualité de vie. Une enquête a révélé que les patients souffrant de sécheresse oculaire modérée sacrifiaient 1,6 année de leur vie (s’ils devaient vivre encore 10 ans) pour se débarrasser de leur maladie; la valeur était de 0,7 an pour une fracture de la hanche invalidante.3 Cela souligne la pertinence des symptômes de syndrome sec chez les patients concernés.
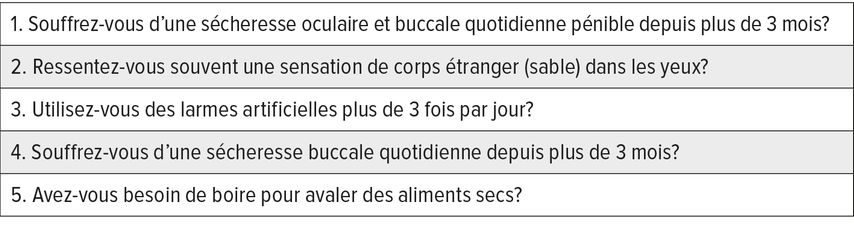
Les symptômes subjectifs de syndrome sec se distinguent de ceux objectifs (mise en évidence d’une diminution de la production lacrymale/salivaire). Il est intéressant de noter qu’il existe une mauvaise corrélation entre les symptômes subjectifs et objectifs de syndrome sec.4 Ainsi, des symptômes objectifs peuvent être présents même en l’absence de symptômes subjectifs. Il est judicieux d’utiliser des questions standardisées pour l’anamnèse,5 elles sont présentées dans le tableau 1. Ces questions permettent de distinguer une sécheresse occasionnelle d’une sécheresse chronique, appelée syndrome sec. Seul ce dernier point mérite d’être évalué.
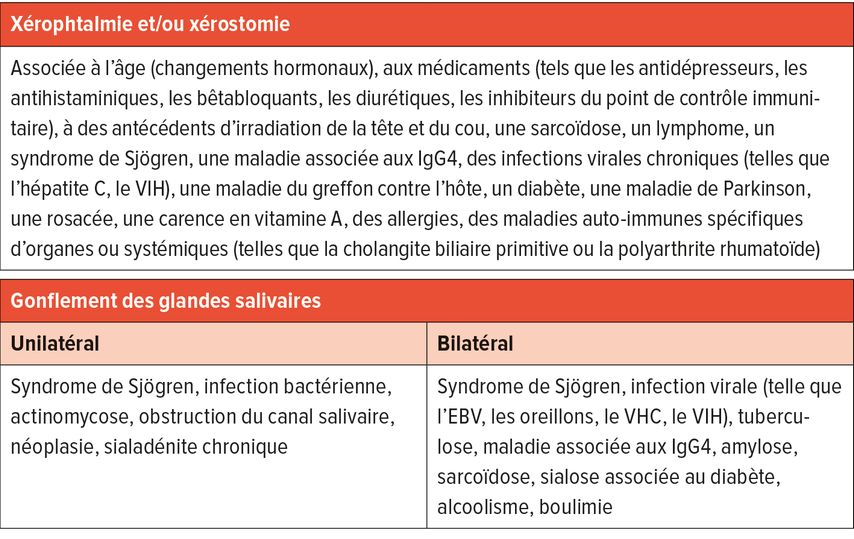
Les causes fréquentes de la sécheresse oculaire sont les médicaments (comme les antidépresseurs ou les diurétiques), les facteurs environnementaux (comme la climatisation ou la pollution atmosphérique) ou les changements liés à l’âge (comme les changements hormonaux ou la présence d’un ectropion). Les maladies systémiques, telles que le syndrome de Sjögren ou d’autres connectivites, la sarcoïdose ou les infections (comme l’hépatite C ou le VIH) peuvent également être associées à des symptômes de syndrome sec.
Un gonflement concomitant des glandes salivaires peut fournir des indications supplémentaires sur la cause. Dans le cas du syndrome de Sjögren, un gonflement uni- ou bilatéral, généralement indolore, des glandes salivaires est observé dans 20 à 30% des cas (études transversales). Des causes infectieuses (telles que les oreillons, l’EBV, le VHC) ou d’autres maladies systémiques (telles que l’amylose ou la sarcoïdose) peuvent s’accompagner d’un gonflement des glandes salivaires.6–9 Le tableau 2 énumère les causes possibles d’une sécheresse oculaire/buccale et d’un gonflement des glandes salivaires.
Tab. 2: Causes possibles d’une xérophtalmie, d’une xérostomie et d’un gonflement des glandes salivaires
Il existe plusieurs méthodes pour mesurer la production lacrymale et salivaire. Deux tests sont présentés ci-dessous à titre d’exemple. Dans la pratique clinique quotidienne, le test de Schirmer est souvent utilisé pour mesurer la production lacrymale. Il s’agit d’insérer un papier buvard dans le tiers latéral de la paupière inférieure et de lire la quantité de sécrétion lacrymale. Celle-ci correspond à l’humidification du papier buvard en millimètres sur une période de 5 minutes. Les valeurs à partir de 5mm/5min sont considérées comme des résultats normaux. Le test de Saxon peut être utilisé pour mesurer la production salivaire. Pour ce faire, le/la patient·e mâche une compresse pliée. La différence de poids de la compresse avant et après 2 minutes de mastication est déterminée. Les valeurs à partir de 2,75g/2min sont normales.8,10 Les deux tests sont faciles à réaliser dans la pratique clinique quotidienne et ne nécessitent aucun appareillage sophistiqué. Un autre test utilisé est notamment le débit salivaire non stimulé, lors duquel le patient crache sa salive dans un tube à essai pendant une période définie. Il convient de noter que fumer au préalable, s’hydrater ou utiliser des gouttes oculaires peut influencer le diagnostic. C’est pourquoi il est préférable de réaliser le test le matin, sans manger ni boire pendant au moins 90 minutes avant le test.
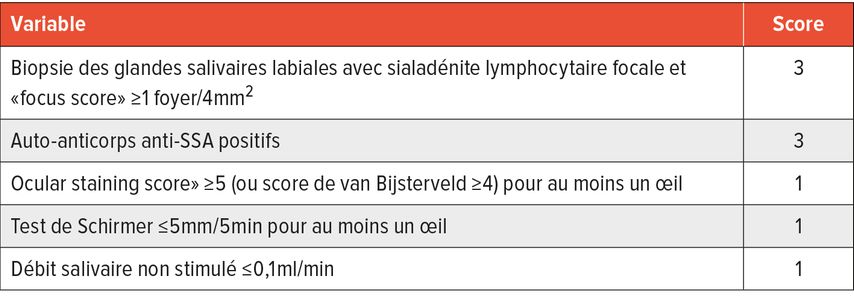
Outre les symptômes subjectifs et objectifs de syndrome sec, il convient de tenir compte d’éléments importants lors de l’anamnèse et du statut clinique en vue d’un large diagnostic différentiel (Tab. 3).
Tab. 3: Critères de classification ACR/EULAR pour le syndrome de Sjögren primitif. En cas (1) de réponse positive à au moins une des questions pour le syndrome sec (Tab. 1) ou de résultat positif pour au moins un domaine ESSDAI20, (2) de score ≥4 et (3) d’absence de critères d’exclusion, les critères sont remplis5
Un autre élément de diagnostic est le diagnostic de laboratoire, y compris la détermination des anticorps antinucléaires (ANA) caractéristiques. Dans ce cas, une recherche d’ANA, d’auto-anticorps anti-SSA (52/60kDa) et anti-SSB, et de facteur rhumatoïde est utile en plus d’une numération formule sanguine et d’un bilan urinaire. Il faut tenir compte du fait qu’un titre élevé d’ANA peut être détecté chez environ 20% et que les anti-SSA sont présents chez environ 3% de la population normale.10–14 Le titre doit être pris en considération lors de l’interprétation de la pertinence du résultat.
Le syndrome de Sjögren est la deuxième maladie auto-immune la plus fréquente après la polyarthrite rhumatoïde et se manifeste principalement chez les femmes autour de la cinquantaine ou de la soixantaine. Il existe cependant aussi des formes juvéniles. Les auto-anticorps anti-SSA peuvent être détectés dans environ 60 à 80% des cas, les facteurs rhumatoïdes dans environ 30 à 60% des cas.8,10,13,14 Si le facteur rhumatoïde est positif, il y a souvent aussi une hypergammaglobulinémie polyclonale pour les IgG.
D’autres maladies auto-immunes, telles que la polyarthrite rhumatoïde, le lupus érythémateux disséminé ou la sclérose systémique, peuvent être associées au syndrome de Sjögren. Un syndrome de chevauchement existe en présence de manifestations cliniques typiques et d’auto-anticorps spécifiques aux deux entités ou d’une biopsie des glandes salivaires positive. Les auto-anticorps anti-SSA/SSB (titre faible) sont souvent présents en tant qu’anticorps «associés» dans d’autres connectivites. Parmi les auto-anticorps anti-SSA, on distingue les anti-Ro60 (60kDa) des anti-Ro52 (52kDa). Ces derniers sont souvent observés en cas de myosites.
Pour délimiter les diagnostics différentiels, il est utile de déterminer des paramètres de laboratoire complémentaires dans le cadre du bilan initial, tels qu’une sérologie de l’hépatite et du VIH, une numération formule sanguine différentielle ou une électrophorèse des protéines avec immunofixation et dosage des chaînes légères. Chez les hommes atteints du syndrome sec et en particulier en cas d’affection des voies respiratoires supérieures (rhinosinusite, asthme bronchique), une maladie associée aux IgG4 doit être envisagée comme diagnostic différentiel et une classification des sous-classes d’IgG dans le sérum doit être effectuée.
Selon l’approche de Sherlock Holmes («A good detective never misses a clue»), l’évaluation des symptômes de syndrome sec comprend d’autres éléments en plus du diagnostic de syndrome sec et de laboratoire: l’imagerie en fait partie. L’échographie permettant de visualiser les glandes salivaires sous-mandibulaires et la glande parotide mérite d’être soulignée à cet égard. Un score est attribué en fonction de l’image du parenchyme, qui peut aller de la normalité à une diffusion inhomogène avec mise en évidence de zones anéchogènes/hypoéchogènes. Un score <2 est généralement moins suggestif d’un syndrome de Sjögren. Il convient de noter que d’autres maladies, telles que la sarcoïdose ou l’amylose, peuvent donner des résultats échographiques similaires à ceux du syndrome de Sjögren.10,15,16 La sialographie ou la scintigraphie ne sont généralement plus utilisées dans le diagnostic de routine. En présence d’un syndrome de Sjögren, il est recommandé de réaliser en complément une échographie des aires ganglionnaires, au moins cervicales.
La biopsie et l’histologie des glandes salivaires constituent une étape diagnostiquesupplémentaire pour délimiter un diagnostic différentiel, notamment en l’absence d’auto-anticorps anti-SSA. On observe typiquement une sialadénite lymphocytaire focale. Le «focus score» sert à quantifier l’accumulation de lymphocytes: un amas d’au moins 50 lymphocytes est considéré comme 1 foyer. Dans une zone d’au moins 8mm2, le nombre de foyers est indiqué par 4mm2. Un score ≥1 est considéré comme positif au sens du syndrome de Sjögren. Il convient de noter que des modifications histologiques compatibles avec le syndrome de Sjögren peuvent être mises en évidence chez environ 15% de la population normale.5,13,17 Outre les éléments de diagnostic, l’examen histopathologique permet d’établir un pronostic: un «focus score» ≥3 ou la présence de centres germinatifs sont associés au développement d’un lymphome.18,19
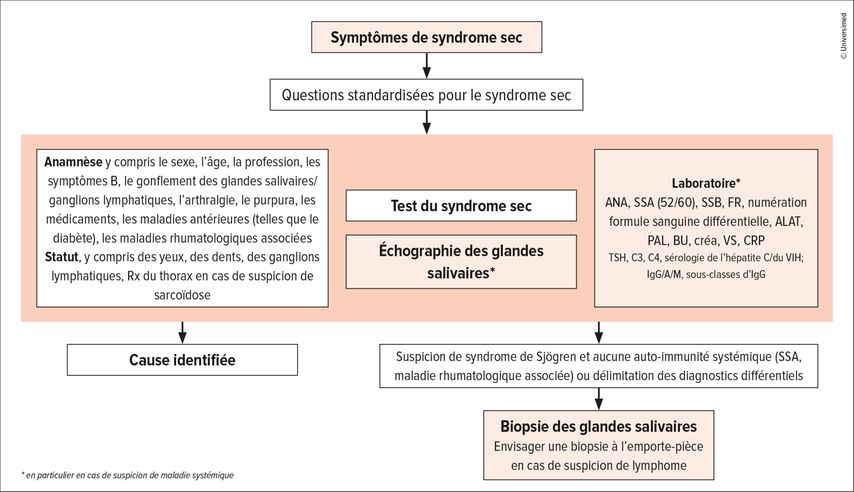
Les critères de classification ACR/EULAR 2016 pour le syndrome de Sjögren sont présentés dans le tableau 3.5 Dans la pratique clinique quotidienne, le diagnostic du syndrome de Sjögren doit tenir compte des éléments ci-dessus. La figure 1 montre une proposition de procédure de diagnostic en cas de symptômes de syndrome sec dans la vie quotidienne.
Fig. 1: Proposition de procédure en cas de symptômes de syndrome sec (ANA: anticorps antinucléaires; BU: bilan urinaire FR: facteur rhumatoïde; Rx: radiographie; VS: vitesse de sédimentation)
Pour en revenir à l’étude de cas décrite au début, vous savez que des modifications histopathologiques observées dans la biopsie des glandes salivaires labiales comme le «focus score» sont compatibles avec le syndrome de Sjögren. Vous savez cependant également que cette constatation n’est pas spécifique et qu’elle peut également être détectée dans la population normale. C’est pourquoi vous recommandez à la patiente d’ajouter d’autres éléments de diagnostic, comme un diagnostic de laboratoire ou une échographie des glandes salivaires, afin d’évaluer la présence d’un syndrome de Sjögren.
Littérature:
1 Thomas E et al.: Br J Rheumatol 1998; 37: 1069-76 2 Schein OD et al.: D Arch Intern Med 1999; 159: 1359-63 3 Schiffman RM et al.: Ophthalmology 2003; 110: 1412-9 4 Bezzina OM et al.: Arthritis Care Res 2017; 69: 1714-23 5 Shiboski CH et al.: 2Arthritis Rheumatol 2017; 69: 35-45 6 Stefanski AL et al.: Dtsch Arztebl Int 2017; 114: 354-61 7 Nocturne G, Mariette X: Nat Rev Rheumatol 2013; 9: 544-56 8 Aeby MM et al.: Swiss Med Forum 2017; 47: 1027-38 9 Mariette X, Criswell LS: N Engl J Med 2018; 378: 931-39 10 Witte T: Z Rheumatol 2019; 78: 511-7 11 Satoh M et al.: Arthritis Rheum 2012; 64: 2319-27 12 Pisetsky DS et al.: Autoimmun Rev 2019; 18: 102400 13 Brito-Zeron P et al.: Clin Exp Rheumatol 2022; 40: 2413-27 14 Hayashi N et al.: Mod Rheumatol 2008; 18: 153-60 15 Cornec D et al.: Arthritis Rheum 2013; 65: 216-25 16 Jousse-Joulin S et al.: Ann Rheum Dis 2019; 78: 967-73 17 Radfar L et al.: Arthritis Rheum 2002; 47: 520-4 18 Sene D et al.: Arthritis Rheumatol 2018; 70: 1481-8 19 Risselada AP et al.: Ann Rheum Dis 2014; 73: 1537-40 20 Seror R et al.: Ann Rheum Dis 2010; 69: 1103-9
Das könnte Sie auch interessieren:
Les conjugués anticorps-médicament ont le vent en poupe
Actuellement, de nombreux conjugués anticorps-médicament sont en cours d’évaluation dans le cancer du poumon. Qu’ils soient utilisés seuls ou en combinaison avec d’autres thérapies ...
Effets sur la santé ainsi que risques liés au travail posté et de nuit
Le travail posté et de nuit entraîne un risque accru de multiples problèmes de santé en raison de la perte de sommeil et de la désynchronisation circadienne. Il s’agit notamment de ...
Les défis des interfaces interdisciplinaires
Face à un éventail croissant d’options ciblées et immunothérapeutiques, les tests moléculaires sont de plus en plus au centre de l’attention dans les tumeurs gastro-intestinales. Des ...