Stratégies futures et objectifs thérapeutiques en cas de MICI
Compte-rendu:
Regina Scharf, MPH
Rédactrice
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Avec les médicaments de plus en plus sélectifs ciblant la colite ulcéreuse et la maladie de Crohn, les objectifs thérapeutiques tels que la cicatrisation transmurale ou histologique sont atteignables. En combinant des substances actives hautement sélectives, on espère briser le plafond thérapeutique qui empêchait jusqu’à présent une augmentation du taux de rémission.
La disponibilité de nouveaux médicaments sélectifs a un impact sur les objectifs thérapeutiques en cas de maladies inflammatoires chroniques de l’intestin (MICI). Outre les objectifs à court terme, tels qu’une rémission symptomatique et une réponse thérapeutique, une rémission endoscopique à long terme est aujourd’hui possible.1 Une cicatrisation transmurale ou histologique peut déjà être obtenue chez certains patients atteints de maladie de Crohn (MC) ou de colite ulcéreuse (CU).
Hormis les objectifs thérapeutiques cliniques, les «patient-reported outcomes» (PRO), c’est-à-dire la déclaration des symptômes et l’évaluation de la qualité de vie par le patient, ont gagné en importance. La normalisation de la qualité de vie est mentionnée comme l’un des principaux objectifs thérapeutiques en cas de MICI dans les recommandations STRIDE II. «Les PRO devraient être documentés pour chaque patient atteint de MICI», a déclaré le Prof. Dr méd. Axel Dignass, Agaplesion Markus Krankenhaus de l’Université Johann Wolfgang Goethe de Francfort-sur-le-Main. Le spécialiste a souligné que les patients atteints de MICI présentaient souvent une qualité de vie nettement réduite, même pendant la période de rémission de la maladie, en raison de symptômes résiduels et d’un traitement non optimal.2 Un PRO important chez ces patients est le besoin d’aller à la selle («bowel urgency»), mais on dispose jusqu’à présent seulement d’informations limitées sur le sujet. Dans le cadre de l’étude CONFIDE, une grande enquête lors de laquelle des patients et des médecins aux États-Unis, en Europe et au Japon ont été interrogés sur leur expérience avec les MICI, plus de 50% des patients atteints de CU modérée à sévère ont cité la diarrhée et le besoin d’aller à la selle comme étant les principaux problèmes liés à leur maladie.3 L’étude a également révélé que 46% des patients portaient des couches ou d’autres protections au moins une fois par mois par crainte d’une perte incontrôlée de selles. A. Dignass a donc recommandé de prendre en compte le «besoin d’aller à la selle» comme critère d’évaluation dans les études cliniques.
Aucune stratégie de sortie
Non seulement l’instauration du traitement, mais aussi la fin de la prise régulière de médicaments peuvent avoir un impact positif sur la qualité de vie des patients atteints de MICI. «Les stratégies de sortie font toutefois rarement l’objet d’études financées par l’industrie», a déclaré le spécialiste. L’étude SPARE, financée par différentes sociétés spécialisées et dont les résultats ont été présentés au congrès de l’European Crohn’s and Colitis Organisation (ECCO), a fourni des informations importantes à ce sujet. Elle a comparé le taux de récidive à deux ans chez des patients atteints de MC traités pendant plus de huit mois par l’infliximab (IFX) en association avec un antimétabolite (méthotrexate ou thiopurine) et chez lesquels le traitement par l’IFX ou l’antimétabolite avait été arrêté ou le traitement combiné avait été poursuivi, après une période de rémission de plus de six mois sans stéroïdes. Il a été démontré que l’arrêt de l’antimétabolite était relativement sûr par rapport à celui du traitement combiné (taux de récidive à 2 ans de 10% vs 14%), tandis que le taux de récidive après l’arrêt de l’IFX augmentait nettement (40%).4
Un taux de récidive tout aussi élevé après l’arrêt du traitement par des anticorps anti-TNF-α (AC anti-TNF) a également été mis en évidence par une étude néerlandaise chez des patients sélectionnés atteints de MICI et présentant un faible risque de récidive. L’étude, qui visait à développer une stratégie de sortie stratifiée en fonction du risque pour le traitement anti-TNF, n’a pas pu identifier de marqueurs prédictifs pour une désescalade thérapeutique personnalisée.5
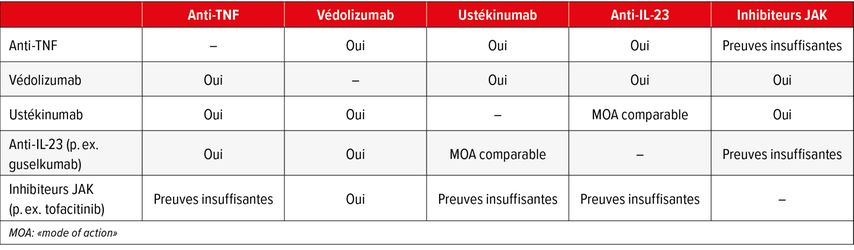
Le traitement des patients atteints de MICI reste un défi. L’objectif est d’augmenter encore les taux de rémission actuels de 30% à 52% maximum afin d’obtenir une cicatrisation transmurale ou histologique, voire moléculaire à l’avenir. Différentes approches sont discutées pour l’atteindre. On compte parmi elles l’association de médicaments hautement sélectifs et de plus en plus répandus (Tab. 1).6 Un traitement sur mesure des patients constituerait une autre étape importante pour améliorer les taux de rémission. Bien que des recherches soient menées depuis plus de 10 ans sur la «signature» inflammatoire, aucun facteur permettant de stratifier les risques et de mettre en place ensuite un traitement personnalisé n’a été identifié jusqu’à présent. La meilleure compréhension de l’«interactome MICI», dont font partie le génome, le microbiome, l’immunome et l’exposome, etc., ouvre en outre la voie à d’autres options thérapeutiques.
Tab. 1: Associations thérapeutiques avancées possibles en cas de MICI (adaptées de Danese et al., 2022)6
Médicaments en cas de MICI
Combien d’informations une mise à jour thérapeutique de 480 secondes peut-elle contenir? Beaucoup, surtout si elles sont présentées tel un feu d’artifice. Nous avons synthétisé les exposés de 8 minutes et, comme dans la vraie vie, nous commençons par les substances qui ont fait leurs preuves.
Stéroïdes et budésonide
Les stéroïdes sont utilisés depuis 60 ans chez les patients atteints de MICI afin d’obtenir une rémission. L’ECCO recommande de traiter une MC active légère à modérée touchant uniquement l’iléon et/ou le côlon ascendant par le budésonide.7 Une dose de 9mg de budésonide est suffisante pour induire une rémission clinique. Le traitement à une dose de 15mg de budésonide n’a aucun effet thérapeutique supplémentaire.8 La libération du budésonide varie selon les modes d’administration, c’est donc un aspect à prendre en compte dans le choix du médicament pour le traitement de la MC et de la CU. Chez les patients atteints de MC modérée à sévère, l’ECCO recommande un traitement par des corticostéroïdes systémiques.7 Ce dernier entraîne une réponse thérapeutique et une rémission cliniques. Cependant, les effets indésirables liés au traitement exigent souvent l’arrêt de la prise.9 Le schéma de réduction des stéroïdes fait l’objet de nombreux débats. La dose de stéroïdes est généralement réduite de 5mg par semaine parallèlement à l’instauration du traitement d’entretien par l’IFX. Une étude de différents schémas de réduction (réduction standard: <5mg/semaine, réduction rapide: >5mg/semaine, interruption directe) chez des patients atteints de CU a démontré que la vitesse de réduction n’avait aucun impact sur l’efficacité du traitement par l’IFX, à l’exception du sous-groupe des patients atteints de colite ulcéreuse aiguë sévère. La réduction standard a entraîné des taux de CRP plus faibles et une meilleure réponse clinique chez ces patients.10 Les «small molecules», telles que les inhibiteurs de Janus kinase (inhibiteurs JAK), sont de plus en plus souvent utilisées pour traiter la CU. Leur utilisation en association avec un traitement de base par des stéroïdes n’est pas recommandée, car cela n’a aucun effet positif sur l’efficacité selon une étude récente, mais les risques de sécurité augmentent.11
5-ASA
Plusieurs méta-analyses confirment que les 5-ASA constituent un traitement efficace pour induire une rémission et prévenir les récidives chez les patients atteints de CU.12,13 Les données disponibles pour la MC sont plus complexes. Alors que l’ECCO ne recommande pas l’utilisation des 5-ASA pour obtenir une rémission de la MC, une étude suisse révèle qu’ils sont fréquemment utilisés, parfois avec succès, en cas de MC.7,14 Depuis le début de l’ère des substances biologiques, la question suivante est très débattue: faut-il ou non arrêter le traitement par des 5-ASA en cas d’escalade thérapeutique avec une substance biologique? Une analyse a mis en évidence le fait que la poursuite du traitement par des 5-ASA n’a aucun autre effet positif sur le résultat clinique dans ce cas.15 Selon une revue récente, une chimioprévention supplémentaire par des 5-ASA est obsolète chez les patients atteints de CU et qui reçoivent un traitement, par exemple des substances biologiques ou des «small molecules», conduisant à une cicatrisation de la muqueuse.16 Une étude récente de la cohorte MICI danoise montre que la prise de 5-ASA par le père pendant la conception et par la mère pendant la grossesse semble être sûre.17
Thiopurines
L’expérience avec les thiopurines immunosuppressives, telles que l’azathioprine (AZA), dans le traitement des MICI a été acquise sur plus de 60 ans. Ce traitement est peu coûteux et relativement sûr, à condition de tenir compte des risques individuels. L’ECCO recommande le traitement par l’AZA pour le maintien de la rémission chez les patients atteints de MC stéroïde-dépendante ou en monothérapie pour le maintien de la rémission chez les patients atteints de CU stéroïde-dépendante ou présentant une intolérance aux 5-ASA. Une monothérapie par l’AZA n’est pas recommandée pour induire une rémission en cas de MC et de CU.7 Dans les essais randomisés contrôlés SONIC et US SUCCESS chez des patients atteints de MC et de CU et naïfs de biothérapie, le traitement associant l’AZA et l’IFX a induit une meilleure rémission sans stéroïdes que les deux monothérapies.18,19 Jusqu’à présent, cet effet a uniquement été démontré en association avec l’IFX, mais pas avec l’adalimumab, le golimumab, le védolizumab ou l’ustékinumab. Les thiopurines ont un effet modéré sur le maintien d’une rémission induite par la chirurgie chez les patients atteints de MC. Elles ne jouent en revanche aucun rôle en cas de MC avec fistules. Le traitement par des thiopurines entraîne souvent des effets indésirables, par exemple des symptômes gastro-intestinaux, une hépatotoxicité, une pancréatite ou une leucopénie. Ces réactions pouvant être aussi bien dose-dépendantes qu’idiosyncrasiques, une surveillance thérapeutique des médicaments est recommandée. Le traitement par des thiopurines augmente également le risque d’infections, de maladies lymphoprolifératives et de cancers de la peau non-mélanomes.
AC anti-TNF-α et substances biosimilaires
Les substances biosimilaires sont aujourd’hui de plus en plus souvent utilisées pour traiter les MICI au lieu des deux AC anti-TNF, à savoir l’adalimumab (ADA) et l’IFX. Le passage de la substance originale à cette substance se fait généralement sans grandes difficultés. On constate toutefois régulièrement des «switchbacks», c’est-à-dire un retour à la substance originale. Une étude récente a révélé que le nombre de «switchbacks» annuels, toutes spécialités thérapeutiques confondues, s’élevait à 14%, ce qui est beaucoup plus fréquent qu’on ne le pensait. Ces «switchbacks» ont été observés le plus souvent chez des patients qui avaient interrompu leur traitement par des substances biosimilaires (62%).20 Pour éviter les effets nocebo potentiels, les interruptions de traitement et les «switchbacks», il convient d’informer les patients en détail avant tout passage à une substance biosimilaire.
Le CT-P13 (Veblocema™), une nouvelle substance biosimilaire de l’IFX administrée par voie sous-cutanée (SC), est autorisé en Suisse depuis l’année dernière. La comparaison indirecte du CT-P13 SC par rapport à IV et de la substance originale (IFX) chez des patients atteints de polyarthrite rhumatoïde a mis en évidence une amélioration significative des indices d’activité étudiés et a lancé un débat sur les différences pharmacocinétiques.21 Toutefois, on ignore encore si la formulation SC présente de réels bénéfices en termes d’action et d’immunogénicité par rapport à la formulation IV. Le nombre de substances biosimilaires de l’ADA augmente également. Une différence importante entre les substances biosimilaires de l’ADA disponibles réside dans les excipients acides utilisés. Ils influencent les effets indésirables, tels que l’apparition de douleurs lors de l’injection.
Méthotrexate
De fortes doses de méthotrexate (MTX), un antagoniste de l’acide folique, ont un effet cytotoxique et antiprolifératif, et sont mutagènes ainsi que tératogènes. Aux doses faibles généralement utilisées en cas de MICI, le MTX a un effet anti-inflammatoire et immunomodulateur. Ce dernier a été fabriqué pour la première fois en 1947 et figure sur la liste des médicaments essentiels de l’OMS. Le nombre d’études portant sur cette substance est limité. La justification de l’utilisation du MTX en cas de MC a été fournie par une étude de 1995, qui a montré que le traitement par le MTX (25mg/semaine IM) induisait une rémission clinique chez deux fois plus de patients que le traitement de comparaison par le placebo (39,4% vs 19,1%; p=0,025).22 Le suivi sur cinq ans a montré que 65% des patients ayant reçu un traitement d’entretien à une dose de 15mg/semaine IM étaient en rémission par rapport à 39% sous placebo.23 Des études confirment que l’administration SC permet également d’induire une rémission, mais pas l’administration PO. Les résultats de l’étude MERIT-UC révèlent que la monothérapie par le MTX ne constitue pas une option thérapeutique en cas de CU.24 En revanche, les résultats de l’étude CD-COMMIT portant sur le traitement d’entretien combiné par l’IFX et le MTX chez des patients atteints de MC sont intéressants. Cette étude a mis en évidence le fait que les patients traités également par le MTX présentaient des taux d’IFX plus élevés et produisaient moins d’anticorps contre l’AC anti-TNF, malgré la perfusion d’hydrocortisone avant chaque traitement par l’IFX.25
Tacrolimus
Cet inhibiteur de la calcineurine (iCN) bloque la transcription des gènes codant pour des cytokines, telles que l’interleukine-2, le TNF-α et l’interféron-γ, et inhibe l’activation ainsi que la prolifération des lymphocytes T. Le tacrolimus est disponible en formulation orale. Son action est rapide et 10 à 100 fois plus puissante que celle de la ciclosporine A. Les deux iCN, à savoir la ciclosporine A et le tacrolimus, sont utilisés comme «traitement de secours» chez les patients atteints de CU résistante aux stéroïdes.7 Environ 10–15% des patients atteints de CU connaissent un épisode fulminant au cours de l’évolution de la maladie, et environ 30% d’entre eux ne présentent aucune réaction au traitement par des stéroïdes. L’indication la plus fréquente d’une colectomie est l’activité non contrôlée de la maladie. Les meilleures preuves appuyant l’utilisation du tacrolimus proviennent de précédents essais randomisés contrôlés. L’un de ces essais a montré que le taux de réponse clinique était de 50% chez les patients atteints de CU résistante aux stéroïdes modérée à sévère par rapport au placebo. Le traitement par le tacrolimus a permis d’obtenir une cicatrisation de la muqueuse chez environ 44% des patients et une rémission clinique chez 9,4% d’entre eux.26 Une méta-analyse a également révélé des taux élevés de réponse clinique et d’absence de colectomie sans risque accru d’effets indésirables graves chez les patients atteints de CU active sous tacrolimus.27 La comparaison du tacrolimus par rapport à l’IFX en cas de CU modérée à sévère ainsi que de la ciclosporine A par rapport à l’IFX chez les patients atteints de colite ulcéreuse aiguë sévère n’a mis en évidence aucune différence significative en termes d’efficacité.28,29 Il convient de contrôler la concentration sérique et d’ajuster la dose pendant le traitement par les iCN. En raison de sa néphrotoxicité et de sa neurotoxicité, le traitement doit être pris sur une durée maximale de six mois. Une garantie de prise en charge des coûts est nécessaire en Suisse pour le traitement de la CU par le tacrolimus.
Transplantation du microbiote fécal
Alors que la recherche sur la transplantation du microbiote fécal (TMF) a beaucoup avancé au cours des cinq dernières années, l’application pratique de ces progrès chez les patients atteints de CU s’est heurtée à des obstacles réglementaires jusqu’à présent. En Suisse, le transplant de microbiote fécal est considéré comme un dispositif médical non standardisé, c’est pourquoi une autorisation de l’autorité d’autorisation et de contrôle des produits thérapeutiques est nécessaire. La procédure n’est pas seulement compliquée, elle est aussi coûteuse: selon une estimation du Centre Hospitalier Universitaire de Lausanne, le coût du traitement s’élève à environ CHF 15000.–. La TMF peut avoir lieu par lavement dans le cadre d’une coloscopie, au moyen d’une sonde ou sous forme de gélules. Le mécanisme d’action exact n’a pas encore été clairement établi.
Au sein de l’UE, la TMF est pratiquée dans différents centres. En 2019, près de 2000 TMF ont été réalisées dans l’UE dans le cadre d’études cliniques, dont plus de la moitié pour traiter des infections à Clostridioides difficile.30 Son efficacité pour cette indication est comprise entre 85 et 90%: elle prévient les récidives et peut s’avérer plus efficace qu’une antibiothérapie.31 Le traitement de la CU a été étudié dans le cadre de sept essais randomisés contrôlés avec des protocoles d’étude très différents. Sur l’ensemble des études, la TMF a induit une rémission clinique et endoscopique chez environ 30% des patients.32,33 On dispose encore seulement de données limitées sur l’utilisation de la TMF chez les patients atteints de MC. Différentes stratégies sont discutées pour améliorer l’efficacité de la TMF, par exemple la sélection des donneurs, la réalisation de la TMF à partir de dons groupés, l’utilisation répétée de la TMF et le traitement préalable des receveurs par des antibiotiques. La TMF peut entraîner des effets indésirables: outre des symptômes tels que des crampes, des saignements et la survenue de poussées, des décès liés à la TMF ont également été rapportés.
Védolizumab
Les études sur l’efficacité du védolizumab, un AC monoclonal humanisé, chez les patients atteints de CU et de MC remontent à environ 10 ans.34,35 Diverses analyses rétrospectives et données du monde réel sont depuis venues compléter le tableau. Une méta-analyse d’études du monde réel publiée en 2018 confirme ainsi qu’environ un tiers à la moitié des patients atteints de CU ou de MC modérée à sévère et traités par le védolizumab étaient en rémission après 12 mois.36
En raison de son action comparable et de son profil d’innocuité plus avantageux que celui de l’adalimumab, l’ECCO recommande de privilégier le védolizumab pour le traitement d’induction et d’entretien chez les patients atteints de CU active modérée à sévère.7 Sur la base des résultats de deux études comparatives indirectes, elle conseille d’utiliser un traitement par le védolizumab ou l’ustékinumab chez les patients atteints de MC active modérée à sévère qui ne répondent pas au traitement par des AC anti-TNF.7 Des données récentes indiquent toutefois que l’ustékinumab pourrait être plus avantageux que le traitement par le védolizumab en termes d’induction et de maintien de la rémission chez les patients atteints de MC résistante aux AC anti-TNF.37 Le passage d’une administration IV à SC de védolizumab était sûr chez les patients atteints de CU ou de MC.38,39
Ustékinumab et au-delà
L’ustékinumab, un AC anti-IL-12/23, est autorisé pour le traitement des patients atteints de MC ou de CU active modérée à sévère et résistante au traitement. Les données actuelles de l’étude sont tirées de l’étude d’extension à long terme UNIFI menée sur trois ans. Elles ont montré que, respectivement, 51% et 55% des patients atteints de CU et traités par l’ustékinumab (90mg SC) toutes les 12 ou 8 semaines étaient toujours en rémission symptomatique sans stéroïdes.40 Les taux de rémission étaient plus élevés chez les patients naïfs de traitement biologique que chez les patients ayant déjà reçu un traitement préalable. L’étude n’a mis en évidence aucun nouveau signal d’innocuité. L’absence de données sur le traitement des patients âgés atteints de MICI par l’ustékinumab est problématique. Quelques informations sur la sécurité ont été fournies par une étude comparant les deux substances biologiques védolizumab ou ustékinumab et le traitement par des AC anti-TNF chez des patients atteints de MC. Elle a révélé moins d’infections graves sous traitement par l’ustékinumab que par un AC anti-TNF ou par le védolizumab.41 Les résultats d’une étude sur des patients âgés de ≥60 ans atteints de MICI publiée récemment ont montré une action et une sécurité comparables de l’ustékinumab par rapport au védolizumab.42 Le traitement par l’ustékinumab a entraîné des infections des voies respiratoires supérieures et des arrêts de traitement un peu plus fréquemment que le védolizumab. Outre l’ustékinumab, d’autres AC anti-IL-23 devraient être autorisés à l’avenir pour traiter les MICI. Actuellement, plusieurs études de phase III évaluent les AC anti-IL-23 brazikumab, risankizumab et mirikizumab chez des patients atteints de CU et de MC, ainsi que le guselkumab en cas de MC.
Tofacitinib
Seul le tofacitinib, un inhibiteur sélectif des Janus kinases 1–3 (inhibiteurs JAK), est actuellement autorisé en Suisse pour le traitement des patients atteints de CU. L’action du tofacitinib en cas de CU a été confirmée lors des études OCTAVE Induction 1 et 2 ainsi que de l’étude OCTAVE Sustain. Elles ont révélé que le tofacitinib (10mg 2x par jour) a entraîné une rémission chez 18,5% et 16,6% des patients après 8 semaines, par rapport à 8,2% et 3,6% sous placebo. Les taux de rémission après 52 semaines de traitement d’entretien à une dose de 5mg ou 10mg de tofacitinib 2 fois par jour ou par le placebo étaient de 34,3%, 40,6% et 11,1%, respectivement.43 Également appelés «small molecules», les inhibiteurs JAK sont disponibles en formulation orale et se caractérisent par une action rapide.
En raison de l’incidence accrue d’événements thromboemboliques liés au traitement de la polyarthrite rhumatoïde (PR) par le tofacitinib, l’Agence européenne des médicaments (EMA) et Swissmedic ont mis en garde l’année dernière contre la survenue d’embolies pulmonaires et de décès chez les patients âgés de >50 ans présentant des facteurs de risque cardiovasculaire.44 Il est important de mentionner que l’incidence d’événements thromboemboliques chez les patients atteints de PR avait augmenté avec la dose. Il convient donc de ne pas prendre de fortes doses sur une période prolongée en cas de bonne réponse. Une analyse des données du système national français des données de santé (SNDS) a fourni des informations intéressantes sur les complications. Elle a montré que 92 patients avaient souffert d’une thromboembolie veineuse (TEV) ou artérielle (TEA) sur les 5870 traités par un inhibiteur JAK (baricitinib ou tofacitinib) entre janvier 2017 et fin juin 2019. La TEV et la TEA étaient survenues en moyenne 4,6 mois et 6,1 mois, respectivement, après l’instauration du traitement par des inhibiteurs JAK.45 Selon l’étude, le risque de thromboembolie reste élevé pendant 30 jours après l’arrêt du traitement, puis il se normalise.
Les autorités de contrôle des médicaments recommandent de n’utiliser les inhibiteurs JAK chez les patients suivants que si aucun traitement alternatif n’est disponible: âgés de ≥65 ans, fumeurs ou anciens fumeurs à long terme, présentant un risque accru d’événements cardiovasculaires, de cancer, de thromboembolie veineuse.
Ozanimod
L’ozanimod, un modulateur du récepteur de la sphingosine-1-phosphate (SP1), empêche la migration des lymphocytes T et B dans le tissu intestinal enflammé. La réduction des lymphocytes dans la circulation périphérique a également un impact sur les sous-populations de lymphocytes, en affectant principalement les cellules de la réponse immunitaire adaptative. L’ozanimod semble avoir des effets seulement limités sur les cellules de la réponse immunitaire innée.46 L’action de l’ozanimod a été évaluée dans l’étude TRUE-NORTH chez >1000 patients atteints de CU active modérée à sévère, dont la plupart avaient reçu un traitement préalable par des stéroïdes, une partie par des 5-ASA et environ 40% par des AC anti-TNF.47 Les résultats ont mis en évidence une rémission clinique chez 18,4% des patients sous ozanimod (1mg de chlorhydrate d’ozanimod 1x par jour) et 6% des patients sous placebo (p<0,001) au cours de la phase d’induction de 10 semaines. Les patients présentant une réponse au traitement par l’ozanimod ont ensuite été randomisés pour recevoir un traitement d’entretien de 52 semaines (1mg d’ozanimod 1x par jour) ou un placebo. Le taux de rémission obtenu par la suite était significativement plus élevé sous ozanimod (37%) que sous placebo (18%; p<0,001). Le taux de réponse clinique était significativement plus élevé que sous placebo, pendant la phase d’induction comme pendant la phase d’entretien. Un plus grand nombre d’infections, telles que les rhinopharyngites et les infections des voies respiratoires supérieures, a été observé sous traitement par l’ozanimod. Le nombre d’infections sévères était comparable à celui sous placebo. On a en outre constaté une augmentation de l’incidence des valeurs hépatiques élevées et une réduction du nombre absolu de cellules lymphocytaires sous ozanimod.
L’ozanimod ne doit être utilisé ni pendant la grossesse et l’allaitement ni en cas de diverses maladies, notamment les maladies pulmonaires sévères, la cirrhose du foie, les tumeurs malignes, les infections actives et les antécédents d’œdème maculaire. Une grande prudence est de mise chez les patients souffrant de maladies cardiaques et de troubles du rythme cardiaque. Il convient de réaliser différents examens avant d’instaurer un traitement par l’ozanimod, par exemple un ECG, un test de la fonction hépatique, une consultation ophtalmologique, etc. Aucune donnée sur le traitement de la MC par l’ozanimod n’est disponible à ce jour. L’étrasimod est un autre modulateur du récepteur S1P étudié en cas de CU et de MC.
Source:
IBDnet, 8th Postgraduate Course in IBD, du 1er au 3 décembre 2022, Ermatingen
Littérature:
1 Turner D et al.: Gastroenterology 2021; 160: 1570-83 2Dubinsky MC et al.: Inflamm Bowel Dis 2021; 27: 1747-55 3 Panaccione R et al.: Gastroenterology 2022; 162 (Suppl): S-688 4 Louis E et al.: Withdrawal of infliximab or anti-metabolite therapy in Crohn’s Disease patients in sustained remission on combination therapy: a randomized unblinded controlled trial (SPARE). ECCO 16–19 février 2022 5 Savelkoul E et al.: Anti-TNF withdrawal according to a risk-stratified protocol does not reduce the risk of relapse in patients with inflammatory bowel disease in endoscopic remission: a prospective study. ECCO 16–19 février 2022 6 Danese S et al.: Gut 2022; 71: 2380-7 7 Torres J et al.: J Chrons Colitis 2020; 14: 4-22 8 Rezaie A et al.: Cochrane Database Syst Rev 2015; 6: CD000296 9 Benchimal EI et al.: Cochrane Database Syst Rev 2008; 2: CD006792 10 Ovesen PD et al.: The influence of different prednisolone tapering algorithms on the effectiveness of infliximab in patients with ulcerative colitis – A real-world cohort study. ECCO 16.–19. Februar 2022 11 Raine T et al.: Impact of corticosteroid usage on efficacy and safety outcomes in patients receiving upadacitinib for ulcerative colitis. ECCO 16–19 février 2022 12 Ford AC et al.: Am J Gastroenterol 2011; 106: 601-16 13 Barberio B et al.: J Crohns Colitis 2021; 15: 1184-96 14 Schoepfer AM et al.: Aliment Pharmacol 2014; 40: 930-37 15 Singh S et al.: Am J Gastroenterol 2018; 113: 1197-205 16 Herfarth H, Vavricka SR:Inflamm Intest Dis 2021; 7: 28-35 17 Norgard BM et al.: Aliment Pharmacol Ther 2022; 56: 1349-60 18 Colombel JF et al.: N Engl J Med 2010; 362: 1383-95 19 Panaccione R et al.: Gastroenterology 2014; 146: 392-400 20 Liu Y et al.: Adv Ther 2022; 39: 3711-34 21 Combe B et al.: Arthritis Res Ther 2021; 23: 119 22 Feagan BG et al.: N Engl J Med 1995; 332: 292-7 23 Feagan BG et al.: N Engl J Med 2000; 342: 1627-32 24 Herfarth H et al.: Gastroenterology 2018; 155: 1098-108 25 Feagan BG et al.: Gastroenterology 2014; 146: 681-8 26 Ogata H et al.: Inflamm Bowel Dis 2012; 18: 803-8 27 Komaki Y et al.: J Crohns Colitis 2016; 10: 484-94 28 Yamagami H et al.: Rom J Intern Med 2017; 55: 151-7 29 Williams JG et al.: Lancet 2016; 1: 15-24 30Baunwall SM et al.: Lancet Reg Health Eur 2021; 9: 100181 31 Ott SJ et al.: Gastroenterology 2017; 152: 799-811 32 Haifer C et al.: Lancet Gastroenterol Hepatol 2021; 2022; 7: 141-51 33Costello SP et al.: JAMA 2019; 321: 156-64 34 Feagan BG et al.: N Engl J Med 2013; 369: 699-710 35 Sandborn WJ et al.: N Engl J Med 2013; 369: 711-21 36 Schreiber S et al.: J Gastroenterol 2018; 53: 1048-64 37 Townsend T et al.: Aliment Pharmacol Ther 2020; 52: 1341-52 38 Sandborn WJ et al.: Gastroenterology 2020; 158: 562-72 39 Vermeire S et al.: J Crohns Colitis 2022; 2022; 16: 27-38 40 Abreu MT et al.: J Crohns Colitis 2022;16: 1222-34 41 Singh S et al.: Clin Gastroenterol Hepatol 2022; S1542-3565 42 Gebeyehu G et al.: Dig Dis Sci 2022. https://doi.org/10.1007/s10620-022-07770-8 43 Sandborn WJ et al.: N Engl J Med. 2017; 376: 1723-36 44 Ytterberg SR et al.: N Engl J Med 2022; 386: 316-26 45Gouverneur A et al.: Eur J Clin Pharmacol 2022; 78: 1981 46 Information professionnelle Ozanimod, mise à jourmai 2022. www.swissmedicinfo.ch 47 Sandborn WJ et al.: N Engl J Med 2021; 385: 1280-91
Das könnte Sie auch interessieren:
Les conjugués anticorps-médicament ont le vent en poupe
Actuellement, de nombreux conjugués anticorps-médicament sont en cours d’évaluation dans le cancer du poumon. Qu’ils soient utilisés seuls ou en combinaison avec d’autres thérapies ...
Effets sur la santé ainsi que risques liés au travail posté et de nuit
Le travail posté et de nuit entraîne un risque accru de multiples problèmes de santé en raison de la perte de sommeil et de la désynchronisation circadienne. Il s’agit notamment de ...
Les défis des interfaces interdisciplinaires
Face à un éventail croissant d’options ciblées et immunothérapeutiques, les tests moléculaires sont de plus en plus au centre de l’attention dans les tumeurs gastro-intestinales. Des ...