Pour ou contre la metformine pendant la grossesse
Auteures:
Dre méd. Michaela Kraigher-Krainer1
Prof. Dre méd. Susanne Kaser2
Prof. Dre méd. Bettina Toth1
1 Universitätsklinik für Gynäkologische Endokrinologie und Reproduktionsmedizin
Medizinische Universität Innsbruck
2 Universitätsklinik für Innere Medizin 1
Medizinische Universität Innsbruck
E-mail: bettina.toth@tirol-kliniken.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Le nombre de femmes souffrant déjà de diabète avant la grossesse, mais aussi le nombre de cas d’obésité et de diabète gestationnel pendant la grossesse augmentent constamment. Les recommandations générales préconisent l’insuline comme traitement antidiabétique pendant la grossesse. Toutefois, sur la base des données les plus récentes, l’utilisation de la metformine dans certains groupes à risque de femmes enceintes fait l’objet de discussions dans les directives de nombreuses sociétés spécialisées.
Keypoints
-
L’administration de metformine peut être envisagée chez les femmes en surpoids important afin d’éviter une prise pondérale excessive.
-
Un traitement par la metformine établi en présence d’un SOPK peut être poursuivi du moins au début de la grossesse (jusqu’à la fin du 1er trimestre).
-
La metformine constitue une option thérapeutique supplémentaire à l’insuline en cas de diabète gestationnel et permet en tant que traitement adjuvant une réduction de la dose d’insuline.
-
Le traitement par la metformine peut être poursuivi pendant la grossesse en cas de diabète de type 2 avéré.
-
Le traitement par la metformine doit être arrêté en cas de suspicion de petite taille pour l’âge gestationnel.
Au cours des 20 dernières années, le nombre de femmes enceintes souffrant de maladies constituant des facteurs de risque préconceptionnels telles que l’obésité, le diabète gestationnel (DG) ou le diabète de type 2 (DT2) a augmenté. Tout particulièrement les femmes atteintes de DT2 ont en partie commencé à prendre de la metformine avant la planification de la grossesse, car ce traitement est efficace, peu coûteux et sûr. La metformine est également fréquemment utilisée pour optimiser le cycle chez les patientes atteintes d’un syndrome des ovaires polykystiques (SOPK) ayant un désir d’enfant.1–3 La metformine fait partie du groupe des biguanides hypoglycémiants et induit une diminution de la glycémie basale et de la glycémie postprandiale.4,5
Dans ce contexte, l’effet repose sur trois mécanismes:2,6
-
Diminution de la production de glucose dans le foie par inhibition de la gluconéogenèse et de la glycogénolyse.
-
Augmentation de l’insulinosensibilité dans les muscles entraînant une amélioration de l’absorption et de l’utilisation du glucose périphérique.
-
Retard de l’absorption intestinale du glucose.
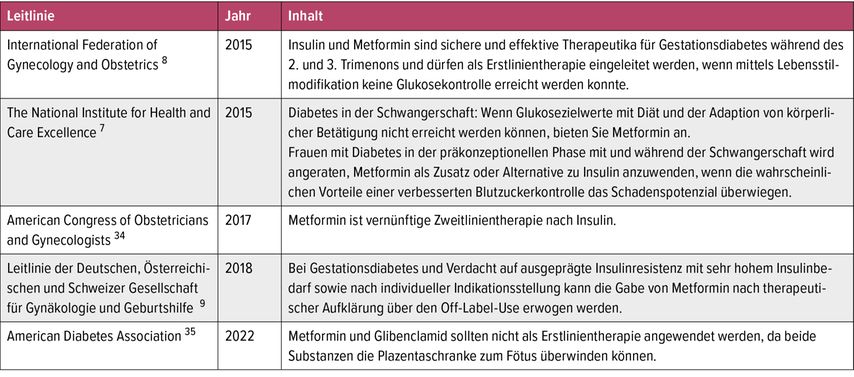
Les directives internationales (p.ex. du National Institute for Health and Care Excellence [NICE],7 de la Fédération internationale de gynécologie et d’obstétrique [FIGO],8 la directive S3 des Sociétés allemande, autrichienne et suisse de gynécologie et d’obstétrique9 [DGGG, OEGGG, SSGO]) préconisent l’utilisation ciblée de metformine pendant la grossesse pour certaines indications (Tab. 1). L’American Diabetes Association (ADA) recommande en revanche dans sa version actuelle (2022) de privilégier l’insuline par rapport à un traitement par la metformine en présence de DG.10
Les études réalisées jusqu’ici portant sur l’utilisation de la metformine pendant la grossesse ont rendu compte d’une prise pondérale maternelle plus faible, une réduction des besoins en insuline en présence de DT2 et une diminution du risque d’hypoglycémie néonatale et de macrosomie fœtale, notamment en comparaison avec un traitement par l’insuline.11,12 La metformine traverse toutefois le placenta et, à hautes doses, atteint le fœtus.13,14 Concernant l’enfant, il n’y a pas d’indices de malformations congénitales lors de la prise de metformine pendant la grossesse. Une étude actuelle indique néanmoins un risque accru de sous-poids fœtal par rapport à l’âge gestationnel (petite taille pour l’âge gestationnel) et de surpoids des enfants pendant l’enfance et l’adolescence.15,16 Même si les données à ce sujet sont encore peu nombreuses, ces résultats doivent déjà être abordés dans le cadre d’une analyse du rapport bénéfice/risque en phase préconceptionnelle.
L’insuline entraîne pendant la grossesse un nombre accru d’hypoglycémies maternelles et une prise pondérale maternelle excessive. Du point de vue des patientes, l’insulinothérapie est souvent, en outre, jugée comme étant moins facile à utiliser en raison de son mode d’administration.17
Les différents groupes à risque (obésité, DT2, DG, SOPK) sont présentés en détail dans ce qui suit.
Obésité
L’obésité est associée à des risques considérables pour la mère et l’enfant: notamment DG, apparition d’un DT2, macrosomie fœtale, y compris dystocie des épaules, et taux de césariennes élevé.2,18 L’effet de la metformine vs placebo sur l’état de la mère et de l’enfant a été évalué dans le cadre d’une étude randomisée et contrôlée (ERC) (étude EMPOWaR, 2015) incluant 400 femmes obèses (IMC ≥30kg/m2). Le traitement par la metformine a été instauré entre la 12e et la 16e semaine de grossesse et administré jusqu’à la naissance. Des modifications en termes de poids de naissance, de grande taille pour l’âge gestationnel, de taux de césariennes ou de taux d’hypertension artérielle gravidique (HTAG) n’ont pas été constatées. Au total, 18% des femmes sous metformine vs 24% dans le groupe placebo ont présenté un DG (n.s.).19
L’effet de la metformine chez des femmes enceintes non diabétiques a été évalué dans le cadre d’une ERC contre placebo (étude MOP, 2016) incluant également 400 femmes obèses (IMC >35kg/m2). Le groupe metformine présentait une prise pondérale maternelle plus faible (4,6kg vs 6,3kg) et une incidence plus faible de pré-éclampsies (3,0% vs 11,3%).20 Dans le cadre d’une autre ERC (étude GROW, 2018), 500 femmes en surpoids (IMC ≥25kg/m2) sous traitement par la metformine administrée du 1er ou 2e trimestre jusqu’à la naissance ont été comparées à un groupe placebo qui suivait des mesures diététiques. Des différences significatives n’ont pas été mises en évidence en termes de proportion des enfants ayant un poids de naissance supérieur à 4kg, de grande taille pour l’âge gestationnel/petite taille pour l’âge gestationnel ou d’incidence du DG. Un taux plus faible de césariennes a été observé dans le groupe metformine.21 Dans le cadre des études mentionnées, une observance de 60 à 80% sous traitement par la metformine a été relevée. Des effets secondaires sévères sont survenus uniquement dans de rares cas; des effets indésirables gastro-intestinaux majoritairement d’intensité légère ont été signalés.
Les études réalisées jusqu’ici révèlent un tableau hétérogène et ne permettent actuellement pas d’en déduire que l’utilisation systématique de metformine chez les femmes enceintes obèses est judicieuse.
Syndrome des ovaires polykystiques
Jusqu’à 20% de l’ensemble des femmes ayant un désir d’enfant sont atteintes d’un SOPK. Lors de la grossesse, en présence d’un SOPK, le risque de fausses couches, de DG, d’HTAG, de naissance prématurée et de petite taille pour l’âge gestationnel augmente.3,22,23 L’effet de la metformine a été évalué du 1er trimestre à la naissance en comparaison d’un placebo associé à des mesures diététiques dans le cadre d’une ERC (étude PregMet, 2010) incluant 274 femmes présentant un SOPK (IMC de 29kg/m2). Une réduction du risque de survenue de pré-éclampsie, de naissance prématurée, de macrosomie, de petite taille pour l’âge gestationnel ou de DG n’a pas pu être constatée dans le groupe metformine. La prise pondérale maternelle était toutefois significativement plus faible dans le groupe metformine.24
Dans le cadre d’une autre ERC de suivi (étude PregMet2, 2019), 487 femmes présentant un SOPK (IMC de 27kg/m2) sous traitement par la metformine ont été comparées à un groupe placebo. La metformine a été prise à partir de la 12e à la 23e semaine de grossesse jusqu’à la naissance. Un nombre comparable de cas de DG a été observé dans les deux groupes; une réduction de la prise pondérale maternelle a pu toutefois être constatée sous metformine.25 L’ADA recommande actuellement l’arrêt de ce traitement à la fin du premier trimestre de la grossesse en cas d’utilisation de la metformine pour induire une ovulation en présence d’un SOPK.10
Il est urgent de réaliser d’autres études, d’autant plus que la proportion de patientes obèses atteintes d’un SOPK est élevée et que la prise pondérale maternelle est associée à de nombreuses complications pendant la grossesse et lors de l’accouchement.
Diabète gestationnel
Une baisse de l’insulinosensibilité maternelle intervient dans jusqu’à 60% des cas à partir de la deuxième moitié de la grossesse. Un DG se manifeste en cas de compensation insuffisante.26,27 Les complications les plus importantes pendant et après la grossesse comprennent la pré-éclampsie, la grande taille pour l’âge gestationnel, un risque accru de survenue de dystocie des épaules ou la nécessité d’une césarienne et ultérieurement un risque de diabète chez la mère et l’enfant.15,28
L’étude MiG est jusqu’ici la recherche la plus importante concernant l’administration de metformine en présence de DG. Dans le cadre de cette étude randomisée, 751 femmes au total présentant un DG ont reçu un traitement par l’insuline ou la metformine entre la 20e et la 33e semaine de grossesse. Des hypoglycémies néonatales sévères ont été observées significativement plus rarement dans le groupe metformine (3,3% vs 8,1%). En outre, une réduction significative de la prise pondérale maternelle a pu être obtenue; toutefois, un taux plus élevé de naissances prématurées inexpliquées a été relevé sous metformine. Une administration supplémentaire d’insuline a été nécessaire au cours du traitement chez 46% des femmes sous metformine, néanmoins à une posologie plus faible qu’en cas d’administration d’insuline seule.17,29 Cette étude a été suivie d’une autre étude clinique randomisée évaluant la metformine vs insuline réalisée en 2021 chez 200 femmes présentant un DG. Une réduction de la prise pondérale maternelle sous metformine a été également mise en évidence dans le cadre de cette étude, tandis qu’un nombre accru d’épisodes hypoglycémiques sont survenus sous insuline. En outre, le taux de césariennes était significativement plus faible dans le groupe traité par la metformine en comparaison de l’insuline (27,6% vs 52,6%; p<0,05).30
Une méta-analyse de 2019 englobant 19 ERC a révélé que la metformine était associée à un taux plus faible de macrosomie et de grande taille pour l’âge gestationnel chez les femmes atteintes de DG.16 Toutes les études mentionnées soulignent le bénéfice obtenu grâce à la metformine. Chez les femmes présentant un DG et nécessitant un traitement médicamenteux, la metformine permet d’obtenir le même contrôle glycémique que l’insuline et le traitement est associé à une survenue plus faible d’épisodes hypoglycémiques, mais donne lieu à un niveau largement équivalent d’interventions obstétricales et périnatales. En raison des données à long terme limitées concernant les enfants de mères atteintes de DG et de l’effet retardé de la metformine, son utilisation est recommandée par les Sociétés nationales et internationales du diabète uniquement comme traitement adjuvant de l’insuline en présence de DG et d’insulinorésistance prononcée ou d’obésité.27,31 Ces limitations doivent être discutées avec la patiente avant l’instauration du traitement (notamment également l’usage off-label).
Diabète de type 2
Le risque de fausses couches, de pré-éclampsie, de naissance prématurée et de grande taille pour l’âge gestationnel est accru en présence de DT2. Malgré l’insulinothérapie, le risque de prise pondérale maternelle excessive et d’hyperglycémie néonatale est élevé.15 L’insuline a été comparée à une administration de metformine et à un placebo dans le cadre d’une étude multicentrique randomisée publiée en 2020 (étude MiT) incluant 502 femmes atteintes de DT2 et présentant un IMC de 35kg/m2. La prise pondérale maternelle et le taux de césariennes étaient plus faibles sous metformine. Les nouveau-nés avaient, de plus, un poids de naissance plus faible. Des taux significativement plus faibles de grande taille pour l’âge gestationnel et de macrosomie ont été observés, mais un nombre significativement plus élevé de petite taille pour l’âge gestationnel a été relevé (7% vs 13%; p<0,05).32
Une méta-analyse datant de 2021 englobant 21 ERC a confirmé l’effet et la sécurité de la metformine administrée seule ou comme adjuvant à l’insulinothérapie pendant la grossesse chez des patientes atteintes de DG et en présence de DT2 en phase préconceptionelle. Un poids de naissance plus faible et une proportion moins importante de nouveau-nés ayant un poids de naissance >4kg ont été mis en évidence dans le groupe metformine. Par ailleurs, le risque d’hypoglycémie néonatale et de prise en charge des nouveau-nés en unité de soins intensifs a pu être réduit parallèlement à la survenue accrue de petite taille pour l’âge gestationnel. En termes de mortalité périnatale, des différences significatives n’ont pas été constatées.33
En particulier les patientes atteintes de DT2 déjà prétraitées par la metformine semblent tirer profit de la poursuite du traitement par la metformine pendant la grossesse.
Résumé
Les avantages et les inconvénients potentiels pour la mère et l’enfant d’un traitement par la metformine administré pendant la grossesse doivent être évalués de manière individuelle en tenant compte des facteurs de risque existants. L’administration de metformine peut être envisagée chez les femmes en surpoids important présentant un IMC >35kg/m2, avec pour objectif d’éviter une prise pondérale excessive en cas de grossesse. Également en présence d’un SOPK, un traitement par la metformine, déjà instauré comme mesure d’aide à la procréation, peut être dans un premier temps poursuivi pendant la grossesse, en particulier en présence d’un IMC >30kg/m2 ou d’antécédents de fausses couches. La réalisation de l’épreuve d’hyperglycémie provoquée par voie orale doit être avancée et effectuée entre la 12e et la 14e semaine de grossesse afin de pouvoir, le cas échéant, passer précocement à un traitement par l’insuline. Un traitement par la metformine comme option thérapeutique complémentaire de l’insuline peut être envisagé en présence d’un DG associé à une obésité; dans ce cas, en particulier l’observance de la patiente doit également être prise en compte, dans la mesure où certaines patientes jugent que la manipulation de la metformine est plus simple. L’ajout de metformine à une insulinothérapie déjà en cours permet, en outre, de réduire éventuellement la dose. Les patientes présentant un DT2 avéré qui ont débuté une grossesse pendant le traitement par la metformine peuvent poursuivre le traitement par la metformine.
Toutes les patientes doivent être informées de l’usage off-label lors de l’instauration ou de la poursuite d’un traitement par la metformine pendant la grossesse. Les incertitudes concernant les mensurations anthropométriques futures des enfants et des adolescents doivent être à cette occasion abordées et les données disponibles à ce jour sur l’efficacité et la sécurité de la metformine, y compris le passage de la metformine dans le placenta, doivent être exposées. La metformine doit être arrêtée en cas de suspicion de petite taille pour l’âge gestationnel et ne doit pas être administrée lors d’une nouvelle grossesse en cas d’antécédents de petite taille pour l’âge gestationnel.15
Littérature:
1 Chen C et al.: Estimated global overweight and obesity burden in pregnant women based on panel data model. PLoS One 2018; 13: e0202183 2 Glueck CJ et al.: Metformin during pregnancy reduces insulin, insulin resistance, insulin secretion, weight, testosterone and development of gestational diabetes: prospective longitudinal assessment of women with polycystic ovary syndrome from preconception throughout pregnancy. Hum Reprod 2004; 19: 510-21 3 Ouyang H et al.: Research progress of metformin in gestational diabetes mellitus: a narrative review. Ann Palliat Med 2021; 10: 3423-37 4 Marshall SM: 60 years of metformin use: a glance at the past and a look to the future. Diabetologia 2017; 60: 1561-5 5 Ainuddin J et al.: Metformin versus insulin treatment in gestational diabetes in pregnancy in a developing country: a randomized control trial. Diabetes Res Clin Pract 2015; 107: 290-9 6 Owen MR et al.: Evidence that metformin exerts its anti-diabetic effects through inhibition of complex 1 of the mitochondrial respiratory chain. The Biochem J 2000; 348: 607-14 7 Webber J et al.: Diabetes in pregnancy: management of diabetes and its complications from preconception to the postnatal period (NG3). Br J Diabetes Vasc Dis 2015; 15: 107-11 8 Hod M et al.: The International Federation of Gynecology and Obstetrics (FIGO) Initiative on gestational diabetes mellitus: A pragmatic guide for diagnosis, management, and care. Int J Gynaecol Obstet 2015; 131: 173-211 9 Schäfer-Graf U et al.: Gestationsdiabetes mellitus (GDM), Diagnostik, Therapie und Nachsorge – Kurzfassung der S3-Leitlinie (AWMF-Registernummer: 057-008). Diabetologie und Stoffwechsel 2021; 16: 215-25 10 American Diabetes Association: Standards of medical care in diabetes—2022. Abridged for primary care providers. Clin Diabetes 2022; 40: 10-38 11 Balsells M et al.: Glibenclamide, metformin, and insulin for the treatment of gestational diabetes: a systematic review and meta-analysis. BMJ 2015; 350: h102 12 Silva JC et al.: Metformin compared with glyburide for the management of gestational diabetes. Int J Gynaecol Obstet 2010; 111: 37-40 13 Vanky E et al.: Placental passage of metformin in women with polycystic ovary syndrome. Fertil Steril 2005; 83: 1575-8 14 Charles B et al.: Population pharmacokinetics of metformin in late pregnancy. Ther Drug Monit 2006; 28: 67-72 15 Newman C, Dunne FP: Metformin for pregnancy and beyond: the pros and cons. Diabet Med 2022; 39: e14700 16 Tarry-Adkins JL et al.: Neonatal, infant, and childhood growth following metformin versus insulin treatment for gestational diabetes: A systematic review and meta-analysis. PLoS Med 2019; 16: e1002848 17 Rowan JA et al.: Metformin versus insulin for the treatment of gestational diabetes. N Engl J Med 2008; 358: 2003-15 18 Godfrey KM et al.: Influence of maternal obesity on the long-term health of offspring. Lancet Diabetes Endocrinol 2017; 5: 53-64 19 Chiswick C et al.: Effect of metformin on maternal and fetal outcomes in obese pregnant women (EMPOWaR): a randomised, double-blind, placebo-controlled trial. Lancet Diabetes Endocrinol 2015; 3: 778-86 20 Syngelaki A et al.: Metformin versus placebo in obese pregnant women without diabetes mellitus. N Engl J Med 2016; 374: 434-43 21 Dodd JM et al.: Effect of metformin in addition to dietary and lifestyle advice for pregnant women who are overweight or obese: the GRoW randomised, double-blind, placebo-controlled trial. Lancet Diabetes Endocrinol 2019; 7: 15-24 22 Homburg R: Pregnancy complications in PCOS. Best Pract Res Clin Endocrinol Metab 2006; 20: 281-92 23 Lo JC et al.: Increased prevalence of gestational diabetes mellitus among women with diagnosed polycystic ovary syndrome. Diabetes Care 2006; 29: 1915-7 24 Vanky E et al.: Metformin versus placebo from first trimester to delivery in polycystic ovary syndrome: a randomized, controlled multicenter study. J Clin Endocrinol Metab 2010; 95: E448-55 25 Løvvik TS et al.: Use of metformin to treat pregnant women with polycystic ovary syndrome (PregMet2): a randomised, double-blind, placebo-controlled trial. Lancet Diabetes Endocrinol 2019; 7: 256-66 26 Metzger BE et al.: International association of diabetes and pregnancy study groups recommendations on the diagnosis and classification of hyperglycemia in pregnancy. Diabetes Care 2010; 33: 676-82 27 Kautzky-Willer A et al.: Gestationsdiabetes (GDM) (Update 2019). Wien Klin Wochenschr 2019; 131: 91-102 28 Bao L et al.: Metformin versus insulin for gestational diabetes: a systematic review and meta-analysis. J Matern Fetal Neonatal Med 2021; 34: 2741-53 29 Hyer S et al.: Metformin in pregnancy: mechanisms and clinical applications. Int J Mol Sci 2018; 19: 1954 30 Picón-César MJ et al.: Metformin for gestational diabetes study: metformin vs insulin in gestational diabetes: glycemic control and obstetrical and perinatal outcomes: randomized prospective trial. Am J Obstet Gynecol 2021; 225: 517.e1-517.e17 31 American Diabetes Association: 14. Management of diabetes in pregnancy: standards of medical care in diabetes—2021. Diabetes Care 2021; 44 (Suppl 1): S200-10 32 Feig DS et al.: Metformin in women with type 2 diabetes in pregnancy (MiTy): a multicentre, international, randomised, placebo-controlled trial. Lancet Diabetes Endocrinol 2020; 8: 834-44 33 He K et al.: The efficacy and safety of metformin alone or as an add-on therapy to insulin in pregnancy with GDM or T2DM: A systematic review and meta-analysis of 21 randomized controlled trials. J Clin Pharm Ther 2022; 47: 168-77 34 Practice bulletin No. 180: Gestational diabetes mellitus. Obstet Gynecol 2017; 130: e17-37 35 American Diabetes Association Professional Practice Committee; Draznin B et al.: 15. Management of diabetes in pregnancy: standards of medical care in Diabetes—2022. Diabetes Care 2022; 45 (Suppl1): S232-43
Das könnte Sie auch interessieren:
Modulateurs du récepteur de la sphingosine-1-phosphate dans le traitement de la SEP
Les modulateurs du récepteur de la sphingosine-1-phosphate représentent une classe de médicaments prometteurs pour le traitement de deuxième ligne de la sclérose en plaques (SEP). Deux ...
Présentation des données pertinentes pour la pratique sur le mavacamten dans la CMHO
Le mavacamten, un inhibiteur de la myosine, a été la première substance de cette classe à être autorisée en 2023 pour le traitement de la cardiomyopathie hypertrophique obstructive (CMHO ...
Hypertension secondaire: formes, diagnostic & options thérapeutiques
La fréquence d’une cause secondaire d’hypertension artérielle est de 10%. En cas de suspicion d’hypertension secondaire, il convient de procéder à un examen ciblé afin de pouvoir, dans l ...