«Point of Care Ultrasound» (POCUS): le stéthoscope moderne?
Auteurs:
Dr méd. Mark Kirsch
Dr méd. Marius Treusch
Klinik Innere Medizin
Universitätsspital Basel
Petersgraben 4
4031 Basel
E-mail: mark.kirsch@usb.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Les progrès techniques nous ont apporté une version «de poche» des appareils à ultrasons, dotée d’une bonne qualité d’imagerie. Ainsi l’échographie se trouve à la portée de tout médecin de premier recours et interniste comme examen clinique rapide au lit du malade. Comment cette échographie sur le site d’intervention (POCUS) est-elle utilisé? Dans quels domaines a-t-elle fait ses preuves? Quels avantages et quels inconvénients apporte-t-elle au traitement du patient? Le POCUS servira-t-il uniquement à compléter le stéthoscope et l’examen clinique, ou ira-t-il même jusqu’à le remplacer dans certains domaines?
Keypoints
-
L’intégration de l’échographie sur le site d’intervention («Point of Care Ultrasound», POCUS) à l’anamnèse et à l’examen clinique permet une amélioration significative de la prise en charge du patient.
-
Les forces de POCUS résident dans la possibilité de regrouper les résultats anamnestiques, cliniques et échographiques au lit du patient.
-
Depuis janvier 2022, l’échographie d’urgence basée sur le POCUS constitue en Suisse une composante de la formation continue en médecine interne générale.
C’est au pneumologue René Théophile Hyacinthe Laënnec que l’on doit l’invention du stéthoscope au début du XIXe siècle. On raconte qu’il ne voulait plus poser directement son oreille sur la poitrine et le dos de ses patientes et patients. Un rouleau construit à partir d’un journal l’a aidé à ausculter et lui a donné l’idée de développer un stéthoscope. Décédé de la tuberculose en 1826, il faudra encore patienter bien des années avant que l’échographie n’entre dans le domaine clinique.1
Et alors qu’à la fin du XIXe siècle, l’effet piézoélectrique était déjà découvert par les frères Curie comme principe technique de base de l’échographie actuelle, et que l’échosondeur était apparu pendant la Première Guerre mondiale, rendu tristement célèbre pour la localisation des sous-marins ennemis, il a encore fallu attendre jusque dans les années 1940 pour que le procédé d’échographie trouve ses premières applications en diagnostic clinique.2
Il existe un parallèle intéressant entre les deux «techniques d’auscultation», même si l’appellation stéthoscope dérive des termes grecs «stethos» (poitrine) et «skopein» (regarder) et que nous contemplons de fascinantes images dans notre appareil à ultrasons. Ce sont deux techniques qui «écoutent» réellement le patient: les ondes sonores sont enregistrées, pour l’une technique, dans la tête du médecin, et pour l’autre dans un ordinateur.
Il apparait donc à première vue que les deux procédés, l’examen clinique et l’échographie au lit du malade, se disputent le temps passé avec le patient, et des voix s’élèvent pour dire que l’échographie non seulement élargit l’examen clinique traditionnel, mais pourrait même le remplacer. La valeur de POCUS dans la pratique quotidienne, par rapport à l’examen au stéthoscope, sera examinée dans cet article sous différents points de vue.
Influence de l’échographie sur la relation médecin-patient
Duan et al. ont pu montrer une fois de plus qu’un examen clinique complet influençait la relation médecin-patient de manière favorable. Le groupe de chercheurs a réussi à établir que la satisfaction du patient augmentait avec le nombre de composantes de l’examen clinique.3 En effet, l’introduction de l’échographie au lit du malade semble également renforcer la perception positive de la compétence du médecin, comme ont pu le montrer Howard et al. lors de l’examen de patients admis au service des urgences. Ici, c’était non seulement l’évaluation de la recherche diagnostique échographique, mais aussi la prise en charge du personnel médical et l’impression générale du service d’urgence qui étaient plus positives chez les patients ayant bénéficié d’un examen échographique.4
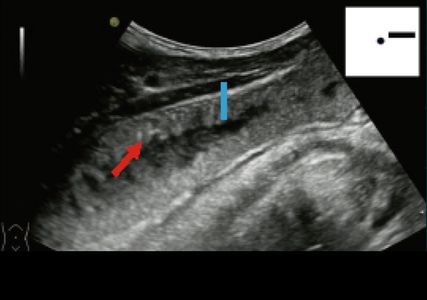
Échographie pulmonaire versus auscultation/examen pulmonaire
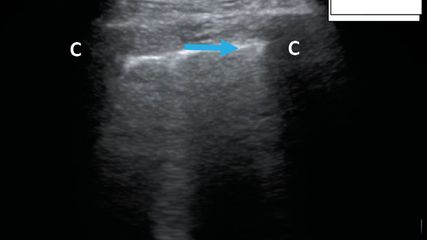
Fig. 1: Ligne B (POCUS en milieu hospitalier; en haut à droite schématiquement sur le pictogramme). C: côte avec annulation acoustique dorsale; flèche (bleu): espace interpleural; flèche (rouge): ligne B
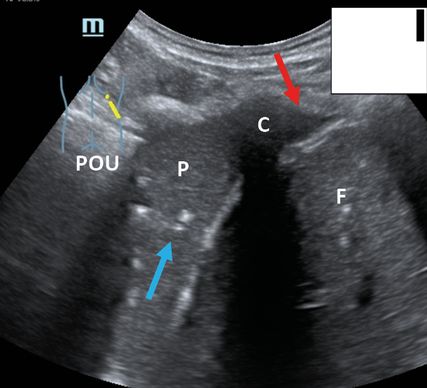
Fig. 2: Angle costo-diaphragmatique droit avec pneumonie basale et épanchement pleural, dorsal (POCUS en milieu hospitalier; en haut à droite schématiquement sur le pictogramme). POU: poumons; F: foie; C: ombre des côtes; P: pneumonie; flèche (rouge): épanchement pleural; flèche (bleu): air piégé
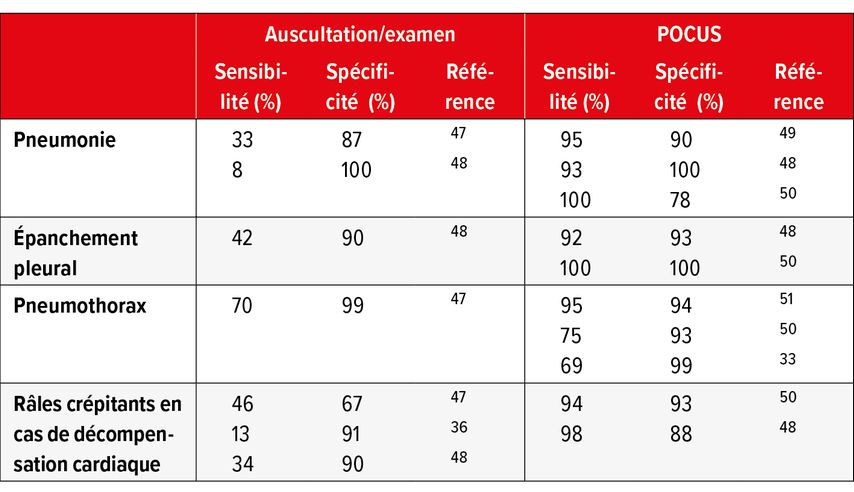
Pour l’auscultation des poumons, les sensibilités et spécificités des différents examens varient et peuvent être comparées à celles de l’examen POCUS au lit du malade (Tab.1). De l’avis du Dr Daniel Lichtenstein, l’un des pionniers de l’échographie pulmonaire et le premier à décrire les lignes B comme signes d’accumulation liquidienne interstitielle pulmonaire et les lignes A comme signes potentiels de pneumothorax5 (Fig.1, lignes B typiques), l’échographie pulmonaire est largement supérieure à l’examen clinique en termes de sensibilité en cas de pneumonie, d’épanchement pleural (Fig. 2, pneumonie basale avec épanchement concomitant) et de pneumothorax, et il est nettement supérieur avec une spécificité comparable en cas de syndrome interstitiel. Cela peut être confirmé dans les grandes lignes à travers d’autres études, bien que la spécificité élevée n’ait pas pu être atteinte dans de nombreuses études, p.ex. en cas de pneumonie, et que la sensibilité d’un diagnostic clinique de pneumonie soit probablement sous-estimée par Lichtenstein. Il faut mentionner que c’est lors du diagnostic de pneumothorax symptomatique au lit du malade que le diagnostic clinique semble être le moins inférieur par rapport à l’échographie. Il convient aussi de souligner que les données d’examen clinique incluses ici, dans la méta-analyse d’Arts, concernaient en majorité des patients ayant subi un traumatisme. À notre avis, lors du diagnostic d’épanchement pleural, la valeur de l’examen clinique se rapproche beaucoup de celle de l’échographie, uniquement lorsqu’il s’agit d’épanchements pleuraux très volumineux ayant un retentissement clinique. Dans le diagnostic de syndrome interstitiel, p.ex. dans le cadre d’une insuffisance cardiaque, il semble que l’échographie pulmonaire ait été de plus en plus utilisée ces dernières années. Selon nous, cela provient de l’utilisation répétée non compliquée en pratique quotidienne et de la supériorité de la méthode par rapport à la radiographie de thorax conventionnelle (voir également le paragraphe sur l’insuffisance cardiaque). Une fois de plus, on perçoit l’utilité d’une imagerie échographique au lit du maladie chez les patients confinés en période de Covid-196 ou chez les patients instables en soins intensifs.7
Échographie cardiaque versus auscultation/examen clinique cardiaque
L’auscultation des valves cardiaques peut détecter uniquement la participation des valves et le mécanisme impliqué (sténose versus insuffisance), et le degré de sévérité de manière très restreinte. Dans cette situation, c’est l’échographie effectuée par le cardiologue qui constitue l’examen de choix. La question de la supériorité de l’échographie sur l’examen clinique ne se pose donc pas dans cette situation, mais il convient plutôt de se demander si l’examen cardiaque par POCUS peut être pratiqué au cours d’une simple anamnèse, de manière fiable, par des médecins de famille ou des internistes moins entraînés. Il a pu être démontré au cours de plusieurs études, qu’une fraction d’éjection ventriculaire gauche fortement diminuée pouvait être reconnue par des internistes avec une pertinence élevée.8,9 La fonction ventriculaire gauche avait pu être estimée de manière correcte jusque dans 97% des cas.9 Si l’évaluation devient plus différentiée, la fiabilité diminue et il est possible que certains éléments importants soient négligés ou mal interprétés. Ainsi, un examen rétrospectif comparant l’échographie cardiaque effectué au lit du malade à l’échocardiographie laisse apparaître seulement 70% de résultats cohérents.10 En résumé, la qualité de l’échographie cardiaque au lit du malade suffit toutefois pour les besoins du médecin de famille ou de l’interniste en pratique clinique quotidienne, comme nous l’expliquerons dans les paragraphes dédiés à la médecine aiguë et à l’insuffisance cardiaque.
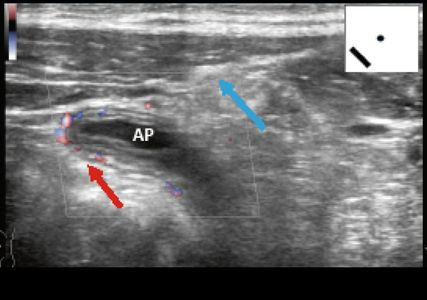
Échographie abdominale versus auscultation/examen abdominal
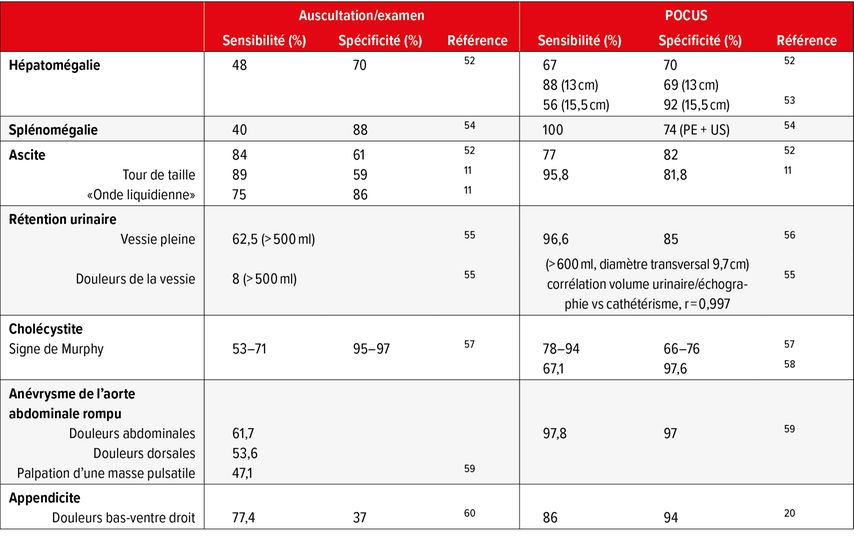
L’examen clinique et l’auscultation de l’abdomen peuvent être également comparées au POCUS sur bien des points (Tab. 2).
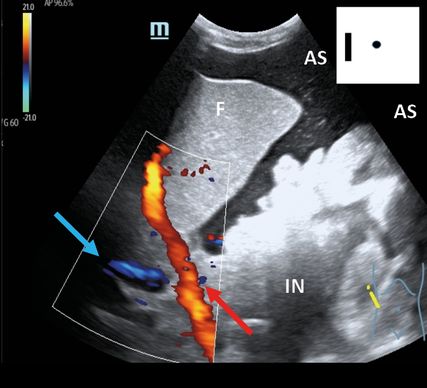
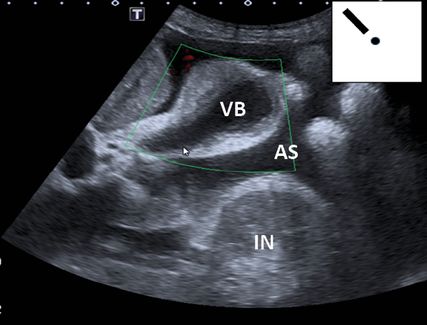
Fig. 3: Foie cirrhotique avec ascite, flux hépato-portal à travers la veine porte au doppler couleur (POCUS en milieu hospitalier; en haut à droite schématiquement sur le pictogramme). F:foie; IN: intestin; AS: ascite; flèche (bleu): veine cave; flèche (rouge): flux hépato-portal encore normal sur le doppler couleur
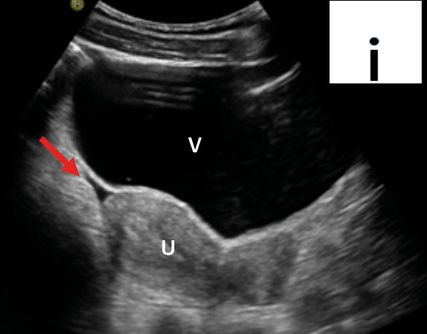
Fig. 4: Petite quantité de liquide libre (POCUS en milieu hospitalier; en haut à droite schématiquement sur le pictogramme). V: vessie; U: utérus; flèche (rouge): liquide libre
Fig. 5: Rein gauche congestionné, grade 2–3 (POCUS en milieu hospitalier; en haut à droite schématiquement sur le pictogramme). Flèche (rouge): calices élargis
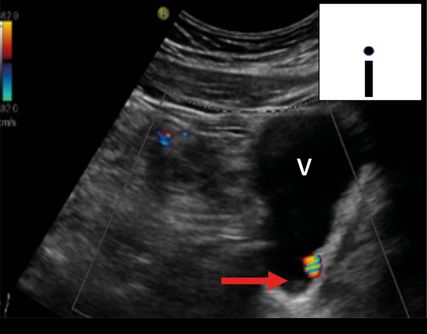
Fig. 6: Calcul urétéral avec phénomène de Twinkling juste avant la sortie de la vessie (POCUS en milieu hospitalier; en haut à droite schématiquement sur le pictogramme). V: vessie; flèche (rouge): phénomène de Twinkling
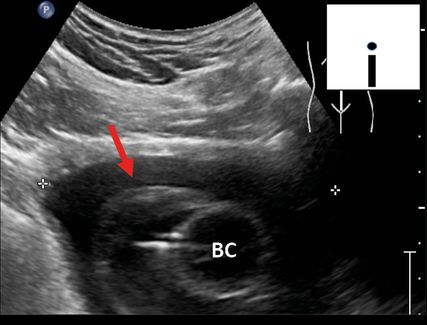
Fig. 7: Obstruction à la vidange du cathéter vésical par un hématome (POCUS en milieu hospitalier; en haut à droite schématiquement sur le pictogramme). BC: ballon du cathéter; flèche (rouge): hématome entourant le ballon comme un capuchon
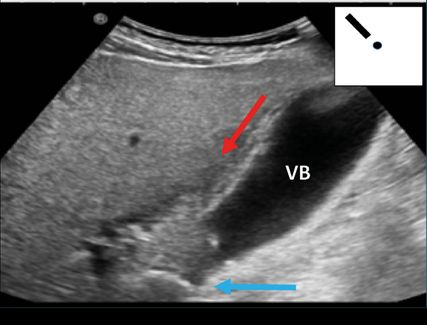
Fig. 8: Cholécystite (POCUS en milieu hospitalier; en haut à droite schématiquement sur le pictogramme). VB: vésicule biliaire; flèche (bleu): calcul; flèche (rouge): liquide dans le lit de la vésicule biliaire
Fig. 9: Vésicule biliaire avec paroi épaissie en présence d’ascite (POCUS en milieu hospitalier; en haut à droite schématiquement sur le pictogramme). AS: ascite; IN: intestin; VB: vésicule biliaire
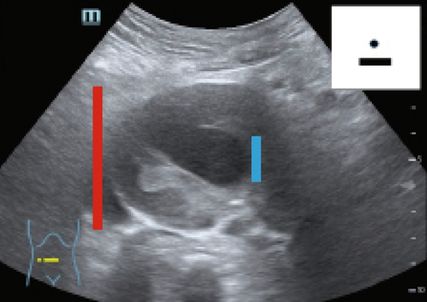
Fig. 10: Anévrisme de l’aorte abdominale sous-rénale partiellement thrombosé (POCUS en milieu hospitalier; en haut à droite schématiquement sur le pictogramme). Trait (rouge): diamètre de l’aorte; trait (bleu): diamètre de la lumière traversée par le flux
Fig. 11: Appendicite (POCUS en milieu hospitalier; en haut à droite schématiquement sur le pictogramme). Flèche (bleu): passage de la musculature abdominale latérale dans la gaine du M. droit; flèche (rouge): perfusion augmentée de l’appendice élargie au Power-Doppler
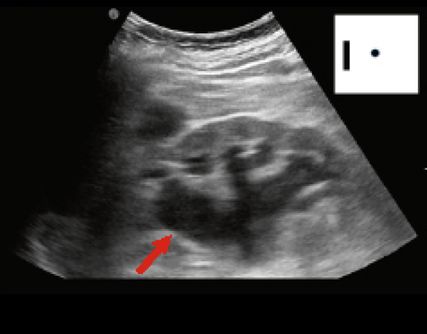
Fig. 12: Œdème de la paroi de l’intestin grêle en cas d’iléus paralytique du grêle (POCUS en milieu hospitalier; en haut à droite schématiquement sur le pictogramme). Flèche (rouge): plis de Kerckring; trait (bleu): paroi épaissie
L’examen clinique d’une tuméfaction de la rate, petit organe situé sous la rebord costal gauche, peut ne pas être d’une grande sensibilité, et l’approche POCUS dans ce contexte peut être clairement supérieure en termes de sensibilité. Cependant, il conviendra ici d’intégrer à l’interprétation d’autres informations telles que la taille du patient, la forme de la rate ou le contexte clinique, afin de garantir une spécificité suffisante. En cas de diagnostic d’hépatomégalie, l’examen échographique semble être un peu moins supérieur à l’examen clinique, même si les travaux d’Arora et al. cités en référence ont évalué la capacité des étudiants en médecine. D’une part les points de mesure échographique utilisés pour l’évaluation de la taille du foie et les paramètres de mesure maximaux font encore l’objet de discussions, d’autre part une hépatomégalie est facilement accessible à l’examen clinique sous le rebord costal droit. Cependant, ce n’est souvent pas la taille du foie qui présente une importance clinique décisive, mais bien plus sa texture (stéatose, fibrose, cirrhose), et c’est là que l’évaluation échographique offre évidemment tous ses avantages décisifs (Fig. 3, cirrhose hépatique avec ascite).
L’échographie permet d’estimer de manière fiable d’infimes quantités de liquide avec une grande sensibilité11 (voir aussi le paragraphe sur la médecine aiguë et la Fig. 4, petite quantité de liquide abdominal). La sensibilité de POCUS en tant que moyen de détection échographique de l’ascite nous est aussi présentée dans la publication d’Arora et al. avec 77% de «non représentatif». Comme déjà évoqué, ce travail examine les capacités d’étudiants en médecine. La faible sensibilité de POCUS dans cet examen révèle probablement la nécessité d’une formation intensive en échographie.
L’évaluation des composantes post-rénales lors d’une insuffisance rénale aiguë est une question couramment posée dans la pratique quotidienne. Outre la difficulté de détecter des obstructions unilatérales par l’examen clinique, il semble également que l’examen clinique d’une vessie pleine, dont l’examen a été effectué par le personnel de soin dans la référence citée, soit également peu sensible (Fig. 5, stase rénale degré III; Fig. 6, calcul urétéral pré-vésical). Il a pu être démontré à plusieurs reprises que le volume vésical pouvait être estimé de manière fiable avec un petit écart, à l’aide de la formule suivante du volume d’une ellipsoïde (hauteur x largeur x longueur x 0,5).12 Le «Bladder-Scanner» automatisé est disponible pour répondre facilement à la question du volume résiduel. Des modèles portatifs destinés au milieu ambulatoire sont en développement13 (Fig. 7, cathéter vésical obstrué par un caillot sanguin).
Lors du diagnostic d’une cholécystite, le POCUS est la méthode de choix en comparaison de l’examen clinique. La détection de calculs biliaires augmente la probabilité pré-test d’une cholécystite de manière significative. L’épaississement des parois estimé par échographie ne peut être considéré isolément du contexte clinique, car il est non spécifique14 (Fig. 8, cholécystite avec cholélithiases; Fig. 9, épaississement des parois de la vésicule biliaire en cas d’ascite). Le signe de Murphy constitue une composante essentielle de l’examen tant clinique qu’échographique. La localisation exacte de la vésicule biliaire par échographie apporte une augmentation significative de la sensibilité. Dans l’évaluation du signe de Murphy par échographie, l’expérience clinique et échographique se mélangent. Le médecin traitant au lit du malade semble effectuer un examen plus sensible que le spécialiste «éloigné» ou le collaborateur technique non médical.15 Sous cet aspect, on peut encore discuter de la meilleure imagerie en cas de cholécystite (TDM versus POCUS) concernant les sensibilité et spécificité.16,17 Il est incontesté que dans la plupart des cas, l’examen clinique associé au POCUS permet d’établir le diagnostic de cholécystite.
Le POCUS a fait irruption dans plusieurs directives nationales relatives au dépistage de l’anévrisme de l’aorte abdominale.18 Avec une sensibilité de la palpation d’une «masse pulsatile» de 47,1%, il n’est pas étonnant que le POCUS soit d’un plus grand bénéfice dans le diagnostic d’une rupture aiguë d’anévrisme abdominal que l’examen clinique (Fig. 10, anévrisme de l’aorte abdominale sous-rénale en partie thrombosé).
Les douleurs abdominales sont d’une bonne sensibilité lors du diagnostic clinique primaire de l’appendicite. L’association de divers paramètres cliniques permet d’augmenter encore la précision du diagnostic clinique (p.ex. score d’Alvarado19). Cependant, le POCUS a fait ses preuves en tant qu’imagerie complémentaire. Dans cette situation, la visualisation d’une lithiase appendiculaire par exemple, peut être d’une signification décisive pour la suite de la procédure. Le POCUS placé entre des mains expérimentées a été décrit comme doté d’une pertinence comparable à celle d’une TDM abdominale pour le diagnostic d’appendicite20 (Fig.11, appendice enflammée).
Au cours de l’examen clinique d’évaluation de l’intestin, il a été montré de façon générale que l’auscultation ne permettait qu’une mauvaise évaluation d’une occlusion intestinale ou du degré de troubles du transit post-opératoires.21,22 Dans ce contexte, le développement du POCUS de l’intestin semble également prometteur. Bien que l’échographie abdominale ne soit la plupart du temps intelligible que pour un échographiste expérimenté, sa valeur a déjà pu être démontrée dans le suivi des maladies digestives inflammatoires et dans le diagnostic d’autres pathologies digestives23,24 (Fig.12, muqueuse de l’intestin grêle inflammatoire et épaissie en cas d’iléus paralytique).
Utilisation de l’échographie lors de ponctions
Il existe actuellement un fort niveau de preuve pour le fait qu’une ponction guidée par échographie soit plus sûre qu’une ponction orientée anatomiquement, qu’il s’agisse d’une ponction d’ascite25,26, d’une ponction pleurale27 ou p.ex. de la pose d’un cathéter veineux central28. On discute également de la possibilité de remplacer la radiographie pratiquée après la pose d’un cathéter veineux central par l’échographie.29
Utilisation des algorithmes d’échographie en médecine aiguë
Sur le plan historique, c’est au changement de siècle que le POCUS a fait sa première apparition en médecine aiguë. Un grand nombre d’algorithmes fixes d’échographie ont été établis notamment dans le cadre de la réanimation cardiopulmonaire30, de la survenue d’un choc indifférencié (protocole RUSH)31 ou chez les patients polytraumatisés (eFAST).32,33 On notera également une augmentation des preuves en faveur de l’échographie pulmonaire dans la clarification d’une dyspnée aiguë notamment. À ce propos, Pivetta et al., par exemple, ont démontré que l’échographie pulmonaire en complément de l’examen clinique, y compris de la radiographie du thorax et de l’estimation du BNP, menait dans 8 cas sur 100 à la nécessité de reconsidérer l’attribution de la dyspnée à une cause donnée.34 Le protocole BLUE a été largement diffusé pour la clarification des pathologies pulmonaires aiguës.35
Utilisation de l’échographie dans le traitement des patients atteints d’insuffisance cardiaque
Un 3e ou un 4e bruit cardiaque, un étalement du choc de pointe, des signes indirects de décompensation cardiaque, tels que des œdèmes des membres inférieurs, une turgescence des veines du cou ou des râles crépitants pulmonaires, ne permettent d’établir le diagnostic d’insuffisance cardiaque qu’avec une faible sensibilité. Il faut tout de même remarquer que les résultats pathologiques précités sont d’une grande spécificité et qu’ils conservent toute leur valeur dans la démarche diagnostique clinique.36
Au cours des vingt dernières années, l’examen clinique a été complété par des procédés échographiques. Outre l’estimation du diamètre de la veine cave et de la veine jugulaire et de leur variabilité respiratoire, il convient aussi de mentionner ici l’échographie pulmonaire destinée à la détection d’une augmentation des lignes B, et depuis quelques années également la détection d’un flux pathologique modifié au niveau des veines hépatique et rénale ou de la veine porte. La valeur ajoutée d’une évaluation échographique de l’état volumique associé à l’examen clinique a déjà pu être largement soulignée. Ainsi Pellicori et al. ont pu démonter qu’on pouvait détecter une hypovolémie par évaluation échographique de la veine cave, des veines jugulaires et des poumons, chez environ la moitié des patients présentant une insuffisance cardiaque n’ayant aucun signe clinique ni échographique.37 Les paramètres de flux au niveau de la veine porte et des veines hépatiques et rénales ont été évalués avec succès, ainsi que l’évaluation du diamètre de la veine cave en utilisant le score de VEXUS, pour prédire avec une grande spécificité une défaillance rénale per-opératoire dans le cadre d’une opération de chirurgie cardiaque.38,39
Les résultats publiés ces dernières années à propos de la prise en charge ambulatoire de patients insuffisants cardiaques avec l’ajout d’une échographie pulmonaire sont très impressionnants. Marini et al. parlent même d’un «number needed to treat» de 8,4 patients, pour éviter une réadmission à l’hôpital par une échographie supplémentaire.40 Même si ces résultats sont relativisés dans une méta-analyse de Mhanna et al.41 et que l’adaptation du traitement diurétique basée sur l’échographie pulmonaire ne soit pas encore clairement déterminée, il semble que l’échographie pulmonaire soit toutefois prometteuse chez les patients insuffisants cardiaques hospitalisés.
Conclusion
L’échographie est une composante bien établie de la médecine moderne. Les forces de POCUS résident dans la possibilité de regrouper au lit du malade les résultats d’échographie, l’anamnèse, l’examen clinique et les autres résultats cliniques recueillis. L’examen clinique au stéthoscope fait incontestablement partie du quotidien médical, et il doit en être tout autant de l’approche POCUS. Le POCUS et l’examen clinique peuvent s’étayer mutuellement en formation.42 Cet aspect important a été pris en compte lors de l’introduction en janvier 2022 de l’échographie d’urgence basée sur le POCUS dans la formation continue en médecine interne générale en Suisse. Dans ce contexte, il est important que les structures de formation continuent de consolider des échanges fructueux avec les institutions responsables. Nous pouvons rendre compte ici des premières expériences sur notre propre site43 et l’on peut également s’appuyer sur les expériences internationales de formation POCUS déjà existantes.44–46 L’effort de formation ne doit pas être sous-estimé, mais doit être abordé en raison des avantages pour les soins apportés aux patients décrits ici.
Littérature:
1 The centennial of the stethoscope. JAMA 2016; 315: 2738 2 Newman PG, Rozycki GS: Surg Clin North Am 1998; 78: 179-95 3 Duan L et al.: Postgrad Med 2020; 132: 102-8 4 Howard ZD et al.: J Emerg Med 2014; 46: 46-53 5 Lichtenstein D, Mezière G: Intensive Care Med 1998; 24: 1331-4 6 Kameda T et al.: J Med Ultrason 2021; 48: 31-43 7 Brogi E et al.: Crit Care 2017; 21: 325 8 Razi R et al.: J Am Soc Echocardiogr 2011; 24: 1319-24 9 Mjølstad OC et al.: Eur Heart J Cardiovasc Imaging 2013; 14: 1195-202 10 Maxwell AG, Jardine DL: Intern Med J 2019; 49: 1025-8 11 Keil-Ríos D et al.: Intern Emerg Med 2016; 11: 461-6 12 Padilha JF et al.: Int Urogynecol J 2020; 31: 973-9 13 Jo HG et al.: Sensors 2021; 21: 5445 14 Runner GJ et al.: AJR Am J Roentgenol 2014; 202: W1-12 15 Noble VE et al.: Eur J Emerg Med 2010; 17: 80-3 16 Wertz JR et al.: AJR Am J Roentgenol 2018; 211: W92-7 17 Gruber H, Loizides A: AJR Am J Roentgenol 2019; 212: W43 18 Benson RA et al.: Br J Radiol 2018; 91: 20170306 19 Alvarado AA: Ann Emerg Med 1986; 15: 557-64 20 Hwang ME: Radiol Technol 2018; 89: 224-37 21 Felder S et al.: J Surg Educ 2014; 71: 768-73 22 Read TE et al.: Dis Colon Rectum 2017; 60: 608-13 23 Allocca M et al.: J Crohns Colitis 2021; 15: 143-51 24 Wale A, Pilcher J: Semin Ultrasound CT MR 2016; 37: 301-12 25 Ennis J et al.: Int J Clin Med 2014; 5: 1277-93 26 Millington SJ, Koenig S: Chest 2018; 154: 177-84 27 Peris A et al.: N Engl J Med 2018; 378: e19 28 Saugel B et al.: Crit Care 2017; 21: 225 29 Ablordeppey EA et al.: AEM Educ Train 2021; 5: e10530 30 Blanco P, Martínez Buendía C: J Ultrasound 2017; 20: 193-8 31 Keikha M et al.: Bull Emerg Trauma 2018; 6: 271-8 32 Canelli R et al.: N Engl J Med 2022; 386: e23 33 Netherton S et al.: CJEM 2019; 21: 727-38 34 Pivetta E et al.: Eur J Heart Fail 2019; 21: 754-66 35 Bekgoz B et al.: Am J Emerg Med 2019; 37: 2020-7 36 Watson RD et al.: BMJ 2000; 320: 236-9 37 Pellicori P et al.: Eur J Heart Fail 2019; 21: 904-16 38 Beaubien-Souligny W et al.: J Am Heart Assoc 2018; 7: e009961 39 Beaubien-Souligny W et al.: Ultrasound J 2020; 12: 16 40 Marini C et al.: Lung ultrasound-guided therapy reduces acute decompensation events in chronic heart failure. Heart 2020; 106: 1934-9 41 Mhanna M et al.: Heart Fail Rev 2022; 27: 821-6 42 Wong CK et al.: Postgrad Med J 2021; 97: 10-5 43 Arpagaus Armona GF et al.: Prim Hosp Care Allg Inn Med 2022; 22: 42-4 44 Blans MJ et al.: Neth J Med 2020; 78: 116-24 45 Mellor TE et al.: Mil Med 2019; 184: 901-6 46 LoPresti CM et al.: Am J Med 2019; 132: 1356-60 47Arts L et al.: Sci Rep 2020; 10: 7347 48 Lichtenstein D et al.: Anesthesiology 2004; 100: 9-15 49Ye X et al.: PLoS One 2015; 10: e0130066 50 Xirouchaki N et al.: Intensive Care Med 2011; 37: 1488-93 51 Lichtenstein DA et al.: Crit Care Med 2005; 33: 1231-8 52 Arora S et al.: J Ultrasound 2017; 20: 199-204 53 Gosink BB, Leymaster CE: J Clin Ultrasound 1981; 9: 37-44 54 Olson APJ et al.: Crit Ultrasound J 2015; 7: 13 55 Ceratti RDN, Beghetto MG: Rev Gaucha Enferm 2021; 42: e20200014 56 Daurat A et al.: Anesth Analg 2015; 120: 1033-8 57 Jain A et al.: Acad Emerg Med 2017; 24: 281-97 58 Sharif S et al.: CJEM 2021; 23: 626-30 59 Fernando SM et al.: Acad Emerg Med 2022; 29: 486-96 60 Benabbas R et al.: Acad Emerg Med 2017; 24: 523-51
Das könnte Sie auch interessieren:
Redéfinition de la résécabilité à l’ère de l’immunothérapie
L’introduction de l’immunothérapie néoadjuvante a ouvert de nouveaux horizons quant aux limites de la résection chirurgicale des tumeurs du cancer du poumon. Toutefois, des problèmes ...
La perte de poids reste toujours le meilleur traitement en cas de MASLD
La directive commune pour la prise en charge de la maladie stéatosique du foie associée à une dysfonction métabolique (MASLD) de l’European Association for the Study of the Liver (EASL ...
Hypertension secondaire: formes, diagnostic & options thérapeutiques
La fréquence d’une cause secondaire d’hypertension artérielle est de 10%. En cas de suspicion d’hypertension secondaire, il convient de procéder à un examen ciblé afin de pouvoir, dans l ...