Oxygénothérapie à long terme: quand l’oxygène devient un médicament
Auteur:
Dr méd. Stephan Wieser
FMH Pneumologie und Allg. Innere Medizin
Lungen-Klinik Bethanien
Zürich
E-mail: s.wieser@lungen-klinik.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Il n’est pas rare que l’on administre de l’oxygène en suivant son intuition, selon la devise «plus c’est, mieux c’est». Comme pour tout traitement médicamenteux, puisque c’est bien de cela qu’il s’agit ici, l’utilisation doit cependant être fondée sur des preuves et la physiopathologie. Nous allons discuter de l’oxygénothérapie à long terme («long-term oxygen treatment», LTOT) qui, contrairement à l’oxygénothérapie aiguë, est utilisée à long terme et de manière autonome par les patients au quotidien.
Keypoints
-
La LTOT est indiquée lorsqu’une hypoxémie chronique sévère persiste après un traitement optimal, même au cours d’une phase stable de la maladie.
-
Une gazométrie est indispensable pour une prescription soigneuse.
-
La LTOT a pour objectif d’augmenter la PaO2 jusqu’à 60mmHg au minimum ou de 10mmHg.
-
La durée d’utilisation doit être de 15h/j ou plus pour obtenir un avantage en termes de survie.
-
Un traitement mobile peut permettre d’atteindre la durée d’utilisation nécessaire et, éventuellement, d’améliorer les capacités.
-
L’hypercapnie est un effet secondaire éventuel de la LTOT.
L’oxygène est synonyme de vie, mais il peut être néfaste
L’oxygène est la base de la vie d’une grande partie des êtres vivants, dont l’Homme. Il constitue 21% de notre atmosphère. Ce dernier permet un métabolisme aérobie efficace; dans le cas d’un manque d’oxygène, on observe un passage à un métabolisme anaérobie inefficace, qui ne peut être maintenu que pendant une courte période.
L’hypoxie est l’apport insuffisant en oxygène des tissus de l’organisme et se manifeste sur le plan clinique par une tachypnée, une tachycardie, une arythmie, une hypertension, puis une hypotension. Les patients présentent une dyspnée et sont d’abord agités et désorientés, puis dans un état léthargique et comateux. Parmi les différentes formes d’hypoxie, l’hypoxie hypoxémique, qui est due à une baisse de la pression d’oxygène dans le sang, se prête le mieux à une substitution de l’oxygène.
L’administration incontrôlée d’une fraction inspirée en oxygène élevée entraîne une hyperoxie. Elle pose aussi quelques problèmes et peut provoquer à long terme une toxicité du SNC (agitation, vertiges, nausées, vision en tunnel, acouphènes), mais aussi une atteinte alvéolaire diffuse due à la libération de radicaux libres à long terme.
Insuffisance respiratoire hypoxémique contre hypercapnique
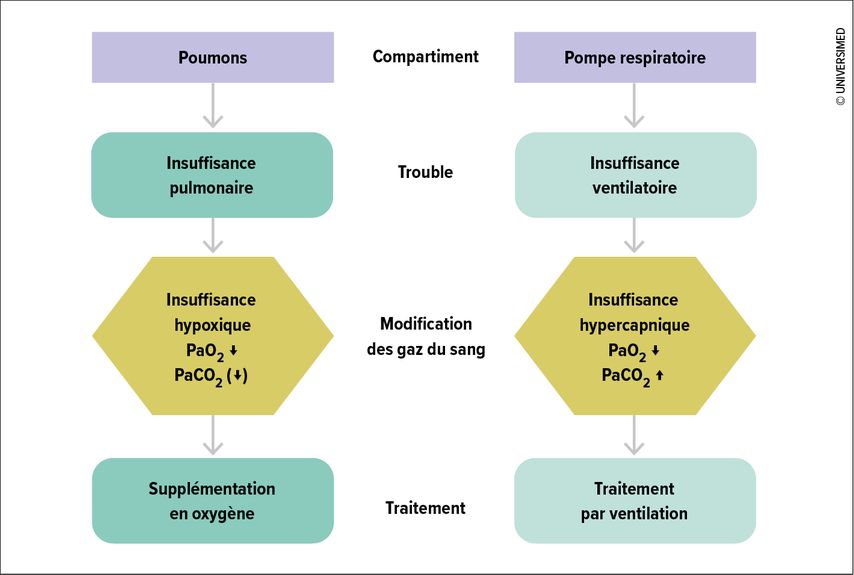
Pour comprendre les mécanismes d’une hypoxémie et donc du traitement optimal, il convient de séparer une défaillance respiratoire (insuffisance respiratoire) en ses deux composantes: les poumons en tant que système d’échange de gaz et la pompe respiratoire en tant que système de ventilation (Fig. 1).
En cas de diminution de la surface d’échange de gaz, de trouble de la diffusion ou de la perfusion pulmonaire, seule l’absorption d’O2, mais pas l’émission de CO2, est perturbée de manière cliniquement significative en raison du coefficient de diffusion nettement plus élevé. L’insuffisance respiratoire hypoxémique (type 1) se traduit par une baisse de la pression partielle d’oxygène (PaO2) dans la gazométrie artérielle, la pression partielle du dioxyde de carbone (PaCO2) étant normale ou réduite en cas d’hyperventilation. Le traitement consiste en premier lieu à administrer de l’oxygène.
Les atteintes de la pompe respiratoire (dues à des troubles du centre respiratoire, des nerfs efférents ou de la jonction neuromusculaire, des muscles respiratoires ou du thorax osseux) entraînent une insuffisance ventilatoire hypercapnique (type 2). La ventilation insuffisante de l’air frais «non respiré» dans la chambre d’échange de gaz provoque également une hypoxémie, mais aussi une hypercapnie et une acidose respiratoire en raison de l’absence d’expiration du CO2 produit. Sur le plan thérapeutique, une ventilation doit être évaluée en premier lieu.
La mesure transcutanée de la saturation en oxygène est insuffisante
Il résulte de cette réflexion que la seule mesure de l’oxygène permet uniquement de constater l’hypoxémie, mais ne permet pas de faire la distinction entre un trouble des échanges gazeux et une atteinte de la pompe respiratoire (insuffisance respiratoire hypoxémique contre hypercapnique); une gazométrie artérielle est donc nécessaire avec, entre autres, détermination de la pression du dioxyde de carbone (PaCO2). La mesure de la pression d’oxygène (PaO2) permet en outre de détecter les artefacts fréquents de la mesure transcutanée de la saturation en oxygène.
Les preuves relatives à l’oxygénothérapie à long terme datent des années 1980
Les études randomisées, contrôlées déterminantes portant sur l’utilisation de la LTOT sont l’étude NOTT («Nocturnal Oxygen Therapy Trial») menée sur 203 patients hypoxémiques atteints de BPCO et l’étude du MRC («Medical Research Council») menée sur 87 patients hypoxémiques, datant respectivement de 1980 et 1981. Dans l’étude NOTT, 6 patients ont dû bénéficier d’une oxygénothérapie à long terme (contre un traitement nocturne uniquement) pendant 2 ans pour éviter un décès; dans l’étude du MRC, 5 patients ont dû bénéficier d’une oxygénothérapie pendant 5 ans (contre aucune oxygénothérapie). Lorsqu’elles sont suffisamment comparables, les cohortes de l’étude NOTT et de l’étude MRC permettent une analyse combinée dont le résultat prouve l’efficacité d’une oxygénothérapie. La survie des patients atteints de BPCO est nettement supérieure à celles des personnes non traitées en cas d’administration d’oxygène pendant au moins 15h/j.
Comparées aux standards actuels, ces études ont un nombre très faible de patients et la transposition du traitement de la BPCO, encore très limité à l’époque dans les domaines de la pharmacothérapie, de la rééducation, de la ventilation non invasive à long terme, de la réduction du volume pulmonaire, etc., aux conditions actuelles est uniquement possible sous réserve. Ces deux études constituent néanmoins les meilleures preuves disponibles relatives à cette question. Le critère d’évaluation primaire de survie ne reflète toutefois pas la qualité de vie et les capacités au quotidien.
Les preuves relatives au traitement d’autres tableaux cliniques hypoxémiques, tels que la fibrose pulmonaire, l’hypertension pulmonaire, les maladies restrictives, etc., ont été déduites de ces études, mais il n’existe que très peu d’études qui abordent directement ces questions.
Effets de l’oxygénothérapie
-
Effet favorable sur l’hémodynamique pulmonaire: elle permet de contrer une augmentation de la pression dans la circulation pulmonaire, voire de la faire baisser dans certains cas.
-
Soulagement de la pompe respiratoire: elle entraîne une diminution de la commande respiratoire renforcée par l’hypoxémie et donc une réduction du volume respiratoire par minute. La diminution de la commande respiratoire n’améliore pas seulement la sensation de dyspnée, mais soulage également les muscles respiratoires.
On observe les effets supplémentaires suivants: augmentation des capacités physiques, mesurable par exemple par le test de marche de 6 minutes, et répercussions positives sur les fonctions neurocognitives. Chez les patients atteints de BPCO, une réduction du taux d’exacerbation et une meilleure probabilité de survie à une exacerbation ont été démontrées. Une diminution des arythmies cardiaques, probablement due à l’augmentation de l’oxygénation myocardique, est observée. Outre l’amélioration du pronostic, ces facteurs entraînent en moyenne une meilleure qualité de vie.
Quand la LTOT est-elle indiquée? Comment est-elle titrée?
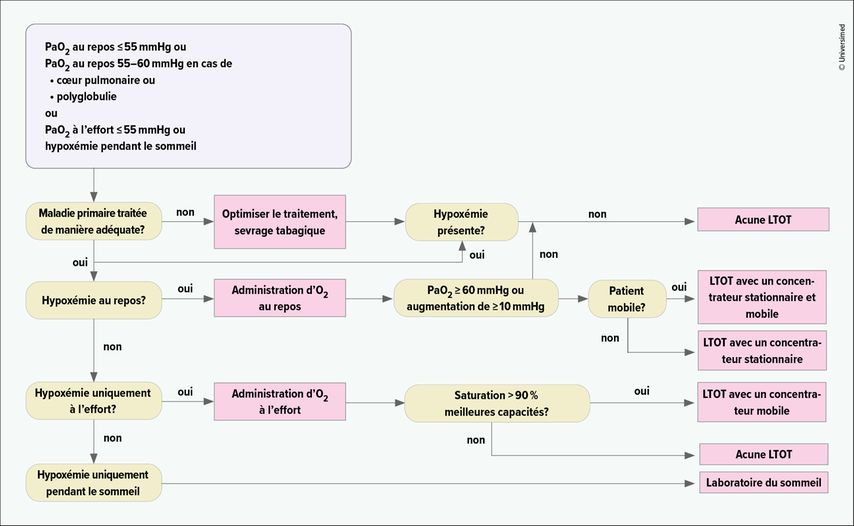
Sur la base des données des études précitées, une LTOT est indiquée dans les cas suivants (voir également Fig. 2):
-
une hypoxémie de repos sévère (définie par une PaO2 ≤55mmHg ou 7,3kPa) ou
-
une hypoxémie de repos modérée (définie par une PaO2 ≤60mmHg ou 8kPa), si une polyglobulie secondaire ou un cœur pulmonaire, avec ou sans insuffisance cardiaque droite, sont également présents.
Fig. 2: Algorithme d’évaluation de l’indication de l’oxygénothérapie à long terme (LTOT) (adapté d’après Magnussen et al., 2008)13
La condition préalable est que l’hypoxémie chronique soit également détectable dans l’intervalle stable par des mesures répétées (idéalement de 3 à 4 semaines d’intervalle), après exploration d’autres formes de traitement adéquates (rééducation, pharmacothérapie, réduction du volume pulmonaire, traitement des comorbidités).
En cas d’oxygénothérapie post-aiguë, par exemple à la suite d’une hospitalisation en raison d’une exacerbation de la BPCO ou de la fibrose pulmonaire, d’une pneumonie sévère ou du Covid-19, l’indication de poursuite du traitement à long terme (et donc une transformation en LTOT) doit être vérifiée au plus tard après 6 à 12 semaines et le traitement doit être arrêté en l’absence d’indication supplémentaire.
La titration de la dose doit viser une PaO2 >60mmHg (8,0kPa) et une SpO2 >90%. Une hypercapnie ne constitue pas en soi une contre-indication à la LTOT, mais elle doit susciter des réflexions supplémentaires concernant la cause de l’hypoxémie (défaillance de la pompe respiratoire?) et le traitement différentiel (ventilation non invasive). En cas de survenue d’une acidose respiratoire ou d’une augmentation de la PaCO2 >7,5mmHg (1kPa) sous administration d’oxygène, le traitement doit être interrompu ou une ventilation non invasive nocturne doit être évaluée en complément.
Combien d’heures la LTOT doit-elle être utilisée par jour?
La LTOT présente un avantage en termes de survie lorsqu’elle est utilisée pendant 15h/j ou plus; aucun bénéfice pronostique n’a été démontré pour une durée d’utilisation plus courte. Par conséquent, l’indication et la prise en charge des coûts d’une LTOT sont liées à une durée d’utilisation d’au moins 15h/j.
Une grande partie de l’administration d’oxygène peut avoir lieu pendant la nuit. Dans la directive actualisée de la Société allemande de pneumologie (DGP), il est explicitement indiqué que les études d’observation actuelles ne révèlent aucun avantage d’une LTOT sur 24h/j contre ≥15 h/j en termes de taux de mortalité ou d’hospitalisation. Ces résultats doivent toutefois être validés dans des études randomisées contrôlées.
Sur quels mécanismes de la dyspnée et donc symptômes la LTOT a-t-elle un effet positif?
Bien que cela ne rende pas compte du mécanisme pathologique complexe de la dyspnée, de nombreux patients souffrant d’affections pulmonaires, qu’ils soient ou non atteints d’insuffisance respiratoire hypoxémique, espèrent naturellement une amélioration de leur dyspnée grâce à l’oxygénothérapie. Chez les patients hypoxémiques également, l’effet positif sur la dyspnée n’est souvent obtenue que dans une faible mesure. La substitution de l’oxygène permet certes de corriger le troubles des échanges gazeux, mais d’autres mécanismes de la dyspnée ne peuvent pas être résolus (obstruction du flux respiratoire, hyperinflation pulmonaire, mécanique respiratoire défavorable). Cet aspect doit absolument être discuté au préalable avec les patients afin d’éviter des attentes irréalistes et des déceptions.
Oxygénothérapie mobile
Dans le cadre de l’oxygénothérapie mobile, le patient porte une source d’oxygène mobile. En raison du besoin accru en oxygène, des temps de circulation plus courts à un débit cardiaque plus élevé et de l’accentuation du trouble des échanges gazeux qui en résulte lors d’un effort physique, l’hypoxémie est souvent aggravée et plus symptomatique pendant l’activité physique. Cela peut être en partie compensé par une oxygénothérapie mobile. La plupart du temps, les patients restent symptomatiques après la correction de l’hypoxémie en raison de la diminution du flux respiratoire, de l’hyperinflation ou de la restriction pulmonaire, mais un grand nombre de patients peuvent en tirer un bénéfice en termes de symptômes (dyspnée, tolérance à l’effort) et de capacités physiques (distance de marche).
Dans quels cas faut-il avoir recours à l’oxygénothérapie mobile?
Une oxygénothérapie mobile est indiquée lorsque le patient ne peut pas atteindre la durée de traitement visée par une LTOT d’au moins 15h/j avec un traitement stationnaire (à domicile) du fait de sa grande mobilité et d’un haut niveau d’activité au quotidien (indication pronostique).
Une amélioration cliniquement pertinente sous oxygénothérapie mobile (+30m au test de marche de 6 minutes ou amélioration de la dyspnée d’un point sur l’échelle de Borg CR10) est constatée par environ 40–50% des patients, principalement le sous-groupe ayant des capacités physiques fortement réduites (indication symptomatique). Un pronostic général de l’effet reste toutefois impossible, de sorte qu’une mesure standardisée dans des conditions contrôlées, avec et sans oxygénothérapie ambulatoire, est nécessaire. La mise en œuvre au quotidien reste en fin de compte individuelle, car le bénéfice symptomatique doit être comparé à la contrainte physique et logistique supplémentaire.
L’oxygénothérapie mobile n’est pas indiquée, même chez les patients hypoxémiques, si les conditions mentionnées ne sont pas remplies. Dans de tels cas, l’extension de l’oxygénothérapie aux phases mobiles hors du domicile ne garantit aucun bénéfice et ne doit pas être imposée en prescrivant une oxygénothérapie mobile. Le port de la source d’oxygène ainsi que la crainte d’être stigmatisé en raison d’une utilisation en public peuvent constituer des obstacles pour le patient et favoriser une tendance au repli sur soi.
Aucun avantage en termes de survie pour les patients présentant uniquement une hypoxémie nocturne
L’oxygénothérapie des patients présentant uniquement une hypoxémie nocturne n’a d’effet prouvé ni sur la morbidité ni sur la létalité (les patients atteints d’insuffisance cardiaque accompagnée d’apnée centrale du sommeil constituent une exception). L’effet sur la qualité de vie et du sommeil n’a pas été suffisamment étudié. Dans de tels cas, un traitement doit être indiqué de manière individuelle en fonction des symptômes et des comorbidités. Le cas échéant, il convient généralement de déterminer et de traiter en premier lieu le type de trouble respiratoire associé au sommeil, par exemple au moyen d’un traitement par PPC nocturne en cas de syndrome d’apnée obstructive du sommeil ou d’une ventilation nocturne en cas de syndrome d’hypoventilation. Le traitement ne se concentre pas sur la désaturation pendant le sommeil, mais sur le trouble respiratoire associé au sommeil qui en est, le plus souvent, à l’origine.
Aucune indication d’oxygénothérapie palliative chez les patients non hypoxémiques présentant une dyspnée
Il n’est pas rare que des patients non hypoxémiques présentant une dyspnée rapportent un effet positif de l’oxygénothérapie. Cela est dû à une stimulation des afférences sensitives (surtout du nerf trijumeau), ce qui persuade le centre respiratoire d’une augmentation du volume respiratoire par minute et provoque un effet placebo central. Dans de tels cas, la dyspnée peut toutefois être traitée plus efficacement, par exemple en utilisant des ventilateurs (flux d’air frais) et des médicaments opioïdes, et ne doit pas conduire à la prescription d’oxygène.
Sources d’oxygène pour la LTOT
Les concentrateurs d’oxygène extraient l’O2 de l’air ambiant et restituent un air fortement enrichi.
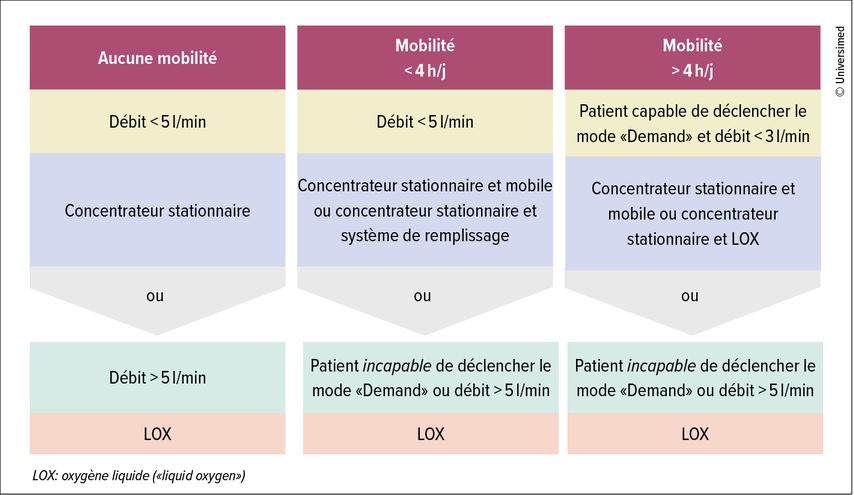
Les concentrateurs stationnaires (poids: env. 20kg) sont raccordés au réseau électrique et permettent un traitement à domicile à un débit allant jusqu’à 5l d’O2/min. La mobilité au sein du logement est garantie par de longs tuyaux, le dispositif peut ainsi être positionné loin du lit afin de minimiser les nuisances sonores. Les patients doivent toutefois être informés du risque de chute lié à un tuyau d’oxygène posé sur le sol.
Les concentrateurs mobiles (poids: env. 2–3kg) peuvent être transportés grâce à des batteries rechargeables. Ils délivrent l’oxygène en bolus, le patient déclenche l’administration par le biais de la dépression au niveau du nez au début de l’inspiration (fonction «Demand» [à la demande]). En cas de faible volume courant et/ou de fréquence respiratoire élevée, il arrive parfois que cette méthode ne soit pas efficace et que le patient ne puisse pas être alimenté par ce système.
Si des débits plus élevés sont nécessaires (>5l d’O2/min) ou que le patient a besoin d’un concentrateur d’oxygène mobile, mais ne peut pas le déclencher en mode «Demand», un débit continu doit être délivré (Fig. 3). L’oxygène refroidi à –183°C et donc liquide («liquid oxygen», LOX) est livré à des intervalles d’environ 1 à 3 semaines et stocké dans un réservoir situé au domicile du patient, à partir duquel il peut être prélevé directement ou via un mini réservoir portable. Le LOX présente un rapport optimal entre le poids ainsi que le débit et la durée possibles, mais pour les contrainte logistique et coût les plus élevés. Des «stations d’oxygène» situées à différents endroits en Suisse permettent aux voyageurs de remplir leur dispositif portable.
Fig. 3: Quel apport en oxygène est nécessaire? (adapté d’après ResMed Healthcare: Titrations-Kompass Sauerstoff. https://www.resmed-healthcare.de/fachkreise/sauerstoff-und-beatmung-informationsmaterial)
L’oxygénothérapie à long terme avec des bouteilles de gaz comprimé est obsolète, car elle ne permet pas de couvrir les besoins en O2 avec une contrainte logistique raisonnable. Les bouteilles de gaz comprimé restent réservées à un traitement ponctuel en fonction des besoins (dit «burst»), tel qu’il est indiqué en dehors de l’hôpital, par exemple dans les cas palliatifs, pour le transport des malades ou le traitement des céphalées en grappe.
L’administration d’oxygène se fait par lunettes à oxygène. Le cas échéant, elles peuvent être intégrées à une monture de lunettes, ce qui les rend moins visibles. L’administration transtrachéale via un cathéter trachéal transcutané (dit «scoop») n’est plus possible en Suisse pour des raisons médico-légales.
L’ajout d’oxygène à un débit élevé d’air ambiant (60l/min) via un générateur de débit supplémentaire avec humidificateur («nasal high-flow oxygen therapy»; oxygénothérapie nasale à haut débit) peut améliorer davantage l’efficacité de l’oxygénothérapie, principalement par lavage-rinçage de l’espace mort physiologique des voies respiratoires. Cette méthode est utilisée en premier lieu dans les situations aiguës chez les patients sévèrement hypoxémiques. Son utilisation en ambulatoire à long terme n’a lieu jusqu’à présent que dans des cas isolés et son importance n’a pas encore été clarifiée.
Importance de l’observance
L’oxygénothérapie est uniquement efficace si l’hypoxémie est traitée de manière adéquate sur une période suffisamment longue. Déterminante pour le succès du traitement, l’observance peut être limitée par d’éventuels effets secondaires et des attentes irréalistes. Les patients doivent donc être soigneusement formés à l’utilisation du système LTOT, aux effets ainsi qu’aux effets secondaires.
Effets secondaires de la LTOT
L’effet secondaire éventuel le plus sévère de la LTOT est l’hypercapnie, qui résulte 1)d’une altération de la commande respiratoire par correction de l’hypoxémie, 2)d’une diminution de la capacité de liaison du CO2 de l’hème oxygéné et 3) d’une modification du schéma respiratoire ainsi que du rapport ventilation/perfusion sous administration d’oxygène. Il est donc nécessaire de déterminer le besoin en oxygène tout comme la réponse ventilatoire par une gazométrie artérielle lors de la prescription et également pendant le traitement.
Outre une sécheresse des muqueuses nasales et l’épistaxis associée, la LTOT peut avoir de lourdes conséquences psychologiques telles que la peur de la stigmatisation. Les patients ont parfois la crainte infondée d’une dépendance à l’oxygène.
En raison de la présence d’oxygène sous forme de gaz à l’intérieur, il peut y avoir un risque d’incendie et d’explosion en cas de mauvaise manipulation.
LTOT et tabagisme
L’examen de l’indication de la LTOT doit évidemment donner lieu à un conseil en matière de tabagisme en cas de dépendance à la nicotine. Lors de la consultation, il convient également d’aborder la progression de la maladie primaire due à la poursuite du tabagisme et le fait que ce dernier annule le bénéfice pronostique d’une oxygénothérapie. Les fumeurs sous oxygénothérapie doivent également être explicitement informés du risque accru d’incendie. Le tabagisme ne constitue toutefois pas une contre-indication absolue.
Prescription d’une LTOT
En raison des considérations précitées concernant le diagnostic et le traitement différentiels ainsi que la nécessité d’une gazométrie, l’indication, la prescription et le suivi d’une LTOT sont idéalement effectués par un pneumologue (même si cela n’est plus exigé par l’agent payeur). Le formulaire de prescription doit comprendre le diagnostic, les critères d’indication, les résultats de la gazométrie ainsi que des indications sur la durée, le débit et la source d’oxygène prescrits.
Dans de nombreux cas, une garantie de prise en charge préalable de l’assureur est nécessaire pour le traitement. Une fois la prise en charge des coûts clarifiée, un prestataire de soins à domicile (Ligue pulmonaire, prestataires privés) peut mettre à disposition le système d’administration d’oxygène nécessaire et former le patient à l’utilisation ainsi qu’à la manipulation du système. Un premier contrôle de suivi sous traitement devrait avoir lieu dans les trois premiers mois, puis au moins une fois par an, même si le traitement se déroule de manière optimale, pour le renouvellement d’ordonnance.
En bref
L’oxygénothérapie à long terme (LTOT)
La LTOT est indiquée lorsqu’une hypoxémie chronique sévère (PaO2 < 55 mmHg [7,3 kPa] ou > 60 mmHg [8 kPa], en cas de polyglobulie secondaire ou de cœur pulmonaire) mesurée à plusieurs moments persiste après un traitement optimal, même au cours d’une phase stable de la maladie. Une gazométrie est indispensable pour une prescription soigneuse.
Le traitement a pour objectif d’augmenter la PaO2 jusqu’à 60 mmHg au minimum ou de 10 mmHg. La durée d’utilisation doit être de 15 h/j ou plus pour obtenir un avantage en termes de survie. Un traitement mobile peut permettre d’atteindre la durée d’utilisation nécessaire et, éventuellement, d’améliorer les capacités, mais l’indication doit être examinée de manière individuelle.
Il n’existe aucune contre-indication absolue. L’hypercapnie est un effet secondaire éventuel de la LTOT.
Les sources d’oxygène peuvent être des concentrateurs ou de l’oxygène liquide. L’oxygène liquide doit être réapprovisionné fréquemment, mais permet aussi une administration mobile à un débit constant et avec un faible poids. Les concentrateurs extraient l’oxygène de l’air ambiant, alors que les dispositifs mobiles fonctionnent pratiquement exclusivement en mode «Demand»; la capacité du patient à le déclencher doit être vérifiée au préalable.
Littérature:
1 Thomson L, Paton J: Paediatr Respir Rev 2014; 15: 120-3 2 Windisch W et al.: Pneumologie 2017; 71: 722-95 3 Nocturnal Oxygen Therapy Trial Group: Ann Intern Med 1980; 93: 391-8 4 Medical Research Council Working Party: Lancet 1981; 1: 681-6 5 Haidl P et al.: Pneumologie 2020; 74: 813-41 6 Haidl P: Pneumologe 2022; 19: 27-32 7 Brill SE, Wedzicha JA: Int J Chron Obstruct Pulmon Dis 2014; 9: 1241-52 8 Lacasse Y et al.: N Engl J Med 2020; 383: 1129-38 9 Zeineddine S et al.: Chest 2021; 160: 701-17 10 Swan F et al.: Palliat Med 2019; 33: 618-33 11 Hardavella G et al.: Breathe 2019; 15: e108-16 12 Geiseler J, Kissel,M: Pneumologe 2022; 19: 33-41 13 Magnussen H et al.: Pneumologie 2008; 62: 748-56
Das könnte Sie auch interessieren:
Les conjugués anticorps-médicament ont le vent en poupe
Actuellement, de nombreux conjugués anticorps-médicament sont en cours d’évaluation dans le cancer du poumon. Qu’ils soient utilisés seuls ou en combinaison avec d’autres thérapies ...
Effets sur la santé ainsi que risques liés au travail posté et de nuit
Le travail posté et de nuit entraîne un risque accru de multiples problèmes de santé en raison de la perte de sommeil et de la désynchronisation circadienne. Il s’agit notamment de ...
Les défis des interfaces interdisciplinaires
Face à un éventail croissant d’options ciblées et immunothérapeutiques, les tests moléculaires sont de plus en plus au centre de l’attention dans les tumeurs gastro-intestinales. Des ...