Pénurie d’organes pour les transplantations rénales: ce que nous faisons, devons faire et ferons…
Auteurs:
Dr méd. Federico Storni
Universitätsklinik für Viszerale Chirurgie und Medizin, Inselspital, Bauchzentrum Bern
Prof. Dr méd. Daniel Sidler
Universitätsklinik für Nephrologie und Hypertonie
Inselspital, Universitätsspital Bern
E-mail: daniel.sidler@insel.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
L’insuffisance rénale avancée va considérablement augmenter dans les pays occidentaux au cours des prochaines décennies et entraînera un besoin accru de dons d’organes. Pour garantir le succès des transplantations à long terme, il est nécessaire d’optimiser la sélection et la transplantation des organes des donneurs ainsi que le traitement à long terme afin d’obtenir un bon résultat de transplantation à long terme, même pour des organes dits «marginaux».
Keypoints
-
La prévention ou le ralentissement des maladies rénales évolutives est considéré(e) comme la meilleure option pour réduire à long terme le nombre de patients inscrits sur liste d’attente.
-
De nouveaux immunosuppresseurs optimisés pourraient prolonger la survie du greffon.
-
La transplantation de reins de donneurs vivants permet souvent une transplantation sans délai d’attente ni dialyse préalable.
-
Les pipelines de diagnostic et de traitement ex vivo sur des organes explantés seront essentiels pour déterminer et éventuellement optimiser la qualité des organes dits «marginaux».
-
Si la xénotransplantation arrive à s’établir, il pourrait être possible de disposer d’un nombre illimité d’organes, ce qui entraînerait probablement d’autres problèmes encore non identifiés.
La transplantation: une option thérapeutique
Les maladies rénales chroniques sont une entité pathologique fréquente dans les pays occidentaux. Chaque année, environ 80000 patients en Europe dépendent d’une procédure de traitement substitutif de l’insuffisance rénale pour une durée indéterminée.1 Comparée à l’hémodialyse ou à la dialyse péritonéale, la transplantation rénale présente des avantages en termes de survie, de qualité de vie et de coûts thérapeutiques.2
La transplantation rénale est réalisée en Europe depuis les années 1960, cette opération constitue désormais une procédure de routine dans de nombreux centres. En Suisse, six centres la pratiquent. La greffe de l’organe du donneur se fait dans la fosse iliaque gauche ou droite par anastomoses vasculaires avec l’artère ou la veine iliaque externe (ou commune, selon l’anatomie) et implantation de l’uretère dans la vessie. Les organes proviennent de donneurs vivants ou décédés. La plupart des donneurs d’organes vivants ont un lien familial et/ou affectif avec le receveur; il est rare qu’une personne donne un rein à un inconnu pour des raisons purement altruistes. L’attribution d’organes aux patients inscrits sur liste d’attente est gérée par les services nationaux des attributions, en Suisse par Swisstransplant. L’attribution se fait par le biais d’un algorithme de priorisation défini par la loi. Au cours des dernières décennies, le nombre de dons en Europe est resté stable autour de 25ppm (personnes par million d’habitants), avec de grandes différences régionales. Avec 30–41ppm, l’Espagne et le Portugal affichent un taux de don d’organes nettement plus élevé que dans d’autres pays, notamment la Suisse avec 19ppm.
Comme décrit, la transplantation rénale représente une bonne option pour le traitement de l’insuffisance rénale chronique, mais ne mène pas à la guérison. Les dysfonctionnements du greffon à long terme sont fréquents, de sorte que le patient risque d’être à nouveau dialysé ou de devoir subir une nouvelle transplantation après 15 ans en moyenne. De plus, les manifestations extrarénales de la maladie de base et/ou les effets secondaires de l’immunosuppression contribuent de manière significative aux comorbidités. De nombreux receveurs de greffe présentent à long terme des événements cardiovasculaires, des tumeurs ou des infections.
Raisons de la pénurie d’organes
Malgré les efforts d’optimisation des attributions et des transplantations, le nombre d’organes disponibles pour une transplantation reste insuffisant. Il en résulte un pronostic moins favorable pour les patients inscrits sur liste d’attente. En Suisse, environ 1500 patients attendent actuellement un organe compatible, un rein de donneur pour la majorité d’entre eux. En 2022, 83 patients inscrits sur liste d’attente sont décédés. Différentes solutions sont mises en œuvre pour tenter de remédier à la pénurie d’organes dans le domaine de la transplantation d’organes en général et dans celui de la transplantation rénale en particulier.
Prévention de la nécessité d’une dialyse
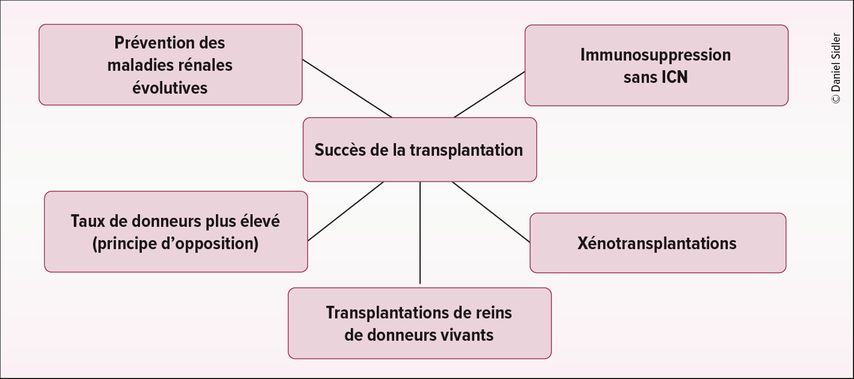
Il ne fait aucun doute que la meilleure solution pour réduire le nombre d’organes nécessaire à une transplantation rénale est de prendre des mesures préventives pour éviter les maladies rénales avec anomalie structurelle ou pour ralentir l’évolution de la maladie rénale. La majorité des maladies rénales nécessitant une dialyse sont d’origine diabétique et/ou cardiovasculaire. Les développements des inhibiteurs du SGLT23, des analogues du GLP-14 et de la finérénone5 montrent un effet puissant pour ralentir les maladies rénales évolutives. Ces derniers sont utilisés chez un nombre croissant de patients. De même, le tolvaptan est la première substance disponible pour ralentir l’évolution de la polykystose rénale autosomique dominante (ADPKD).6 Il faudra toutefois attendre des années avant que l’impact de ces substances ne se fasse sentir sur les chiffres de prévalence des patients dialysés et inscrit sur liste d’attente. La réduction du nombre de patients inscrits sur liste d’attente est finalement la méthode la plus durable et la plus efficace pour lutter contre la pénurie d’organes (Fig. 1).
Fig. 1: Approches visant à améliorer le succès des transplantations par une réduction du côté de la demande ou une amélioration de l’offre
Immunosuppression sans inhibiteur de la calcineurine (ICN)
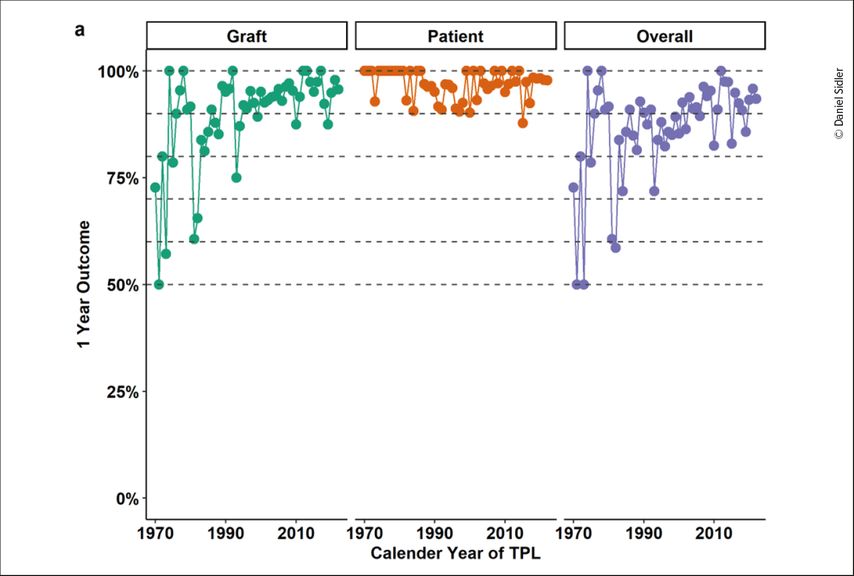
La deuxième option consiste à optimiser le traitement postopératoire afin de permettre une survie du greffon à long terme, si possible pour une durée indéterminée. Les progrès réalisés en matière de diagnostic immunologique ainsi que de traitement chirurgical et médicamenteux ont permis d’améliorer considérablement la survie du greffon à court terme au cours des dernières décennies (Fig. 2). Cependant, les chiffres de la survie du greffon à 5 et à 10 ans stagnent. La raison en est le rejet chronique médié par les anticorps (probabilité d’environ 1 à 2% par année de transplantation) ainsi que le remodelage fibrotique non immunologique, notamment médié par des facteurs cardiovasculaires (hypertension, diabète post-transplantation) et les effets secondaires des traitements par des ICN (ciclosporine, tacrolimus).7 Des développements récents, notamment l’utilisation d’immunosuppresseurs sans ICN, montrent un bénéfice, de sorte que la survie médiane du greffon peut être prolongée.8 En outre, l’utilisation généralisée de substances néphroprotectrices (inhibiteurs du SGLT2, agonistes du GLP-1) aura également un effet bénéfique chez les patients atteints ou non de diabète sucré, bien que ce groupe de patients n’ait pas encore été étudié de grandes études randomisées. Une fois encore, il est certainement avantageux de conserver les organes transplantés le plus longtemps possible afin de lutter contre la pénurie d’organes du côté de la demande.
Fig. 2: Greffon (vert), patients (orange) et survie combinée au cours de la première année après la transplantation en fonction de l’année civile de la transplantation (TPL, 1970–2021) à l’Hôpital universitaire de Berne
Principe d’opposition
Le prélèvement d’organes sur un donneur en mort encéphalique ou décédé après arrêt circulatoire constitue un obstacle éthique majeur. En Suisse, les organes peuvent uniquement être utilisés pour une transplantation si le donneur a donné son consentement de son vivant. Un consentement écrit n’est pas obligatoire, il suffit d’avoir exprimé sa volonté. Ce consentement est malheureusement rarement donné, de sorte que la décision revient aux proches. Dans plusieurs pays, des modifications législatives ont permis de remplacer ce principe de consentement par celui d’opposition: si le candidat au don a refusé de son vivant de donner ses organes, aucun organe n’est prélevé. En l’absence de refus, le consentement est présumé et le don d’organes est visé. En 2022, les électeurs suisses se sont prononcés à 50,1% en faveur de ce principe d’opposition et les autorités fédérales préparent la mise en œuvre de cette modification constitutionnelle au niveau législatif. Un registre des donneurs sera mis en place en parallèle pour documenter de manière simple et sûre la volonté à faire un don d’organes.
Donneurs dits «marginaux»
Tant pour les donneurs vivants que décédés, la démographie a considérablement évolué au cours des dernières années. Les candidats au don sont plus âgés et présentent un niveau accru de comorbidités, notamment en ce qui concerne les facteurs cardiovasculaires, le diabète et l’obésité. On sait que ces facteurs liés au donneur sont des prédicteurs importants de la fonction ainsi que de la survie du greffon et que les résultats sont limités, particulièrement en présence de facteurs de risque.9 Alors qu’elles sont assez fortes pour des groupes entiers de donneurs, ces associations ne se prêtent que de manière limitée à des prédictions individuelles.10 La mise en œuvre de méthodes histologiques, biochimiques et moléculaires s’avère nécessaire pour pouvoir déterminer en quelques heures l’intégrité structurelle et le potentiel de régénération des organes prélevés, afin que les résultats puissent être pris en compte dans les décisions d’attribution. Enfin, il est possible d’utiliser des appareils de perfusion ex vivo et des traitements ex vivo des organes pour évaluer, voire minimiser, les dommages causés aux organes pendant la durée d’ischémie froide.11 Il s’agit de trouver des moyens permettant de sélectionner même les organes dits «marginaux» en toute sécurité, de les conserver ex vivo de manière appropriée, voire de les reconditionner, et d’utiliser si possible tous les organes pour des transplantations réussies. Les progrès en matière de «multi-omics diagnostics» et «big-data analysis» seront utiles à cet égard.
Transplantations de reins de donneurs vivants
La transplantation de reins de donneurs vivants représente une option importante de traitement substitutif des reins, en particulier pour les patients qui souhaitent éviter la dialyse. Les développements de ces dernières années offrent la possibilité d’une transplantation même en cas d’incompatibilité de groupe sanguin entre le receveur et le donneur. Dans ce cas, une préparation médicamenteuse/interventionnelle du receveur (et non du donneur) est nécessaire. Celle-ci comprend la déplétion unique des cellules B circulantes par le rituximab ainsi que l’élimination préopératoire des anticorps dirigés contre les antigènes de groupe sanguin du donneur (anti-A ou anti-B). Les résultats à long terme entre les transplantations AB0-compatibles et -incompatibles semblent comparables, bien qu’un risque d’infection ne puisse être exclu chez certains patients à risque en raison de l’immunosuppression initiale plus importante avec cette dernière option thérapeutique. Dans la mesure où ils sont bien sélectionnés, les résultats à long terme chez les donneurs vivants sont bons, tant en termes de survie globale que de fonction rénale résiduelle et de comorbidités. Les grands registres de donneurs, comme le registre SOL-DHR en Suisse, permettent un suivi à long terme des donneurs d’organes.12
Xénotransplantation
Alors que les dispositifs médicaux d’origine animale (surtout porcine) sont utilisés en médecine depuis des décennies, les xénotransplantations semblaient jusqu’à présent impossibles. Chaque année, environ 150000 patients reçoivent des valves cardiaques porcines; les intestins de centaines de milliers de porcs sont utilisés pour produire des dérivés de l’héparine. Le péricarde bovin est utilisé pour le remplacement/la reconstruction vasculaire. Avec 800 millions de porcs (d’élevage) dans le monde et un taux d’abattage de 85% (670 millions d’abattages par an), les abattages aux fins de traitement biomédical (et non de recherche) ne représentent qu’une petite partie de ce chiffre total. Le principal problème rencontré par la xénotransplantation (rénale) au cours des dernières années a été l’incompatibilité entre les systèmes immunitaires humain et porcin en ce qui concerne la cascade du complément. La transplantation d’un rein de porc chez l’homme s’est ainsi soldée par un rejet hyperaigu médié par le complément, avec déjà un échec primaire de la transplantation.13Des développements, notamment la génération de porcs triple knock-out présentant des anomalies génétiques au niveau des voies centrales du complément, ont conduit à des organes inertes qui semblent transplantables (du moins à court terme). Il y a quelques mois, un rein de porc a été greffé avec succès chez un receveur de greffe (en mort encéphalique) et surveillé pendant 48 heures.14 Les développeurs cherchent également à mettre au point des reins artificiels, mais ceux-ci sont associés à de nombreuses complications, qui expliquent pourquoi cette méthode technologique n’a pas encore pu s’établir.
Conclusion
Dès que les xénotransplantations seront possibles en tant que procédure de routine (ou que des reins artificiels pourront être produits), la plupart des problèmes de pénurie d’organes présentés ci-dessus seront résolus. Il est toutefois à craindre que des problèmes spécifiques à la xénotransplantation (infections opportunistes) et autres ne passent au premier plan. Il ne fait aucun doute que la prévention primaire et secondaire de l’insuffisance rénale sévère et évolutive reste la meilleure stratégie de lutte contre la pénurie d’organes pour les transplantations rénales.
Littérature:
1 Kramer A et al.: The European Renal Association – European Dialysis and Transplant Association (ERA-EDTA) Registry Annual Report 2015: a summary. Clin Kidney J 2018; 11: 108-22 2 Ojo AO et al.: Survival in recipients of marginal cadaveric donor kidneys compared with other recipients and wait-listed transplant candidates. J Am Soc Nephrol 2001; 12: 589-97 3 Yasuda, H, Isobe S: Dapagliflozin in patients with chronic kidney disease. N Engl J Med 2021; 384: 389 4 Yu JH et al.: GLP-1 receptor agonists in diabetic kidney disease: current evidence and future directions. Kidney Res Clin Pract 2022; 41: 136 5 Bakris GL et al.: Effect of finerenone on chronic kidney disease outcomes in type 2 diabetes. N Engl J Med 2020; 383: 2219-29 6 Torres VE et al.: Tolvaptan in patients with autosomal dominant polycystic kidney disease. N Engl J Med 2012; 367: 2407-18 7 Karolin A et al.: Calcineurin inhibitor toxicity in solid organ transplantation. Pharmacol 2021; 106: 347-55 8 Florman S et al.: Outcomes at 7 years post-transplant in black vs nonblack kidney transplant recipients administered belatacept or cyclosporine in BENEFIT and BENEFIT-EXT. Clin Transplant 2018; 32: e13225 9 Kuhn C et al.: Outcome of kidney transplantation from very senior donors in Switzerland – a national cohort study. Transpl Int 2021; 34: 689-99 10 Schwab S et al.: Clinical prediction model for prognosis in kidney transplant recipients (KIDMO): study protocol. Diagn Progn Res 2023; 7: 6 11 Hosgood SA et al.: Normothermic machine perfusion versus static cold storage in donation after circulatory death kidney transplantation: a randomized controlled trial. Nat Med 2023; doi: 10.1038/s41591-023-02376-7 12 Thiel GT et al.: Investigating kidney donation as a risk factor for hypertension and microalbuminuria: findings from the Swiss prospective follow-up of living kidney donors. BMJ Open 2016; 6: e010869 13 Negri A, Wilson L: Future systems of xenotransplantation: melding historical and bioethical methodology. Cell Transplant 2023; 32: 9636897231170510 14 Montgomery RA et al.: Results of two cases of pig-to-human kidney xenotransplantation. N Engl J Med 2022; 386: 1889-98
Das könnte Sie auch interessieren:
Les conjugués anticorps-médicament ont le vent en poupe
Actuellement, de nombreux conjugués anticorps-médicament sont en cours d’évaluation dans le cancer du poumon. Qu’ils soient utilisés seuls ou en combinaison avec d’autres thérapies ...
Effets sur la santé ainsi que risques liés au travail posté et de nuit
Le travail posté et de nuit entraîne un risque accru de multiples problèmes de santé en raison de la perte de sommeil et de la désynchronisation circadienne. Il s’agit notamment de ...
Les défis des interfaces interdisciplinaires
Face à un éventail croissant d’options ciblées et immunothérapeutiques, les tests moléculaires sont de plus en plus au centre de l’attention dans les tumeurs gastro-intestinales. Des ...