MICI: la question difficile du traitement séquentiel
Compte-rendu:
Reno Barth
Journaliste médical
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
En ce qui concerne la prise en charge des maladies inflammatoires chroniques de l’intestin (MICI), la question se pose souvent de savoir par quoi débuter le traitement dans chaque cas individuel et par quoi le poursuivre en cas de réponse insuffisante face aux multiples options thérapeutiques disponibles aujourd’hui. Des stratégies séquen-tielles sont donc nécessaires, mais très peu de preuves issues d’études cliniques sont malheureusement disponibles à ce sujet.
L’hétérogénéité de la maladie complique notamment la question d’un ordre judicieux des traitements disponibles pour la maladie de Crohn», a déclaré le Prof. David T. Rubin du Digestive Diseases Center de l’University of Chicago Medicine, États-Unis, lors du congrès ECCO 2023. Il n’existe pas non plus de biomarqueurs validés pour guider les décisions thérapeutiques. D.T.Rubin a souligné que le contrôle de la maladie de Crohn était une question de facteurs liés au patient, à la maladie et au traitement, et qu’il ne faut pas oublier un autre facteur extrêmement important, à savoir le temps. En d’autres termes: comment la maladie évolue.
Un ensemble de facteurs pronostiques influençant l’évolution d’une maladie de Crohn ont été publiés. Une apparition précoce de la maladie, une maladie extensive, des ulcères profonds, une maladie périanale ou anale sévère, des antécédents de résection, des sténoses ou une maladie pénétrante ainsi que la consommation de tabac favorisent, entre autres, un risque accru. Tous ces facteurs peuvent être déterminants pour le choix du traitement. D.T.Rubin précise que la décision concrète devrait être prise sur la base de données de signification variable, les résultats d’essais randomisés contrôlés représentant les preuves les plus solides. Les méta-analyses en réseau ou les études rétrospectives se situent en bas de la hiérarchie. Cette hiérarchisation ne concerne pas seulement l’efficacité des traitements, mais aussi leur sécurité, et les registres de sécurité, tels que ceux exigés par la FDA par exemple, jouent dans ce cas un rôle relativement important. Un outil validé, basé sur la démographie, les marqueurs biologiques et les marqueurs génétiques, a été publié pour évaluer le risque individuel.1
Les avantages sur le long terme d’un traitement précoce et efficace de la maladie de Crohn ont été démontrés à plusieurs reprises. Les patients atteints de maladie de Crohn qui ont reçu des traitements biologiques précoces avaient deux à trois fois plus de chances d’être en rémission clinique après six à douze mois. Cela s’appliquait aussi bien aux patients pédiatriques qu’aux adultes.2 Dans ce contexte, l’intervenant a souligné que les risques thérapeutiques devaient toujours être évalués par rapport à ceux de la maladie et, qu’en cas de forme sévère avec un risque accru de résultats défavorables, des traitements moins bien tolérés sont également autorisés. Les patients stables depuis longtemps sont en revanche beaucoup moins enclins à accepter des traitements plus risqués, même si une bonne efficacité est à prévoir.
Plusieurs options efficaces pour le traitement de première ligne
Il n’est pas possible de répondre à la question de savoir quel médicament devrait être privilégié comme traitement initial en se basant sur les preuves. Une méta-analyse en réseau de 2018 a démontré la meilleure réponse initiale sous infliximab ou adalimumab chez les patients naïfs de traitement biologique.3 Mais selon D.T.Rubin, le problème de ces données est qu’elles sont désormais obsolètes, car plusieurs nouveaux traitements ont été autorisés et sont déjà établis dans la pratique clinique quotidienne.
L’étude SEAVUE n’a mis en évidence aucun avantage sous ustékinumab et adalimumab lors de la comparaison directe des deux traitements biologiques.4 D.T.Rubin a souligné que les taux de rémission dans les deux bras étaient supérieurs à 60% et que l’étude SEAVUE s’est donc révélée négative par rapport à son hypothèse de base (supériorité de l’ustékinumab par rapport à l’adalimumab), mais que le résultat clinique était très positif. En revanche, des analyses rétrospectives ont démontré la supériorité de l’ustékinumab par rapport au védolizumab en tant que traitement de deuxième ligne après l’échec d’un traitement biologique anti-TNF.5 L’intervenant a également attiré l’attention sur l’anticorps anti-IL-23 risankizumab, qui a présenté de très bons taux de rémission chez les patients après l’échec d’un traitement anti-TNF. Cela était également valable après l’échec de l’ustékinumab. D.T.Rubin a en outre souligné la bonne tolérance du risankizumab.6
Mieux établis dans le traitement de la colite ulcéreuse, les inhibiteurs de Janus kinase (JAK) ont selon lui également un avenir dans la prise en charge de la maladie de Crohn. L’upadacitinib a ainsi permis d’obtenir des taux de réponse et de rémission impressionnants, dans le cadre du traitement d’induction comme dans celui du traitement d’entretien.7 On attend toutefois une extension correspondante des indications.
Tenir compte des manifestations extra-intestinales et des comorbidités
Les manifestations extra-intestinales et les comorbidités auto-immunes peuvent également être des facteurs déterminants pour le choix du traitement dans la pratique clinique quotidienne, d’autant plus que les mêmes voies de signalisation sont en partie impliquées. La présence d’une polyarthrite rhumatoïde, par exemple, plaide en faveur des traitements biologiques anti-TNF ou des inhibiteurs de JAK, qui sont également utilisés dans le traitement de la polyarthrite rhumatoïde. A contrario, un psoriasis en plaques laisse supposer l’utilisation d’ustékinumab, de risankizumab ou d’un traitement biologique anti-TNF.
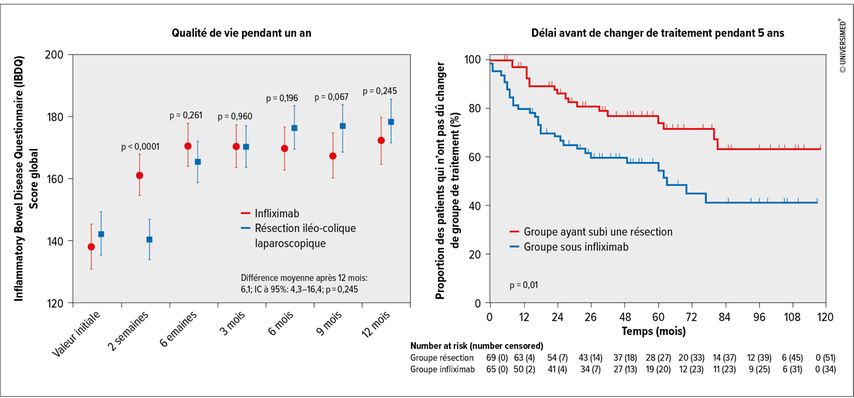
Une autre question ouverte est le rôle de la chirurgie dans la prise en charge de la maladie de Crohn. Les données d’étude indiquent qu’une intervention chirurgicale précoce peut s’avérer bénéfique. L’étude LYR!C a ainsi révélé que la résection iléo-colique entraîne certes des taux de rémission similaires à ceux sous infliximab, mais que les escalades thérapeutiques sont moins nécessaires sur le long terme après l’intervention (Fig. 1).8,9 Selon D.T.Rubin, cela pourrait signifier que la chirurgie peut entraîner une sorte de «reset» tôt dans l’évolution de la maladie et qu’elle ne devrait donc pas être réservée à une forme très avancée.
Fig. 1: Résection iléo-colique laparoscopique par rapport à l’infliximab en cas de maladie de Crohn avec atteinte iléale terminale isolée (modifié selon Ponsioen CY et al., 2017; Stevens TW et al., 2020)8,9
De nombreuses questions en suspens concernent toujours la maladie périanale, qui touche 20 à 25% des patients atteints de maladie de Crohn. L’intervenant considère qu’elle devrait par conséquent constituer l’objectif principal des nouvelles études. Ces dernières ne doivent pas seulement envisager de nouveaux traitements, mais aussi des objectifs thérapeutiques appropriés, que ce soit pour la maladie périanale ou pour une éventuelle maladie périanale infraclinique pouvant précéder les manifestations cliniques pendant une période prolongée. On peut également se demander si la distinction entre non-réponse primaire et secondaire doit avoir un impact sur les décisions ultérieures.
Évaluation des succès thérapeutiques et adaptation du traitement, le cas échéant
D.T.Rubin a notamment souligné l’importance du concept «treat-to-target» emprunté à la rhumatologie. Outre la volonté d’adapter le traitement, cela suppose un suivi adéquat du succès thérapeutique. Le traitement initial doit être choisi en fonction du degré de sévérité de la maladie et du pronostic. Après six à douze semaines, le succès doit être contrôlé et, le cas échéant, le traitement adapté. En cas de succès du traitement initial, un nouveau contrôle est indiqué après six à douze mois. Si l’objectif thérapeutique est seulement atteint avec le deuxième traitement, le succès doit être évalué après seulement trois à six mois.
Toutefois, les preuves manquent là encore. «Les études CALM10 et STARDUST11 montrent l’importance du suivi et de l’escalade thérapeutique. Cette escalade ayant cependant toujours été effectuée avec les médicaments déjà utilisés auparavant, ces aspects ne permettent de tirer que des conclusions limitées sur le changement de traitement», a précisé D.T.Rubin. «Il n’est pas clair non plus s’il est possible de retourner vers des traitements déjà pris dans le passé en cas de perte de réponse à un traitement qui a été débuté plus tard», a-t-il déclaré. Dans le cas d’une non-réponse thérapeutique, l’intervenant a recommandé de se demander d’abord s’il s’agit d’une infection ou d’une inflammation dans le cadre de la maladie de Crohn. Le cas échéant, il faut vérifier si les taux sériques de médicament sont suffisants avant de changer de traitement. Si tel n’est pas le cas, il faut vérifier à la fois l’adhérence thérapeutique et la pharmacodynamique.12
L’expert a argumenté qu’il ne fallait pas attendre une réponse trop longtemps, car les répondeurs ont présenté une réponse thérapeutique après deux à quatre semaines dans la plupart des études. Les réponses tardives existent certes, mais elles sont rares et il n’est en aucun cas possible de s’y fier.
Données limitées sur les stratégies séquentielles en cas de colite ulcéreuse
Dans le traitement de la colite ulcéreuse également, des médicaments de différentes classes sont désormais disponibles, selon le Dr Peter Irving de la Guy’s and St. Thomas’ Hospital Foundation Trust à Londres, Royaume-Uni. Les options thérapeutiques se sont ainsi nettement améliorées en quelques années. Parmi les traitements dits «advanced», plusieurs traitements biologiques anti-TNF, l’anti-intégrine védolizumab, l’anticorps anti-IL-12/IL-23 ustékinumab, les inhibiteurs de JAK tofacitinib, upadacitinib et filgotinib, ainsi que le modulateur du récepteur de la S1P ozanimod sont disponibles pour traiter la colite ulcéreuse. Les anticorps anti-p19 viendront prochainement compléter cette liste.
Dans cette situation, les stratégies séquentielles s’imposent d’elles-mêmes. Dans le cas de la colite ulcéreuse, elles évoluent en grande partie dans un cadre où les preuves manquent avec une seule étude comparative directe. L’étude VARSITY a mis en évidence un taux de rémission clinique supérieur sous védolizumab par rapport à celui sous adalimumab dans une population d’étude largement naïve de traitement par anti-TNF.13 La recherche d’une stratégie séquentielle appropriée est notamment liée à la question du traitement initial optimal qui vise idéalement à rendre d’autres étapes thérapeutiques inutiles. Selon P.Irving, les facteurs déterminants pour cette décision sont des facteurs liés aux médicaments, tels que l’efficacité et la tolérance, aux patients, tels que le phénotype de la maladie ou les souhaits personnels, mais aussi aux médecins traitants, tels que l’expérience avec un certain traitement, ainsi que des facteurs systémiques, tels que la disponibilité et le remboursement dans le pays concerné.
En l’absence d’études comparatives directes, l’efficacité d’un traitement donné peut par exemple être estimée sur la base de méta-analyses en réseau. Ces dernières ont révélé que l’upadacitinib, un inhibiteur de JAK, s’est avéré être l’option la plus efficace, en termes de rémission comme de guérison de la muqueuse, suivi de l’infliximab et du védolizumab.14,15 L’expert a toutefois souligné que les méta-analyses en réseau présentaient elles aussi des faiblesses méthodologiques, car elles comparent par exemple des études ayant des périodes d’observation et des populations d’étude très différentes. Il a ajouté que les substances à action rapide sont avantagées, parce qu’il ne s’agit généralement pas d’études sur le long terme. Malgré leurs faiblesses, les données de vie réelle peuvent également fournir des informations précieuses pour la pratique clinique quotidienne, car elles portent sur des populations d’étude réalistes et incluent par exemple des patients présentant des comorbidités.
Le traitement initial influence-t-il la réponse aux traitements ultérieurs?
On ignore en grande partie si l’ordre choisi pour les traitements peut influencer le résultat sur le long terme. D’après l’intervenant, on présume souvent que les traitements de deuxième ligne sont moins efficaces que chez les patients naïfs de traitement. En cas de MICI, cette hypothèse ne correspond toutefois que partiellement aux preuves issues des études. Les études OCTAVE ont en effet mis en évidence une supériorité comparable du verum par rapport au placebo dans le cadre du traitement d’induction par le tofacitinib chez les patients ayant reçu ou non un traitement préalable.16 Il en va de même pour l’ustékinumab dans les études UNIFI.17 Les données de vie réelle confirment une efficacité comparable des anticorps anti-TNF chez les patients naïfs de traitement biologique et chez ceux ayant reçu un traitement préalable par le védolizumab.18 Selon P.Irving, l’expérience montre également que le délai peut être plus long avant que les patients ayant reçu un traitement préalable ne présentent une réponse.
Il ne faut pas non plus oublier de prendre en compte les coûts lors du choix du traitement. En cas de MICI, P.Irving a souligné que les traitements biologiques les moins chers, à savoir les biosimilaires d’anti-TNF, présentent l’avantage d’être le traitement biologique avec lequel on a le plus d’expérience et dont l’efficacité ainsi que les toxicités sont parfaitement décrites. Il est donc logique de débuter le traitement par un anticorps anti-TNF et de passer à une autre option en cas d’échec primaire ou secondaire du traitement anti-TNF. Le choix du traitement de deuxième ligne peut être facilité par les données issues d’études de vie réelle, lesquelles suggèrent que le tofacitinib serait une meilleure option que le védolizumab, notamment en cas de colite ulcéreuse sévère et après un échec primaire des traitements biologiques.19
L’immunophénotypage pourrait à l’avenir également ouvrir la voie vers une individualisation du traitement. Pour cela, il est toutefois nécessaire que les données issues de la recherche théorique actuellement disponibles soient vérifiées dans le cadre d’études cliniques. «Les directives disponibles à ce jour sur la question de l’approche séquentielle sont très peu spécifiques», a déclaré P.Irving. L’ECCO recommande donc les anti-TNF, le védolizumab, le tofacitinib ou l’ustékinumab pour le traitement d’induction comme d’entretien.20 Cela coïncide pratiquement avec les recommandations américaines ou britanniques.
Source:
18e congrès de la European Crohn’s and Colitis Organisation (ECCO), du 1er au 4 mars 2023, Copenhague
Littérature:
1 Siegel CA et al.: Aliment Pharmacol Ther 2016; 43: 262-71 2 Ungaro RC et al.: Aliment Pharmacol Ther 2020; 51: 831-42 3 Singh S et al.: Aliment Pharmacol Ther 2018; 48: 394-409 4 Sands BE et al.: Lancet 2022; 399: 2200-11 5 Parrot L et al.: Aliment Pharmacol Ther 2022; 55: 380-8 6 Ferrante M et al.: presented at UEGW 2022 7 D’Haens G et al.: Clin Gastroenterol Hepatol 2022; 20: 2337-46.e3 8 Ponsioen CY et al.: Lancet Gastroenterol Hepatol 2017; 2: 785-92 9 Stevens TW et al.: Lancet Gastroenterol Hepatol 2020; 5: 900-7 10 Colombel JF et al.: Lancet 2017; 390: 2779-89 11 Danese S et al.: Lancet Gastroenterol Hepatol 2022; 7: 294-306 12 Yarur AJ, Rubin DT: Inflamm Bowel Dis 2015; 21: 1709-18 13 Sands BE et al.: N Engl J Med 2019; 381: 1215-26 14 Burr NE et al.: Gut 2021: gutjnl-2021-326390 15 Lasa JS et al.: Lancet Gastroenterol Hepatol 2022; 7: 161-70 16 Sandborn WJ et al.: N Engl J Med 2017; 376: 1723-36 17 Sands BE et al.: N Engl J Med 2019; 381: 1201-14 18 Bressler B et al.: J Crohns Colitis 2021; 15: 1694-706 19 Buisson A et al.: Aliment Pharmacol Ther 2023; 57: 676-88 20 Raine T et al.: J Crohns Colitis 2022; 16: 2-17