Médecine personnalisée dans les MICI: Quoi? Pour qui et quand?
Auteur:
Dr Michel H. Maillard, MD-PhD
Centre des maladies digestives Lausanne
Avenue Louis-Ruchonnet 30
1003 Lausanne
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Les maladies inflammatoires chroniques (MICI) ne peuvent se résumer à deux maladies distinctes et doivent être considérées comme un spectre de maladies variant dans leur étendue d’atteinte, leur sévérité et leur évolutivité. Il est donc capital de mieux catégoriser les patient(e)s en fonction de critères cliniques mais également d’intégrer des facteurs génétiques, immunologiques et environnementaux dans nos décisions stratégiques.
Les maladies inflammatoires chroniques de l’intestin (MICI), regroupant sous le même terme la maladie de Crohn et la colite ulcéreuse, sont caractérisées par le développement d’une réponse inflammatoire digestive exagérée au microbiote intestinal. Les causes de ces maladies sont multiples incluant des facteurs de risques génétiques, environnementaux ou immunologiques.1 Le risque génétique est considéré comme faible puisqu’on estime que 2–14% des patient(e)s ont une anamnèse familiale positive pour la maladie de Crohn chez des parents de premier degré contre 8–14% dans la colite ulcéreuse.2 D’autres facteurs externes viennent modifier ce risque comme le tabagisme chronique, la composition de la flore microbienne, l’alimentation ou encore l’exposition aux antibiotiques durant l’enfance.3
L’histoire naturelle des MICI est très variable d’un(e) patient(e) à l’autre avec classiquement des phases de poussée inflammatoire en alternance avec des phases de rémission plus ou moins grandes. Dans certaines situations, il peut y avoir une évolution lentement progressive de l’atteinte sans intervalle de rémission. De surcroît, la rapidité avec laquelle la maladie va progresser sera très variable d’une situation à l’autre. Il est donc très difficile d’identifier lors du diagnostic initial les patient(e)s ayant une maladie agressive de ceux ayant une maladie plus indolente.4 Ceci est néanmoins capital pour bien sûr améliorer le bien-être du (de la) patient(e) en agissant sur les symptômes (douleurs chroniques, troubles du transit, perte pondérale…) mais aussi limiter les risques de complications de ces maladies qui incluent les résections chirurgicales, les hospitalisations et à plus long terme les risques oncologiques. L’identification des patient(e)s à haut risque constitue donc un enjeu thérapeutique capital car cette catégorie de patient(e)s bénéficie d’une thérapie précoce et agressive avec notamment l’instauration rapide d’un traitement biologique.
Stratification des patient(e)s et identification des individus à haut risque
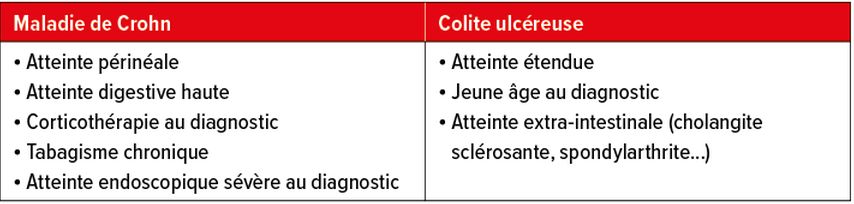
À l’heure actuelle, très peu de facteurs sont pris en compte pour stratifier les patient(e)s souffrant de MICI et tenter d’identifier les individus à haut risque. Les critères actuels de mauvais pronostic sont résumés dans le Tableau 1. Il s’agit pour la maladie de Crohn d’une atteinte périanale ou du tube digestif haut, du tabagisme chronique, de la sévérité au moment du diagnostic ou de la nécessité d’avoir recours à des stéroïdes au diagnostic.5 Pour la colite ulcéreuse, il s’agit de l’étendue de la maladie, l’âge au diagnostic et la présence de manifestations extra-digestives comme la cholangite sclérosante. Le délai avant l’établissement du diagnostic initial est un élément également très important, un délai diagnostic court étant de meilleur pronostic. La réduction du délai diagnostic et l’identification précoce des sujets à risque constituent donc un enjeu thérapeutique clé dans la gestion des patient(e)s MICI.6
De récentes données suggèrent que des facteurs génétiques permettraient d’identifier les patient(e)s ayant un moins bon pronostic. Il s’agit de gènes impliqués dans la réponse immunitaire adaptative et notamment dans la modulation de la réponse lymphocytaire T (FOXO3, XACT, IGFBP1 et la région MHC entre les gènes HLA-B et HLA-DR). La réponse au traitement et le risque de toxicité de certaines thérapies peut également être prédit par le biais de facteurs génétiques. Ceci est bien illustré pour les thiopurines où des mutations dans les gènes de la nudix hydrolase 15 (NUDT15) et la thiopurine-S-methyltransferase (TPMT) ont été associées à la toxicité médullaire de ces thérapies et leur activité de myélosuppression.7
Sélection des thérapies en fonction des caractéristiques du (de la) patient(e)
Bien que certains facteurs environnementaux soient influençables, il n’est pas possible à l’heure actuelle de n’agir que sur ces derniers pour lutter contre l’inflammation intestinale.
Ainsi, la majorité des stratégies thérapeutiques actuelles consistent en une immunomodulation plus ou moins ciblée sur les voies de signalisation activées au niveau muqueux et à l’origine de l’inflammation chronique. Alors que les thérapies conventionnelles combinant des corticostéroïdes à des immunosuppresseurs oraux étaient la pierre angulaire du traitement dans le courant du siècle dernier, l’avènement de thérapies biologiques plus ciblées a considérablement amélioré la prise en charge depuis le début du 2e millénaire. Citons parmi ces thérapies les agents bloqueurs du TNFα qui sont les molécules les plus utilisées jusqu’à présent après un échec des thérapies conventionnelles. Bien que très efficace dans certaines situations, bon nombre de patient(e)s se trouvent en situation d’échec primaire ou secondaire des thérapies.8
Depuis quelques années, plusieurs études ont permis d’identifier des biomarqueurs de réponse aux thérapies anti-TNF. Il s’agit de facteurs génétiques, immunologiques ou cellulaires. Ainsi, les études de West et al., ont permis d’identifier le facteur oncostatin M comme marqueur muqueux de mauvaise réponse aux thérapies anti-TNF.9 Des valeurs élevées au sein de la muqueuse de patient(e)s souffrant de colite ulcéreuse en poussée inflammatoire étaient ainsi associées à un état réfractaire aux thérapies anti-TNF. De manière importante, ceci restait vrai lorsque les taux muqueux étaient déterminés avant le traitement, permettant ainsi de prédire la réponse avant l’initiation de ce dernier. Bien qu’encore en cours d’évaluation pour la pratique clinique, ce facteur pourrait aider les thérapeutes à mieux choisir la meilleure thérapie pour un(e) patient(e) donné(e).
Choix de la séquence thérapeutique: Quel traitement et quand?
Le choix du type de traitement pour un individu donné va dépendre de plusieurs facteurs. On tentera bien sûr de choisir le traitement le plus efficace dans une situation donnée mais également celui avec le meilleur profil de sécurité. Ensuite, on tentera de choisir une thérapie qui ne compromettra pas l’instauration future d’autres molécules en cas d’échec. Les MICI étant des maladies chroniques, la probabilité de maintenir un état de rémission sur le long terme sera un élément clé à intégrer dans la décision thérapeutique. Finalement, la décision thérapeutique pourra être influencée par des circonstances spéciales comme la grossesse, l’apparition de manifestations extra-digestives ou des comorbidités.
En terme d’efficacité, plusieurs études comparatives ont vu le jour dans la colite ulcéreuse ces dernières années. Ainsi, l’étude VARSITY a comparé l’efficacité de l’adalimumab à celle du vedolizumab chez des patients avec colite ulcéreuse et n’ayant jamais été exposés (ou naïfs) aux thérapies biologiques. Après une année de suivi, 31,3% contre 22,5% des patient(e)s étaient en rémission clinique sous vedolizumab et adalimumab respectivement (p=0,006; IC à 95%: 2,5–15,0). Cette différence était également significative pour la rémission endoscopique (39,7% versus 27,7% pour le vedolizumab et l’adalimumab respectivement; p<0,001; IC à 95%: 5,3–18,5).10 Dans l’étude EVOLVE, cette différence d’efficacité n’était pas significative mais le vedolizumab était associé à un meilleur profil de sécurité avec un taux d’effet indésirable sévère inférieur aux anti-TNF (hazard ratio ajusté: 0,34; IC à 95%: 0,19–0,63).11
En terme de persistance du traitement, soit le temps durant lequel le(la) patient(e) reste sous thérapie avec une efficacité maintenue, l’étude PANIC décrivait un effet supérieur du vedolizumab sur l’infliximab et l’adalimumab. Ainsi, à 12 mois, 73,4% des patient(e)s avec colite ulcéreuse étaient encore sous vedolizumab contre 61,1% pour l’infliximab et 45,5% pour l’adalimumab (p<0,001).12
Finalement, des données préliminaires présentées au congrès ECCO 2022 montraient un taux de changement thérapeutique inférieur pour le vedolizumab en comparaison aux anti-TNF (étude VEDOIBD).13
En conclusion, le vedolizumab semble plus efficace que les anti-TNF chez les patients naïfs de thérapie biologique et souffrant de colite ulcéreuse active. Cette efficacité augmentée est couplée à une meilleure persistance de cet effet dans le temps.
Pour l’ustekinumab, il n’y a actuellement pas de donnée publiée sur son efficacité comparative à d’autres thérapies dans la colite ulcéreuse. Néanmoins, l’étude SEAVUE a comparé l’uteskinumab à l’adalimumab dans la maladie de Crohn.14 À un an de suivi, les taux de rémission, réponse clinique et rémission endoscopique étaient similaires entre les deux molécules. Cette grande étude conduite sur 386 patient(e)s dans 121 sites a été remise en question plus récemment par deux études monocentriques et de plus petite taille. Ces dernières ont en effet démontré la supériorité des anti-TNF et de l’adalimumab sur l’ustekinumab en terme de réponse clinique à 3 mois15 et de rémission endoscopique à 26–52 semaines.16
Les données concernant la deuxième et la troisième ligne thérapeutiques sont encore émergentes et sujettes à controverse. Les études ne sont actuellement disponibles que sous format de résumés de congrès. L’étude Bioressource des Royaume-Unis a comparé l’ustekinumab au vedolizumab en deuxième ligne après thérapie anti-TNF dans un collectif de patient(e)s souffrant de la maladie de Crohn. Cette dernière n’a vu aucune différence en terme d’efficacité de ces deux thérapies sur un suivi allant jusqu’à 5 ans.17 Par contre, le vedolizumab était moins efficace que l’ustekinumab lorsqu’il était administré en troisième ligne et l’ustekinumab était supérieur au vedolizumab en cas de localisation iléale.17 À l’inverse, l’ustekinumab gardait le même niveau d’efficacité qu’il soit administré en deuxième ou troisième ligne après les anti-TNF et le vedolizumab.18
Conclusions et perspectives
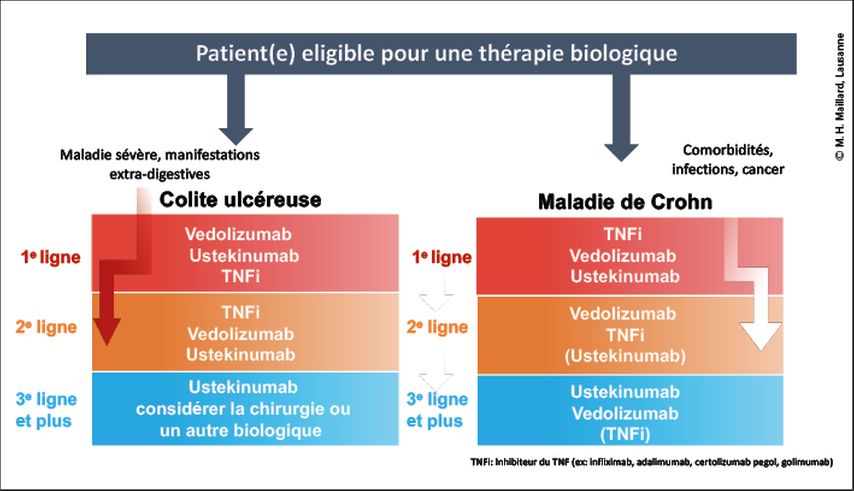
Les MICI ne peuvent se résumer à deux maladies distinctes et doivent être considérées comme un spectre de maladies variant dans leur étendue d’atteinte, leur sévérité et leur évolutivité. Il est donc capital de mieux catégoriser les patient(e)s en fonction de critères cliniques mais également d’intégrer des facteurs génétiques, immunologiques et environnementaux dans nos décisions stratégiques. Certains marqueurs moléculaires permettent de prédire la réponse à une thérapie biologique donnée et devraient progressivement arriver en pratique clinique. Finalement, le nombre de molécules biologiques actuellement disponibles pour les MICI est en pleine croissance et les études comparatives sont très importantes pour nous permettre de déterminer la séquence des thérapies chez un individu donné (Fig. 1). Avec l’essor de nouvelles stratégies thérapeutiques, illustré par l’avènement des inhibiteurs des janus kinases ou de la sphingosine monophosphate, le positionnement de chaque classe médicamenteuse sera de plus en plus complexe. Des combinaisons thérapeutiques sont également en cours d’évaluation avec des données prometteuses pour le futur.
Littérature:
1 de Souza HSP, Fiocchi C: Immunopathogenesis of IBD: current state of the art. Nat Rev Gastroenterol Hepatol 2016; 13: 13-27 2 Torres J, Colombel JF: Genetics and phenotypes in inflammatory bowel disease. Lancet 2016; 387: 98-100 3 Ananthakrishnan AN et al.: Lifestyle, behaviour, and environmental modification for the management of patients with inflammatory bowel diseases: an International Organization for Study of Inflammatory Bowel Diseases consensus. Lancet Gastroenterol Hepatol 2022; 7: 666-78 4 Walsh E et al.: Clinical predictors and natural history of disease extension in patients with ulcerative proctitis. Inflamm Bowel Dis 2017; 23:2035-41 5 Cosnes J et al.: Factors affecting outcomes in Crohn’s disease over 15 years. Gut 2012; 61: 1140-5 6 Vavricka SR et al.: Systematic evaluation of risk factors for diagnostic delay in inflammatory bowel disease. Inflamm Bowel Dis 2012; 18: 496-505 7 Verstockt B et al.: How dowepredict a patient’s disease course and whether they will respond to specific treatments? Gastroenterol 2022; 162: 1383-95 8 Torres J et al.: ECCO Guidelines on therapeutics in Crohn’s disease: medical treatment. J Crohns Colitis 2019; 14: 4-22 9 West NR et al.: Oncostatin M drives intestinal inflammation and predicts response to tumor necrosis factor–neutralizing therapy in patients with inflammatory bowel disease. Nat Med 2017; 23: 579-89 10 Sands BE et al.: Vedolizumab versus adalimumab for moderate-to-severe ulcerative colitis. New Engl J Med 2019; 381: 1215-26 11 Bressler B et al.: Vedolizumab and anti-TNFα real-world outcomes in biologic-naïve inflammatory bowel disease patients: results from the EVOLVE study. J Crohns Colitis 2021; 15: jjab058 12 Ko Y et al.: Superior treatment persistence with ustekinumab in Crohn’s disease and vedolizumab in ulcerative colitis compared with anti-TNF biological agents: real-world registry data from the Persistence Australian National IBD Cohort (PANIC) study. Aliment Pharmacol Ther 2021; 54: 292-301 13 Plachta-Danielzik S et al.: OP17 Maintenance phase propensity score adjusted effectiveness and persistence at week-52 in biologic-naïve ulcerative colitis patients treated with vedolizumab or anti-TNF (VEDO IBD-study). J Crohns Colitis 2022; 16: i018-9 14 Sands BE et al.: Ustekinumab versus adalimumab for induction and maintenance therapy in biologic-naive patients with moderately to severely active Crohn’s disease: a multicentre, randomised, double-blind, parallel-group, phase 3b trial. Lancet 2022: 399: 2200-11 15 Riviere P et al.: P524 Compared efficacy of ustekinumab and anti-TNF agents as first-line biological therapy in luminal Crohn’s disease. J Crohns Colitis 2022; 16: i479 16 Moens et al.: Adalimumab versus ustekinumab as first-line biological in moderate-to-severe Crohn’s disease: real-life cohort from a tertiary referral center. Eur J Gastroenterol Hepatol 2022; 34: 1015-20 17 Desoki R et al.: DOP74 Comparative effectiveness of vedolizumab and ustekinumab in Crohn’s disease patients who failed anti-TNF treatment: Interrogating 1019 patients from the UK IBD BioResource. J Crohns Colitis 2022; 16: i117-8 18 Alsoud D et al.: P447 Positioning of ustekinumab affects its effectiveness, drug persistence and serum exposure in Crohn’s disease. J Crohns Colitis 2022; 16: i427-8
Das könnte Sie auch interessieren:
Les conjugués anticorps-médicament ont le vent en poupe
Actuellement, de nombreux conjugués anticorps-médicament sont en cours d’évaluation dans le cancer du poumon. Qu’ils soient utilisés seuls ou en combinaison avec d’autres thérapies ...
Effets sur la santé ainsi que risques liés au travail posté et de nuit
Le travail posté et de nuit entraîne un risque accru de multiples problèmes de santé en raison de la perte de sommeil et de la désynchronisation circadienne. Il s’agit notamment de ...
Les défis des interfaces interdisciplinaires
Face à un éventail croissant d’options ciblées et immunothérapeutiques, les tests moléculaires sont de plus en plus au centre de l’attention dans les tumeurs gastro-intestinales. Des ...