Maladies des voies biliaires et du pancréas – démarche diagnostique et procédures endoscopiques
Auteur·es:
PD Dr méd. Emanuel Burri
Chefarzt
Dre méd. Christina Raichle
Leitende Ärztin
Klinik Gastroenterologie und Hepatologie
Kantonsspital Baselland, Liestal
E-mail: emanuel.burri@ksbl.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Les procédures endoscopiques de diagnostic ainsi que de traitement des maladies des voies biliaires et du pancréas se sont considérablement développées ces dernières années. L’échographie endoscopique (EUS) et la cholangiopancréatographie rétrograde endoscopique (ERCP) offrent aujourd’hui de nombreuses options thérapeutiques qui sont peu invasives et peuvent remplacer des procédures chirurgicales ou radiologiques.
Keypoints
-
En cas de cholédocholithiase complexe, la cholangioscopie avec SpyGlassTM-DS-II offre la possibilité d’une visualisation directe et d’une fragmentation électrohydraulique ciblée des concrétions sous contrôle visuel dans les voies biliaires.
-
Le drainage des voies biliaires guidé par EUS est nettement supérieur à celui percutané en termes de succès technique et de résultat clinique.
-
L’examen visuel des sténoses suspectes des voies biliaires avec la cholangioscopie avec SpyGlass a une précision diagnostique de 80 à 90%.
-
En cas de pancréatite chronique, les traitements endoscopiques permettent un soulagement de la douleur à long terme chez jusqu’à 74% des patients.
Maladies des voies biliaires
Cholédocholithiase
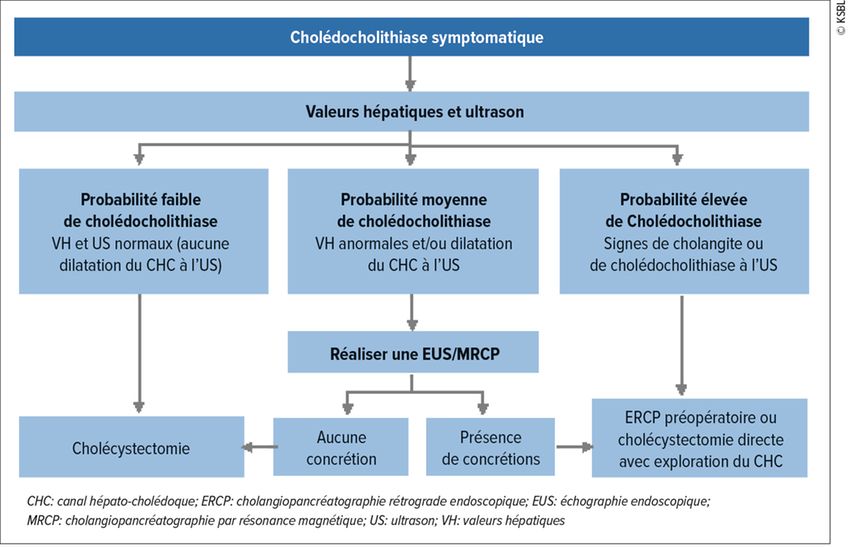
Les calculs des voies biliaires (cholédocholithiase) apparaissent chez 8 à 18% de tous les patients souffrant de calculs de la vésicule biliaire (cholécystolithiase).1 Les patients se plaignent de douleurs de type colique dans le quadrant supérieur droit de l’abdomen (20 min à plusieurs heures), associées à des nausées, des vomissements et, fréquemment, un ictère. L’échographie abdominale permet d’évaluer les voies biliaires intra- et extrahépatiques et, combinée aux analyses de laboratoire, d’orienter les examens supplémentaires (Fig. 1). En cas de forte probabilité de cholédocholithiase, une cholangiopancréatographie rétrograde endoscopique (ERCP) peut être réalisée directement. Si des examens supplémentaires sont indiqués, une échographie endoscopique (EUS) est généralement effectuée. Si celle-ci révèle une cholédocholithiase, l’ECRP peut être pratiquée au cours de la même séance. Selon l’expertise locale, une cholangiopancréatographie par résonance magnétique (MRCP) peut être réalisée comme alternative à l’EUS.2
L’ERCP est le traitement de première intention de la cholédocholithiase. Après intubation de l’ampoule hépatopancréatique à l’aide du fil-guide, on pratique généralement une ampullectomie. Parfois, il est également nécessaire de procéder à une dilatation par ballonnet de l’ampoule afin que l’ouverture soit suffisamment grande pour permettre l’extraction des concrétions.2 La pancréatite post-ERCP représente la complication la plus fréquente après ce traitement. L’incidence est de 3,5 à 9,7%. D’autres complications plus rares sont la cholangite, la cholécystite, l’hémorragie et la perforation.3
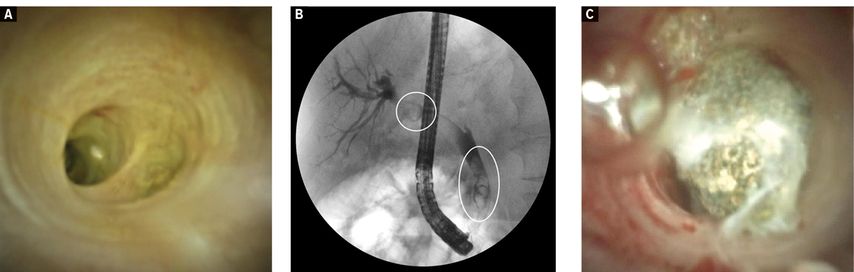
On distingue la cholédocholithiase simple de celle complexe. Une situation complexe est définie par le diamètre du calcul (>1,5cm), le nombre de concrétions (>3), leur forme (en forme de tonneau), leur localisation (intrahépatique, dans le canal cystique) ainsi que par des facteurs anatomiques (canal hépato-cholédoque [CHC] distal étroit par rapport à la concrétion, CHC sigmoïde, calcul impacté). Alors que les petits calculs peuvent être extraits directement des voies biliaires au moyen d’un cathéter à ballonnet ou à panier, une fragmentation (lithotripsie) est souvent nécessaire en cas de cholédocholithiase complexe. Celle-ci peut être effectuée mécaniquement au moyen de cathéters spéciaux ou de la méthode utilisée auparavant, à savoir la lithotripsie extracorporelle (ESWL). Dans les centres d’endoscopie, il est également possible de fragmenter les concrétions sous contrôle visuel au moyen d’un cholangioscope mono-opérateur (SpyGlassTM DS II, Boston Scientific Corp., MA,États-Unis) par lithotripsie électrohydraulique (EHL) ou d’une sonde laser YAG. Le cholangioscope est introduit dans le canal biliaire via le canal opérateur de l’endoscope (principe «Mother-Baby») et permet de visualiser les concrétions. Une sonde EHL bipolaire de 1mm de largeur peut alors être introduite via le canal opérateur du cholangioscope. Des décharges électriques sont déclenchées à son extrémité, ce qui génère des ondes de choc dans le milieu aqueux par expansion du plasma avec formation d’une bulle de cavitation (Fig. 2). Même les grosses concrétions peuvent être fragmentées avec succès dans 95% des cas.2,4
Fig. 2: Cholangioscopie mono-opérateur (SpyglassTM DS II) en cas de cholédocholithiase complexe. A: Voies biliaires normales; B: Concrétions multiples dans le CHC (ERCP); C: Concrétions dans le CHC (cholangioscopie)
Une anatomie modifiée, par exemple par un diverticule duodénal ampullaire ou après des opérations (p.ex. procédure de Billroth II, dérivation gastrique Roux-en-Y), peut rendre l’ERCP très complexe sur le plan technique. Chez les patients ayant subi une dérivation gastrique Roux-en-Y, l’accès biliaire est uniquement possible au moyen d’une ERCP assistée par entéroscopie, d’une ERCP transgastrique assistée par laparoscopie ou d’une ERCP transgastrique guidée par EUS (EDGE). Dans ce dernier cas, une endoprothèse métallique guidée par EUS est mise en place pour connecter l’estomac réséqué à la poche gastrique résiduelle (gastro-gastrostomie) ou au jéjunum (gastro-jéjunostomie). L’ERCP peut alors être réalisée via cet accès. L’EDGE est comparable à l’ERCP assistée par laparoscopie en termes de taux de réussite (97% par rapport à 97%), mais elle est nettement supérieure à l’ERCP assistée par entéroscopie (100% par rapport à 60%).5,6
Cholécystite aiguë
Le diagnostic de cholécystite peut généralement être posé au moyen d’une échographie abdominale. On observe typiquement un épaississement de la paroi de la vésicule biliaire (>3mm), à plusieurs couches, et parfois du liquide dans la fosse de la vésicule biliaire. La prise en compte de l’échographie Doppler permet en outre de constater une hyperémie. Environ 95% des patients atteints de cholécystite aiguë présentent une cholécystolithiase. En l’absence de traitement, la cholécystite entraîne une perforation couverte dans 10% des cas et une perforation libre dans 1% des cas.7,8
La cholécystectomie laparoscopique est le «gold standard» pour le traitement de la cholécystite aiguë. Chez les patients qui ne se qualifient pas pour un traitement chirurgical en raison de comorbidités sévères, un drainage interventionnel de la vésicule biliaire peut être réalisé comme alternative. Outre le drainage percutané de la vésicule biliaire (PT-GBD), le drainage de la vésicule biliaire guidé par EUS (EUS-GBD) s’est établi comme une option supplémentaire au cours des dernières années. Plusieurs études comparant ces deux options thérapeutiques ont montré une supériorité en termes de succès technique (96% par rapport à 89%) et un meilleur résultat clinique en termes de taux de complications à 1 an (25,6% par rapport à 77,5%), de nécessité de réintervention à 30 jours (2,6% par rapport à 30%) et de réadmissions non planifiées (15,4% par rapport à 50%) dans le groupe EUS-GBD par rapport au groupe PT-GBD.9,10 Ainsi, les directives internationales actuelles recommandent également de privilégier l’EUS-GBD au PT-GBD.11
Sténoses des voies biliaires
Il convient de distinguer les sténoses bénignes et malignes des voies biliaires. Les causes bénignes des sténoses biliaires comprennent les causes iatrogènes (p.ex. après une transplantation hépatique ou une cholécystectomie), les modifications inflammatoires (notamment la cholangite sclérosante primitive, la cholangiopathie associée aux IgG4, la cholangite auto-immune, la pancréatite chronique et auto-immune), le syndrome de Mirizzi et la cholangiopathie ischémique. Dans 76 à 85% des cas, la cause est cependant maligne (adénocarcinome du pancréas, cholangiocarcinome).12 La cholangioscopie s’est établie comme nouvelle méthode diagnostique dans le diagnostic des sténoses des voies biliaires indéterminées. L’examen visuel des sténoses suspectes des voies biliaires permet à lui seul d’obtenir une précision diagnostique de 80 à 90%, car les modifications néoplasiques présentent typiquement une forme papillaire ainsi qu’une structure vasculaire irrégulière. Les biopsies ciblées ont une sensibilité plus faible, de 60 à 85%.13 En comparaison, la sensibilité de la cytologie à la brosse pendant une ERPC s’élève seulement à 42%.14
Les sténoses bénignes des voies biliaires sont généralement traitées par dilatation endoscopique (cathéter à ballonnet ou bougie) et mise en place séquentielle de multiples endoprothèses en plastique en plusieurs séances. Le taux de réussite peut atteindre 94% avec cette technique, par rapport à 60% avec la pose d’une seule endoprothèse en plastique. Les complications les plus fréquentes sont la cholangite, la pancréatite, l’occlusion et la dislocation de l’endoprothèse.15,16 Il est également possible d’utiliser des endoprothèses métalliques auto-expansibles entièrement recouvertes («fully covered», fcSEMS), bien que celles-ci ne soient pas supérieures à celles en plastique en termes de succès du traitement de la sténose.17 Une nouvelle option est également disponible, à savoir les endoprothèses auto-expansibles biodégradables, qui présentent un taux de succès clinique de 83%, bien que les données cliniques soient encore limitées à ce jour.18
Le traitement des sténoses malignes des voies biliaires est souvent palliatif, car environ 70% sont déjà inopérables au moment du diagnostic. Malgré un taux de récidive plus faible en cas d’anastomose biliodigestive réalisée chirurgicalement par rapport aux endoprothèses biliaires, les procédures endoscopiques sont généralement privilégiées en raison d’un taux de complications et d’une mortalité plus faibles (10% par rapport à 16%).19,20 Hormis pour les sténoses dans la région du hile (utilisation d’une endoprothèse métallique auto-expansible [SEMS] nue dans la plupart des cas), ce sont principalement des fcSEMS qui sont utilisées. Plusieurs méta-analyses n’ont cependant pas observé de différence significative entre les SEMS nues et les fcSEMS en termes de résultat clinique.11,21,22 Pour augmenter l’ouverture de l’endoprothèse, une ablation par radiofréquence peut être réalisée en complément, bien que son utilité n’ait pas été clairement démontrée.23
Les centres spécialisés pratiquent également de plus en plus des procédures de drainage des voies biliaires guidées par EUS (EUS-BD), surtout lorsque l’accès transpapillaire classique n’est pas possible.11,21 Elle présente un taux de complications et de réintervention plus faible par rapport au drainage biliaire transhépatique percutané (PTBD), qui était la procédure la plus courante auparavant, tout en offrant un taux de réussite identique.24 Dans le cas de l’EUS-BD, il existe trois accès différents: soit un fil-guide peut être introduit dans le duodénum par voie transhépatique en utilisant la technique du rendez-vous guidée par EUS ou par le biais du CHC antérograde via la papille; soit aucun accès direct non anatomique n’est possible et une endoprothèse métallique peut être mise en place. Cela peut se faire en connectant l’estomac au foie (hépato-gastrostomie), ou le duodénum au canal cholédoque (cholédoco-duodénostomie) ou à la vésicule biliaire (cholécysto-gastrostomie, cholécysto-duodénostomie). Pour tous ces accès, une ponction guidée par EUS est réalisée à l’aide d’une canule 19G et un fil-guide est inséré. Une endoprothèse métallique d’apposition luminale («lumen-apposing», LAMS) est alors généralement mise en place par ce biais. Les premières études ont montré que le succès technique (91–94%) et clinique de l’EUS-BD est similaire, voire supérieur, à celui de l’ERCP, et que la procédure présente un taux de complications similaire, voire inférieur (surtout moins de pancréatites).25–27 Une étude récente a également montré que l’EUS-BD est supérieure à l’ERCP avant la chirurgie hépatobiliaire en termes de taux de succès chirurgical clinique et technique (97% par rapport à 75%, 97% par rapport à 83%) et que les durées d’hospitalisation sont plus courtes.28 D’autres études randomisées contrôlées sont actuellement en cours pour déterminer si l’EUS-BD primaire est également supérieure à l’ERCP à long terme en cas de sténose maligne des voies biliaires.29,30
Maladies du pancréas
Pancréatite aiguë
La cause la plus fréquente de pancréatite aiguë est la lithiase biliaire, qui représente 17 à 40% des cas. Si une concrétion peut être détectée dans le CHC en cas de pancréatite biliaire aiguë, une ERCP doit être réalisée dans les 72 heures pour le drainage biliaire. En cas de cholangite supplémentaire, l’ERCP doit être envisagée dès les premières 24 heures. De plus, une cholécystectomie devrait être effectuée rapidement.2,31–33
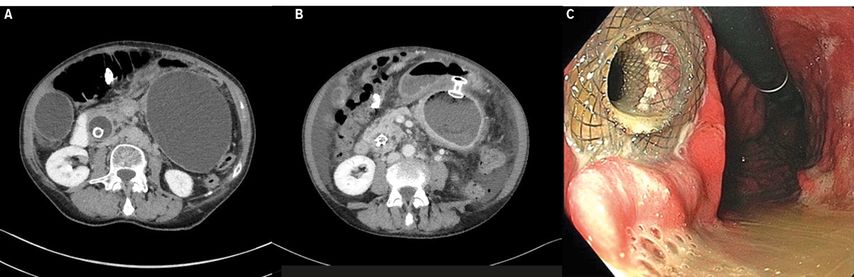
Jusqu’à 10% des cas de pancréatite aiguë sont suivis de complications locales, telles que la formation de collections de liquide (péri)-pancréatique, de pseudokystes pancréatiques, de collections nécrotiques aiguës ainsi que de nécroses circonscrites («Walled-off necrosis», WON). La plupart des patients présentant des pseudokystes sont asymptomatiques. Si les pseudokystes de grande taille provoquent des douleurs abdominales ou une sténose du pylore, il convient de procéder à un drainage des collections. Un drainage est également indiqué en cas de nécrose infectée ou de WON symptomatique. Le cas échéant, on utilise de nos jours principalement des procédures transgastriques ou transduodénales guidées par EUS. Une ponction guidée par EUS de la collection de liquide est réalisée, un fil-guide est inséré et une endoprothèse en plastique ou une LAMS est mise en place. La mise en place d’une LAMS est plus simple et plus rapide sur le plan technique. Avec un système de cathéter dédié, la ponction peut être électrocautérisée sans fil-guide et l’endoprothèse peut être mise en place directement. Les LAMS présentent de larges collerettes d’ancrage des deux côtés ainsi qu’une grande lumière qui doit empêcher l’occlusion par les tissus nécrosés (Fig. 3). Dans le cas d’une WON, une nécrosectomie endoscopique peut également être réalisée via la large lumière de la LAMS.33,34 Une méta-analyse récente comparant l’utilisation de LAMS et d’endoprothèses en plastique pour le drainage des pseudokystes pancréatiques et de la WON a montré des taux de succès technique (97,6% par rapport à 97,5%) et clinique (90,1% par rapport à 84,2%) similaires pour les deux types d’endoprothèses. Cependant, le groupe LAMS a présenté un taux de complications significativement plus faible (16% par rapport à 20,2%).33,35
Fig. 3: Pseudokyste pancréatique de grande taille avant et après la mise en place transgastrique d’une LAMS. A) Pseudokyste sans LAMS (TDM); B) Pseudokyste avec LAMS (TDM); C) Image endoscopique d’une LAMS mise en place
Pancréatite chronique
La pancréatite chronique (PC) est une maladie évolutive caractérisée par une inflammation chronique, une fibrose du parenchyme pancréatique ainsi que la perte des cellules acineuses et des îlots de Langerhans. Cela peut conduire à une insuffisance pancréatique exocrine et endocrine au cours de l’évolution de la maladie. Parmi les autres complications de la PC pour lesquelles des options thérapeutiques endoscopiques sont disponibles, on peut citer, outre les pseudokystes pancréatiques et les sténoses des voies biliaires (voir ci-dessus), les sténoses du canal pancréatique ainsi que la lithiase pancréatique.36
Si une sténose du canal pancréatique est constatée, il faut toujours exclure une cause maligne avant tout traitement endoscopique. Une dilatation séquentielle et la mise en place d’endoprothèses multiples dans le canal pancréatique sur une période d’un an sont recommandées comme traitement de première intention d’une sténose symptomatique dominante.34 Les endoprothèses métalliques n’apportent ici aucun avantage par rapport à celles en plastique.37 La mise en place d’une endoprothèse dans le canal pancréatique permet de soulager la douleur à court terme dans 88% des cas; la mise en place d’endoprothèses multiples permet de soulager la douleur à long terme (9,5 ans) dans 69 à 74% des cas. Une resténose se produit dans jusqu’à 10,4% des cas. Le taux de complications lors des interventions endoscopiques pour le traitement des sténoses est d’environ 8%, les plus fréquentes étant les pancréatites, les occlusions et les migrations d’endoprothèses.38,39
Dans les cas où la mise en place d’une endoprothèse transpapillaire guidée par ERCP échoue, un accès transgastrique guidé par EUS, plus sophistiqué, est possible. Le canal pancréatique est ponctionné depuis l’estomac et un fil-guide est inséré dans le canal pancréatique dilaté jusque dans le duodénum via la papille duodénale majeure (technique du rendez-vous), de sorte que l’endoprothèse puisse être mise en place par ERCP par le biais du fil-guide. La mise en place de l’endoprothèse peut sinon être effectuée directement par voie transgastrique (pancréatico-gastrostomie guidée par EUS).40 Une méta-analyse récente a montré un taux de succès technique et clinique de ces interventions de 85% et 89%, respectivement, avec un taux de complications plus élevé par rapport à la mise en place d’une endoprothèse par ERCP conventionnelle (total: 18,1%, pancréatite aiguë: 6,6%, hémorragie: 4,1%, perforation et/ou pneumopéritoine: 3,1%).41 Ces interventions sont donc uniquement réalisées dans des centres sélectionnés.
Chez plus de 50% des patients atteints de PC, des concrétions de ganglions pancréatiques se forment. La prévalence des concrétions augmente avec la durée de la maladie et atteint respectivement 50% et 100% après 5 et 14 ans à compter du début de la maladie.42 Pendant de nombreuses années, l’ESWL a été la seule option thérapeutique non chirurgicale disponible. Aujourd’hui, la pancréaticoscopie mono-opérateur (SpyGlassTM DS II) combinée à une sonde EHL ou à une sonde laser YAG permet une lithotripsie directe.34 Dans les études rétrospectives menées jusqu’à présent, le taux de réussite se situait entre 43 et 100%.43 Un travail prospectif multicentrique récemment publié a pu mettre en évidence, grâce à l’utilisation de cette option thérapeutique endoscopique, une élimination complète des concrétions dans 90% des cas avec une réduction de la douleur observée jusque dans 82,4% des cas.44
Perspectives
L’endoscopie interventionnelle pour les maladies des voies biliaires et du pancréas s’est beaucoup développée ces dernières années, de sorte que de nouvelles procédures, telles que les drainages biliaires guidés par EUS et les interventions endoscopiques sur le pancréas, peuvent remplacer des interventions chirurgicales plus invasives ainsi que l’ERCP conventionnelle. Des études randomisées contrôlées doivent être menées pour déterminer si ces nouvelles options thérapeutiques endoscopiques sont réellement supérieures à celles établies jusqu’à présent. Il convient également d’évaluer si l’utilisation de ces procédures en dehors des centres spécialisés est judicieuse.
Littérature:
1 Ko CW, Lee SP: Gastrointest Endosc 2002; 56: 165-9 2 Manes G et al.: Endoscopy 2019; 51: 472-91 3 Dumonceau JM et al.: Endoscopy 2020; 520: 127-49 4 Gutierrez OIB et al.: Clin Gastroenterol Hepatol 2018; 16: 918-26.e1 5 Bukhari M et al.: Clin Gastroenterol Hepatol 2018; 88: 484-94 6 Prakash S et al.: Endoscopy 2022; 54: 52-61 7 Date RS et al.: Int J Surg 2012; 10: 63-8 8 Halpin V: BMJ Clin Evid 2014: 0411 9 Teoh AYB et al.: Gut 2020; 69: 1085-91 10 Mohan BP et al.: Endoscopy 2020; 52: 96-106 11 Van der Merwe SW et al.: Endoscopy 2022; 54: 185-205 12 Singh A et al.: Gastroenterol Rep (Oxf) 2015; 3: 22-31 13 Navaneethan U et al.: Gastrointest Endosc 2016; 84: 649-55 14 Burnett AS et al.: J Surg Res 2013; 184: 304-11 15 Costamagna G et al.: Gastrointest Endosc 2001; 54: 162-8 16 Van Boeckel P et al.: BMC Gastroenterol 2009; 9: 96 17 Visconti TAC et al.: Endosc Int Open 2018; 6: E914-23. 18 Siiki A et al.: Gastrointest Endosc 2018; 87: 1132-7 19 De Lima SLA et al.: Int J Hepatobiliary Pancreat Dis 2015; 5: 35 20 Distler M et al.: JOP 2010; 11: 568-74 21 Dumonceau JM et al.: Endoscopy 2018; 50: 910-30 22 Tringali A et al.: Endoscopy. 2018; 50: 631-41 23 Albers D et al.: Gastrointest Endosc 2022; 96: 970-9 24 Sharaiha RZ et al.: Gastrointest Endosc 2017; 85: 904-14 25 Paik WH et al.: Am J Gastroenterol 2018; 113: 987-97 26 Bang JY et al.: Gastrointest Endoc 2018; 88: 277-82 27 Park JK et al.: Gastrointest Endosc 2018; 88: 277-82 28 Tyberg A et al.: J Clin Gastroenterol 2022; doi: 10.1097/MCG.0000000000001795 29 Itonaga M et al.: Medicine (Baltimore) 2021; 100: e25268 30 Chen YI et al.: Trials 2019; 20: 696 31 Da Costa DW et al.: Lancet 2015; 386: 1261-8 32 Nealon WH et al.:Ann Surg 2004; 239: 741-9 33 Arvanitakis M et al.: Endoscopy 2018; 50: 524-46 34 Dumonceau JM et al.: Endoscopy 2019; 51: 179-93 35 Guzmán-Calderón E et al.: J Hepato-Biliary-Pancreatic Sci 2022; 29: 181-292, e1-e9 36 Forsmark CE: Gastroenterology 2013; 144: 1282-91.e3 37 Shen Y et al.: Pancreatol 2014; 14: 87-90 38 Jafri M et al.: JOP 2017; 18: 125-32 39 Tringali A et al.: Endoscopy 2019; 51: 930-5 40 Ergun M et al.: Endoscopy 2011; 43: 518-25 41 Chandan S et al.: Endosc Int Open 2020; 8: E1664-72 42 Ammann RW et al.: Gastroenterol 1984; 86: 820-8 43 Beyna T et al.: Dig Endosc 2018; 30: 29-37 44 Gerges C et al.: Endoscopy 2023; 55: 150-7
Das könnte Sie auch interessieren:
Les conjugués anticorps-médicament ont le vent en poupe
Actuellement, de nombreux conjugués anticorps-médicament sont en cours d’évaluation dans le cancer du poumon. Qu’ils soient utilisés seuls ou en combinaison avec d’autres thérapies ...
Effets sur la santé ainsi que risques liés au travail posté et de nuit
Le travail posté et de nuit entraîne un risque accru de multiples problèmes de santé en raison de la perte de sommeil et de la désynchronisation circadienne. Il s’agit notamment de ...
Les défis des interfaces interdisciplinaires
Face à un éventail croissant d’options ciblées et immunothérapeutiques, les tests moléculaires sont de plus en plus au centre de l’attention dans les tumeurs gastro-intestinales. Des ...