Les resténoses coronaires à l’époque des stents à élution médicamenteuse – de la pathogenèse au traitement
Auteurs:
Dr méd. Matthias Bossard
Dr méd. Adrian Attinger
PD Dr méd. Florim Cuculi
FMH en Médecine interne et Cardiologie avec specialisation en cardiologie interventionnelle
Klinik für Kardiologie
Herzzentrum – Luzerner Kantonsspital
Luzern
E-mail: matthias.bossard@luks.ch
Malgré des progrès majeurs dans le traitement percutané de la coronaropathie et l’introduction de stents modernes à élution médicamenteuse («drug-eluting stents»), la resténose demeure un problème fréquent. Le sujet de la resténose, de sa pathogenèse, de ses prédicteurs et de son traitement est résumé dans cet article.
Keypoints
-
Des resténoses avec réduction significative de la lumière du vaisseau après une ICP et l’implantation d’un stent se forment souvent en conséquence d’une prolifération néo-intimale incontrôlée.
-
En dépit de techniques d’ICP optimisées et de DES modernes, la resténose reste un problème fréquent et donc cliniquement pertinent. Les resténoses sont associées à des hospitalisations et interventions répétées, ainsi qu’à un risque accru de mortalité.
-
L’optimisation de la technique d’ICP, en particulier les techniques d’implantation, la technologie des stents/échafaudages, ainsi que l’individualisation des stratégies de traitement de la coronaropathie sont essentielles pour réduire davantage le risque de développer une RIS.
Depuis l’introduction de l’angioplastie dans les cas de sténose coronaire par Andreas Grüntzig et des stents coronaires par Ulrich Sigwart à la fin des années 1970 resp. des années 1980, le problème des resténoses après une intervention coronarienne percutanée (ICP) constitue un défi majeur pour les médecins concernés. Avec le développement rapide de la technologie de l’ICP et surtout l’introduction des ballonnets et stents à élution médicamenteuse, le taux de resténose a été considérablement réduit.1, 2 Initialement, des resténoses se produisaient chez 20–40% des patients quelques années après l’ICP; après l’introduction des stents à élution médicamenteuse («drug-eluting stents», DES) modernes, ce taux a été ramené à <10%, ce qui demeure toutefois un niveau considérablement élevé et est associé à de nombreux problèmes.1 La resténose demeure donc le tendon d’Achille de l’ICP.
Définition et pathogenèse
La resténose survient en réaction à une lésion de la paroi du vaisseau par l’ICP ou l’implantation d’un stent, laquelle entraîne finalement une réduction du diamètre intérieur du vaisseau (lumière du vaisseau). Sur une base purement angiographique, la resténose intra-stent (RIS) est définie comme une sténose à >50% à l’intérieur ou directement adjacente (≤5mm) à un segment de vaisseau préalablement traité par stent.2 Le développement de la resténose implique une interaction inflammatoire-régénérative complexe entre les composants cellulaires de la paroi du vaisseau coronaire, en particulier l’endothélium et les myocytes à paroi lisse ainsi que les monocytes, les lymphocytes et les plaquettes.2 Après une angioplastie par ballonnet uniquement, le développement de la resténose implique principalement des processus de remodelage de la paroi du vaisseau (en particulier «remodelling» et «recoil»). Ce processus est principalement dû à un remodelage des structures de la paroi des vaisseaux au cours du processus de cicatrisation («remodelling») ou à un rétrécissement des vaisseaux coronaires («recoil»).2 En revanche, dans la RIS, on observe souvent une prolifération excessive de l’intima (hyperplasie néo-intimale) et ce qu’on appelle une néoathérosclérose (développement de plaques riches en lipides dans le segment doté d’un stent).2 La RIS s’observe après l’implantation de stents métalliques nus («bare-metal stents», BMS) ainsi que de DES.2 En introduisant des agents antiprolifératifs (paclitaxel ou analogues «-limus»), le risque de développement excessif d’une hyperplasie néo-intimale a été considérablement réduit (Fig. 1).
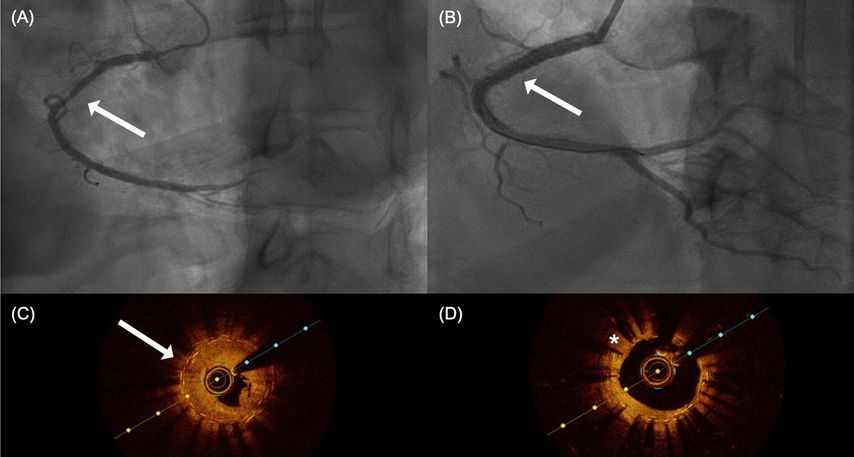
Fig. 1: Réduction de l’hyperplasie néo-intimale à l’aide de substances antiprolifératives. Comparaison figures A/C contre B/D
Facteurs de risque de resténoses
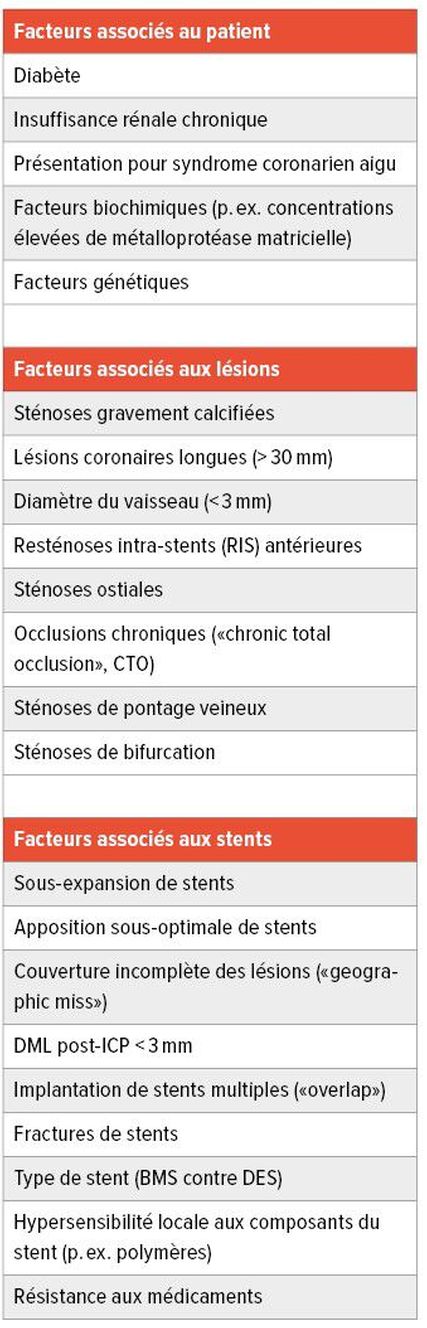
Tab. 1: Facteurs qui favorisent le développement des resténoses BMS: «bare-metal stent»; DES: «drug-eluting stent»; DML: diamètre minimal de la lumière; ICP: intervention coronarienne percutanée
Au cours des trois dernières décennies, de nombreux facteurs de risque de développement de resténoses (en particulier la RIS) ont été identifiés, l’imbrication des facteurs associés aux patients, aux lésions et à l’ICP conduisant finalement au problème (Tab. 1). Dans ce contexte, le diabète et l’insuffisance rénale ressortent certainement comme les facteurs les plus importants de développement d’une RIS.3 Cependant, il faut également noter qu’avec l’augmentation de la complexité et de la durée de la lésion traitée, le risque de développement d’une RIS augmente.3
Du point de vue interventionnel, une sous-expansion du stent implantée est certainement la cause la plus fréquente de RIS. Un prétraitement inadéquat de la lésion («lesion preparation»), un sous-dimensionnement des stents («undersizing»), l’absence de post-dilatation et un échec géographique de la lésion complète («geographic miss») jouent un rôle central.3 En outre, les fractures des stents (p.ex. dans des vaisseaux très tortueux) peuvent également favoriser le développement de RIS.3
Nous devons également être conscients que la présence d’une resténose en soi est un facteur de risque pertinent pour la récurrence d’une resténose. Ainsi par exemple, selon une étude récemment publiée, près de 20% de tous les patients qui ont dû être traités pour une RIS après l’implantation d’un DES à l’aide de ballonnets à élution médicamenteuse («drug-coated balloon», DCB) ont connu une récurrence de resténose dans les 6 à 9 mois.4
Les nouveaux stents
L’optimisation des plateformes de stents (p.ex. les stents au cobalt-chrome «thin-strut» avec des diamètres d’entretoise de 60 à 80μm), l’introduction de nouvelles substances antiprolifératives («-limus stents» avec p.ex. du sirolimus, de l’évérolimus ou du zotarolimus) et, plus récemment, les polymères optimisés ou manquants utilisés comme molécules de connexion/supports pour l’analogue «-limus» sur la plateforme métallique du stent ont encore réduit le risque d’hyperplasie néo-intimale et de néoathérosclérose et ont considérablement amélioré les résultats de l’ICP.2 Cela a également eu pour effet de permettre aux cardiologues interventionnels de traiter par voie percutanée des lésions qui, jusqu’à il y a quelques années, ne pouvaient être traitées que par pontage.
De la resténose au tableau clinique
Sur le plan clinique, une resténose peut demeurer longtemps inaperçue. Elle se manifeste généralement par l’apparition de symptômes associés à l’ischémie (typiquement angine et dyspnée) ou d’une ischémie silencieuse (p.ex., lors d’une ergométrie avec sous-décalages du segment ST) dès que la sténose devient pertinente sur le plan hémodynamique et provoque ainsi un trouble de la perfusion myocardique. Il est intéressant de noter qu’une analyse publiée récemment a révélé que la resténose se manifeste très souvent de manière aiguë en termes de syndrome coronarien aigu (SCA) (p.ex. par une angine instable).5 Par conséquent, les cliniciens doivent également être vigilants lorsque des patients ayant des antécédents d’ICP se plaignent de nouveaux symptômes suspects d’ischémie. La RIS est généralement connue pour être un prédicteur indépendant d’augmentation de la morbidité et de la mortalité chez les patients atteints de coronaropathie et doit être prise au sérieux.6 Pour cette raison, il est essentiel de surveiller sur le plan clinique les patients à intervalles réguliers après une ICP. Sachant que bien souvent, les antécédents et un simple test d’effort, comme par exemple l’ergométrie, à intervalles périodiques peuvent suffire. La réalisation de tests d’ischémie non invasifs (p.ex. scintigraphie de perfusion myocardique ou IRM cardiaque) ainsi que les re-coronarographies ne sont généralement recommandées que si des symptômes suggestifs sont présents (p.ex. angine progressive ou baisse de performance) ou s’il existe une forte suspicion d’ischémie silencieuse pertinente.
De la prévention au traitement des resténoses
Que la resténose ou une lésion native ait été traitée, l’objectif principal après une ICP avec ou sans implantation de stents est le traitement médicamenteux optimal de la coronaropathie sous-jacente. Cela signifie qu’en plus de la double thérapie antithrombotique par des antiplaquettaires – généralement de l’aspirine et un inhibiteur du P2Y12 (clopidogrel, ticagrélor ou pasugrel) – les facteurs de risque cardiovasculaires doivent être pris en charge de manière optimale. Il va sans dire qu’une réduction agressive des lipides (valeur cible actuelle du cholestérol LDL <1,4mmol/l ou 54mg/dl), l’abstinence de nicotine et le traitement du diabète réduisent le risque de resténose ainsi que la progression de la coronaropathie. Toutefois, il convient également de noter que les antiplaquettaires réduisent principalement le risque d’événements ischémiques, en termes d’infarctus aigus du myocarde et de thromboses sur stent, mais ont peu d’effet sur la progression des resténoses.
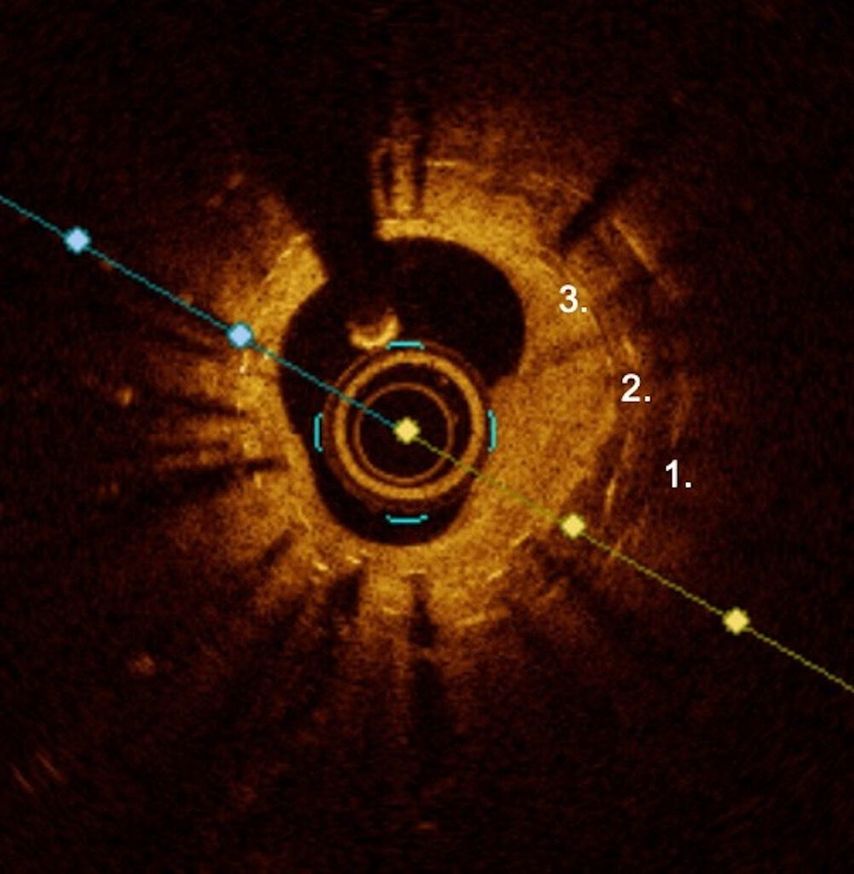
Jusqu’à il y a quelques années, les resténoses étaient généralement traitées principalement par simple angioplastie par ballonnet («plain old balloon angioplasty», POBA) ou implantation directe d’une nouvelle couche de stents. Malheureusement, cette méthode n’était souvent pas très efficace et de nombreux patients se sont retrouvés avec plusieurs couches et surtout de très longs segments de stents implantés, ce qui a souvent entraîné ce qu’on appelle le «phénomène de la peau d’oignon» (Fig. 2) ou une «full-metal jacket» en raison des stents étendus.
Ainsi, les options qui peuvent être utilisées pour le traitement de la RIS se sont désormais multipliées et une approche thérapeutique adaptée aux caractéristiques spécifiques de la lésion RIS devrait être adoptée. Il est recommandé d’utiliser l’imagerie intravasculaire – échographie intravasculaire (EIV) ou tomographie par cohérence optique (TCO) – à chaque fois que cela est possible pour déterminer les mécanismes conduisant à la RIS.7 Celle-ci doit également être corrigée.
Par exemple, une sous-expansion du stent peut être améliorée par une post-dilatation agressive avec des ballons non conformes (p.ex. par OPN NC Balloon®). Les plaques fibrotiques ou une hyperplasie néo-intimale excessive peuvent être traitées par «cutting/scoring balloon» pour regagner au final de la lumière. Dans le cas de lésions très calcifiées de RIS, il peut être nécessaire d’utiliser des méthodes techniques telles que l’athérectomie/rotablation® mécanique, l’athérectomie au laser ou la lithoplastie intravasculaire (Shockwave®).8
L’ambition de traiter une resténose «sans métal» et de prévenir le «phénomène de la peau d’oignon» a conduit au développement de ballonnets à élution médicamenteuse.2, 8 L’idée de base est d’appliquer une substance antiproliférative (paclitaxel ou sirolimus) après dilatation de la sténose, ce qui devrait empêcher le développement d’une hyperplasie néo-intimale. Ainsi, avec ces idées de base, les échafaudages biorésorbables ont également été testés en cas de RIS. La question de savoir s’il est préférable de traiter les RIS par DCB ou DES continue à donner lieu à des discussions. Plusieurs études et méta-analyses ont suggéré que les lésions traitées par DES moderne, en particulier les stents à élution d’évérolimus (p.ex. DES Xience®), ont de meilleures chances d’avoir de meilleurs résultats à long terme.1, 7, 8 Toutefois, il existe maintenant un consensus sur le fait que le traitement de la resténose doit être spécifiquement adapté à la thérapie sous-jacente. Par exemple, les DES modernes semblent être supérieurs aux DCB, en particulier en cas de néoathérosclérose.8
Littérature:
1 Siontis GC et al.: Percutaneous coronary interventional strategies for treatment of in-stent restenosis: a network meta-analysis. Lancet 2015; 386: 655-64 2 Buccheri D et al.: Understanding and managing in-stent restenosis: a review of clinical data, from pathogenesis to treatment. J Thorac Dis 2016; 8: E1150-62 3 Dangas GD et al.: In-stent restenosis in the drug-eluting stent era. J Am Coll Cardiol 2010; 56: 1897-907 4 Cassese S et al.: Incidence and predictors of reCurrent restenosis after drug-coated balloon Angioplasty for Restenosis of a drUg-eluting Stent: The ICARUS Cooperation. Rev Esp Cardiol (Engl Ed) 2018; 71: 620-7 5 Moussa ID et al.: Trends and outcomes of restenosis after coronary stent implantation in the United States. J Am Coll Cardiol 2020; 76: 1521-31 6 Cassese S et al.: Prognostic role of restenosis in 10 004 patients undergoing routine control angiography after coronary stenting. Eur Heart J 2015; 36: 94-9 7 Neumann FJ et al.: 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J 2019; 40: 87-165 8 Shlofmitz E et al.: Restenosis of drug-eluting stents: a new classification system based on disease mechanism to guide treatment and state-of-the-art review. Circ Cardiovasc Interv 2019; 12: e007023
Das könnte Sie auch interessieren:
Intégration: précoce, progressive, conjointe ou (trop) tardive?
Les nouveaux traitements anticancéreux modifient également l’approche des soins palliatifs. Plus la durée de survie augmente, plus l’accent est mis sur la qualité de vie. Le moment de l’ ...
Études visant à modifier la pratique en cas de cancer de l’urothélium et de la prostate
Le paysage thérapeutique des tumeurs urologiques est en constante évolution. Les progrès les plus marquants concernent les premières lignes de traitement. Voici un aperçu des études qui ...
Nouvelles approches thérapeutiques et données modifiant les directives
Cette année, le congrès de l’ISTH s’est tenu du 21 au 25 juin à Washington D.C. Au cours des 115 sessions, les expert·es les plus renommé·es du monde ont présenté les dernières données ...