HFpEF: progression concernant le diagnostic et premier traitement efficace
Auteures:
Dre méd. Christina Binder-Rodriguez
Klinische Abteilung für Kardiologie
Universitätsklinik für Innere Medizin II
Medizinische Universität Wien
E-mail: christina.binder@meduniwien.ac.at
Prof.Dre méd. Diana Bonderman
5. Medizinische Abteilung mit Kardiologie
Klinik Favoriten
Wiener Gesundheitsverbund
Wien
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
De grands progrès ont été réalisés ces dernières années dans le diagnostic et le traitement de l’HFpEF. Un nouvel algorithme aide à établir un diagnostic, et un médicament développé pour le diabète devrait offrir pour la première fois un véritable traitement pour ce groupe de patients.
Keypoints
-
Le diagnostic de l’HFpEF repose sur le tableau clinique, les peptides natriurétiques et les critères échocardiographiques.
-
L’empagliflozine, un inhibiteur du SGLT2, a été le premier traitement médicamenteux à améliorer le pronostic des patients atteints d’HFpEF.
-
Les causes rares d’HFpEF doivent être recherchées activement pour pouvoir mettre en place un traitement spécifique, le cas échéant.
L’insuffisance cardiaque avec fraction d’éjection ventriculaire gauche préservée (HFpEF) touche environ 50% des patients atteints d’insuffisance cardiaque.1 Le taux de mortalité chez ces patients est comparable à celui des patients atteints d’insuffisance cardiaque à fraction d’éjection ventriculaire gauche réduite (HFrEF).2,3 Chez les patients atteints d’HFpEF comme chez ceux atteints d’HFrEF, la qualité de vie subjective est également nettement réduite.4
Diagnostic de l’HFpEF
Le diagnostic de l’HFpEF se fonde sur trois piliers:5
-
Tableau clinique: les patients présentent des signes et des symptômes d’insuffisance cardiaque, à savoir une dyspnée et des capacités réduites. Aux stades plus avancés, les patients développent souvent des œdèmes des jambes. Les femmes sont touchées environ deux fois plus que les hommes.
-
Biomarqueurs cardiaques: dans le cadre des analyses de laboratoire, l’HFpEF est définie par une augmentation de la NT-pro-BNP («N-terminal pro brain natriuretic peptide») avec des valeurs >125pg/ml.
-
Échocardiographie: deux critères échocardiographiques doivent être remplis pour diagnostiquer une HFpEF, à savoir une fraction d’éjection ventriculaire gauche (VG) ≥50% et la mise en évidence d’une dysfonction diastolique et/ou d’une cardiopathie structurelle. Cette dernière est définie comme une hypertrophie du VG ou une dilatation de l’oreillette gauche.
Algorithme HFA-PEFF
Pour faciliter l’établissement du diagnostic, l’algorithme HFA-PEFF a été développé en 2019 par Pieske et al.6 Il propose un guide clinique en 4 étapes diagnostiques:
-
étape («pretest assessment»): comprend l’anamnèse, y compris le recueil des symptômes et des comorbidités, ainsi que l’ECG, les biomarqueurs cardiaques, l’échocardiographie (standard) et l’évaluation des performances par ergométrie ou test de marche de 6 minutes.
-
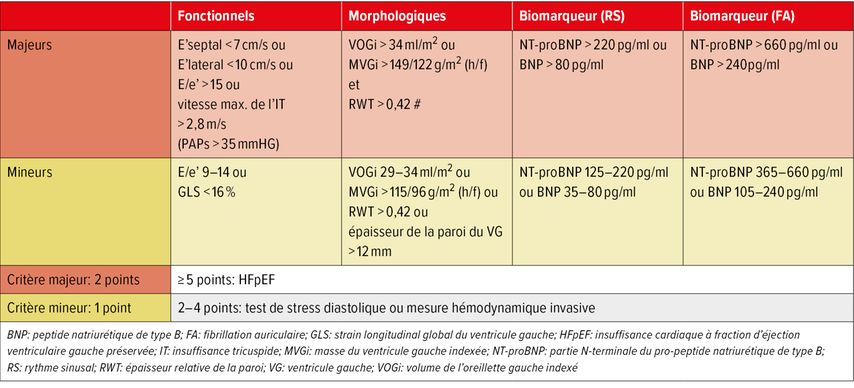
étape («echocardiograhy and natriuretic peptide score»): met l’accent sur un diagnostic échocardiographique et NT-proBNP élargi. Les paramètres échocardiographiques doivent surtout être recueillis pour évaluer la dysfonction diastolique. Les paramètres pris en compte dans ce score sont présentés dans le tableau 1. Un score ≥ 5 points indique la présence d’une HFpEF, alors qu’un score < 2 points reflète une faible probabilité. Dans la «zone grise» entre 2 et 4 points, un diagnostic plus approfondi doit être établi au moyen de tests des performances et/ou d’une évaluation hémodynamique.
-
étape: sert au diagnostic élargi et est surtout utilisée si les tests précédents ont donné des résultats ambivalents («functional testing in case of uncertainty»). Une échocardiographie de stress ou une mesure hémodynamique invasive par cathétérisme cardiaque droit est recommandée à cet effet.
-
étape: sert à rechercher l’étiologie de l’HFpEF («final aetiology»). Il convient avant tout d’exclure les affections telles que les cardiomyopathies hypertrophiques rares. Ceci est particulièrement important pour le pronostic et la planification ultérieure du traitement. Une imagerie multimodale et, le cas échéant, des diagnostics de laboratoire élargis, y compris des analyses génétiques, sont utilisés.
Tab. 1: Paramètres d’évaluation de la dysfonction diastolique (Echocardiography and Natriuretic Peptide Score)
Traitement de l’HFpEF
Les médicaments utilisés avec beaucoup de succès dans le traitement de l’HFrEF n’ont mis en évidence aucun bénéfice pronostique chez les patients atteints d’HFpEF dans le cadre des études. Ni les bêtabloquants, ni les inhibiteurs de l’ECA, ni les antagonistes des récepteurs de l’angiotensine n’ont pu prolonger la survie ou réduire la fréquence des hospitalisations pour insuffisance cardiaque (HIC).7–9
Les preuves ne sont que légèrement meilleures pour la spironolactone. L’étude TOPCAT (spironolactone contre placebo) n’a pas rempli son critère d’évaluation primaire (décès cardiaque ou HIC), mais les données tirées de celle-ci ont indiqué que la spironolactone pourrait prévenir la survenue d’HIC.10 Les directives européennes sur le traitement de l’insuffisance cardiaque ne recommandent toutefois pas l’utilisation d’antagonistes des récepteurs des minéralocorticoïdes, tels que la spironolactone, pour les patients atteints d’HFpEF.5
Après son succès retentissant chez les patients atteints d’HFrEF, l’association sacubitril/valsartan a également été testée dans la population atteinte d’HFpEF dans le cadre de l’étude PARAGON-HF. Le critère d’évaluation combiné de décès cardiovasculaire ou d’HIC n’a pas été rempli lors de cette étude, mais de peu. En examinant les analyses des sous-groupes de plus près, il apparaît cependant que les femmes ainsi que les patients présentant une fraction d’éjection ventriculaire gauche (FEVG) plus faible peuvent éventuellement bénéficier de l’association sacubitril/valsartan.11
En raison de la diminution de l’élasticité du VG, l’HFpEF entraîne une augmentation de la pression de remplissage et le développement d’une hypertension pulmonaire (HTP) postcapillaire. Suite à l’augmentation chronique de la pression dans la circulation pulmonaire, certains patients subissent un remodelage des vaisseaux pulmonaires. Une composante précapillaire supplémentaire de l’hypertension pulmonaire peut ainsi se développer.
L’hypertension pulmonaire associée à l’HFpEF constitue un autre point de départ pour le traitement de ces patients. Malheureusement, la plupart des médicaments qui réduisent la pression pulmonaire et sont efficaces dans d’autres sous-groupes HTP n’ont rencontré que peu de succès dans le cas de l’HTP associée à l’HFpEF.12–15 Certaines études ont même dû être interrompues prématurément en raison de problèmes de sécurité. Aucun de ces médicaments n’a permis d’obtenir un avantage en termes de survie16–18
Inhibiteurs du SGLT2: première substance efficace améliorant le pronostic en cas d’HFpEF
Jusqu’à il y a quelques mois, le traitement de l’HFpEF se concentrait exclusivement sur le contrôle des symptômes par le biais de diurétiques et sur le traitement des comorbidités pour réduire le risque cardiovasculaire.5 En octobre 2021, la première étude de phase III révélant un résultat clairement positif chez les patients atteints d’HFpEF a toutefois été publiée.
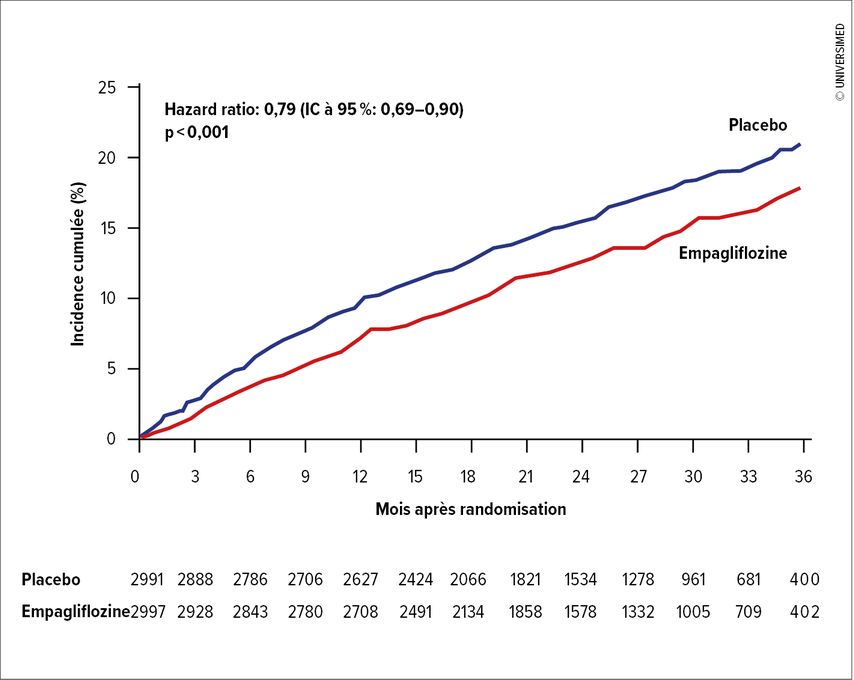
L’étude EMPEROR-Preserved a démontré un avantage pronostique significatif pour les patients traités par l’empagliflozine, un inhibiteur du SGLT2, avec une réduction de 21% du risque relatif (Fig.1).19La protéine SGLT2 («sodium-glucose cotransporter-2») est responsable de la réabsorption de >90% du glucose dans le tubule proximal du rein. Une inhibition médicamenteuse entraîne une augmentation de l’excrétion du glucose et donc un effet osmodiurétique. En raison de ce mécanisme, les inhibiteurs du SGLT2 ont été initialement développés et utilisés comme antidiabétiques oraux. On a pris conscience plus tard des effets cardioprotecteurs et néphroprotecteurs supplémentaires de cette classe de substances. Bien que l’on ne sache pas exactement à quoi ils sont dus, des effets antifibrotiques et hémodynamiques positifs ont, entre autres, été attribué aux inhibiteurs du SGLT2.20,21
Fig. 1: Critère d’évaluation primaire de l’étude EMPEROR-Preserved: l’empagliflozine entraîne une réduction de 21% du risque relatif de survenue d’un événement. Le critère d’évaluation primaire était composé d’un décès cardiovasculaire ou d’une hospitalisation pour insuffisance cardiaque. L’effet est principalement dû à une réduction du risque d’hospitalisation pour insuffisance cardiaque dans le groupe traité par l’empagliflozine (adapté d’après Anker et al.)19
Dans l’étude EMPEROR-Preserved, les effets positifs ont été démontrés dans tous les sous-groupes, même chez les patients ne présentant pas de diabète sucré connu. L’empagliflozine a généralement été bien tolérée et le groupe traité n’a notamment pas connu d’augmentation des hypoglycémies. Un effet néphroprotecteur a en outre été révélé par un ralentissement du déclin de la fonction rénale.
On peut supposer que les inhibiteurs du SGLT2 pour le traitement de l’HFpEF occuperont à l’avenir une place importante dans les directives thérapeutiques internationales.
Littérature:
1 Oktay AA et al.: The emerging epidemic of heart failure with preserved ejection fraction. Curr Heart Fail Rep 2013; 10: 401-10 2 Owan TE et al.: Trends in prevalence and outcome of heart failure with preserved ejection fraction. N Engl J Med 2006; 355: 251-59 3 The survival of patients with heart failure with preserved or reduced left ventricular ejection fraction: an individual patient data meta-analysis. Eur Heart J 2012; 33: 1750-57 4 Lewis EF et al.: Characterization of health-related quality of life in heart failure patients with preserved versus low ejection fraction in CHARM. Heart Fail 2007; 9: 83-91 5 McDonagh TA et al.: 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2021; 42: 3599-726 6 Pieske B et al.: How to diagnose heart failure with preserved ejection fraction: the HFA–PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). Eur Heart J 2019; 40: 3297-317 7 Cleland JG et al.: The perindopril in elderly people with chronic heart failure (PEP-CHF) study. Eur Heart J 2006; 27: 2338-45 8 Yusuf S et al.: Effects of candesartan in patients with chronic heart failure and preserved left-ventricular ejection fraction: the CHARM-Preserved Trial. Lancet 2003; 362: 777-81 9 Massie BM et al.: Irbesartan in patients with heart failure and preserved ejection fraction. N Engl J Med 2008; 359: 2456-67 10 Pitt B et al.: Spironolactone for heart failure with preserved ejection fraction. N Engl J Med 2014; 370: 1383-92 11 Solomon SD et al.: Angiotensin–neprilysin inhibition in heart failure with preserved ejection fraction. N Engl J Med 2019; 381: 1609-20 12 Redfield MM et al.: Effect of Phosphodiesterase-5 inhibition on exercise capacity and clinical status in heart failure with preserved ejection fraction: a randomized clinical trial. JAMA 2013; 309: 1268-77 13 Bonderman D et al.: Riociguat for patients with pulmonary hypertension caused by systolic left ventricular dysfunction: a phase IIb double-blind, randomized, placebo-controlled, dose-ranging hemodynamic study. Circulation 2013; 128: 502-11 14 Bonderman D et al.: Acute hemodynamic effects of riociguat in patients with pulmonary hypertension associated with diastolic heart failure (DILATE-1): a randomized, double-blind, placebo-controlled, single-dose study. Chest 2014; 146: 1274-85 15 Pieske B et al.: Vericiguat in patients with worsening chronic heart failure and preserved ejection fraction: results of the SOluble guanylate Cyclase stimulatoR in heArT failurE patientS with PRESERVED EF (SOCRATES-PRESERVED) study. Eur Heart J 2017; 38: 1119-27 16 Belyavskiy E et al.: Phosphodiesterase 5 inhibitor sildenafil in patients with heart failure with preserved ejection fraction and combined pre- and postcapillary pulmonary hypertension: a randomized open-label pilot study. BMC Cardiovasc Disord 2020; 20: 408 17 Califf RM et al.: A randomized controlled trial of epoprostenol therapy for severe congestive heart failure: The Flolan International Randomized Survival Trial (FIRST). Am Heart J 1997; 134: 44-54 18 Koller B et al.: Pilot study of endothelin receptor blockade in heart failure with diastolic dysfunction and pulmonary hypertension (BADDHY-Trial). Heart Lung Circ 2017; 26: 433-41 19 Anker SD et al.: Empagliflozin in heart failure with a preserved ejection fraction. N Engl J Med 2021; 385: 1451-61 20 Dutka M et al.: Sodium glucose cotransporter 2 inhibitors: mechanisms of action in heart failure. Heart Fail Rev 2021; 26: 603-22 21 Rosano G et al.: Sodium-glucose co-transporter 2 inhibitors in heart failure: recent data and implications for practice. Card Fail Rev 2020; 6: e31
Das könnte Sie auch interessieren:
Les conjugués anticorps-médicament ont le vent en poupe
Actuellement, de nombreux conjugués anticorps-médicament sont en cours d’évaluation dans le cancer du poumon. Qu’ils soient utilisés seuls ou en combinaison avec d’autres thérapies ...
Effets sur la santé ainsi que risques liés au travail posté et de nuit
Le travail posté et de nuit entraîne un risque accru de multiples problèmes de santé en raison de la perte de sommeil et de la désynchronisation circadienne. Il s’agit notamment de ...
Les défis des interfaces interdisciplinaires
Face à un éventail croissant d’options ciblées et immunothérapeutiques, les tests moléculaires sont de plus en plus au centre de l’attention dans les tumeurs gastro-intestinales. Des ...