Hépatopathie et diabète type 2
Auteurs:
Dr méd. Alberto Nascè1
Prof. Dr méd. François R. Jornayvaz1,2,3
1Service d’Endocrinologie, Diabétologie, Nutrition et Education Thérapeutique du Patient
Hôpitaux Universitaires de Genève
2Centre du Diabète de la Faculté de Médecine Université de Genève
3Département de Physiologie Cellulaire et du Métabolisme
Faculté de Médecine, Université de Genève
E-mail: alberto.nasce@hcuge.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
La maladie hépatique chronique la plus souvent liée au diabète est la «non-alcoholic fatty liver disease» ou NAFLD, pathologie caractérisée par l’accumulation excessive de graisse dans le parenchyme hépatique. La relation entre NAFLD et diabète de type 2 peut être vue comme un «mauvais mariage», en soulignant que chaque entité s’alimente des aspects négatifs de l’autre.
La NAFLD est définie par la présence de stéatose dans au moins 5% des hépatocytes selon des analyses soit histologiques soit d’imagerie (spectroscopique ou de résonance magnétique quantitative, avec une capacité de détection sélective pour la matière graisseuse). Le diagnostic de NAFLD nécessite l’exclusion de causes secondaires de stéatose (certains médicaments ou autres pathologies hépatiques stéatogènes) et d’une consommation quotidienne d’alcool ≥30g pour les hommes et de ≥20g pour les femmes.1
Le terme NAFLD comprend un spectre pathologique important. Nous distinguons, selon le degré de sévérité d’atteinte tissulaire, deux grandes entités: la simple stéatose hépatique, autrement dit «non-alcoholic fatty liver» (NAFL) et la forme inflammatoire, connue comme «non-alcoholic steatohepatitis» (NASH), laquelle peut progresser jusqu’au développement d’une fibrose hépatique significative (≥F2 au score anatomopathologique de Métavir) et éventuellement aux complications les plus redoutables comme la cirrhose hépatique et le carcinome hépatocellulaire.
Épidémiologie
Concernant l’épidémiologie de la NAFLD, nous sommes face à une des épidémies du siècle. En effet, il s’agit de la principale cause mondiale d’hépatopathie chronique, avec une prévalence globale d’environ 25% de la population générale au niveau mondial. Les statistiques américaines sont alarmantes: au travers d’une méta-analyse récente de Younossi, l’un des experts mondiaux de la NAFLD, on se rend compte que cette maladie est responsable de 75,1% des cas d’hépatopathie chronique, dont 14,1% de carcinomes hépatocellulaires, ce qui fait que la NAFLD est sur le podium des indications pour la transplantation hépatique.2 En ce qui concerne les données suisses, une étude récente prévoit une progression significative de la prévalence populationnelle de cette pathologie qui devrait atteindre 24,3% en 2030. À noter une augmentation en pourcentage des formes les plus sévères et de la mortalité associée.3 En se focalisant sur l’association entre la NAFLD et le diabète, une récente méta-analyse montre que la prévalence de NAFLD chez les personnes diabétiques de type 2 est deux fois plus élevée que dans la population non diabétique (prévalence de 55−70%). Les études histologiques montrent également que 30−40% des diabétiques sont atteints d’une NASH et que 12−20% d’entre eux ont une fibrose significative (≥F2). Les données varient entre continents avec des chiffres particulièrement préoccupants dans le monde occidental.4
NAFLD et diabète de type 2 – un «mauvais mariage»
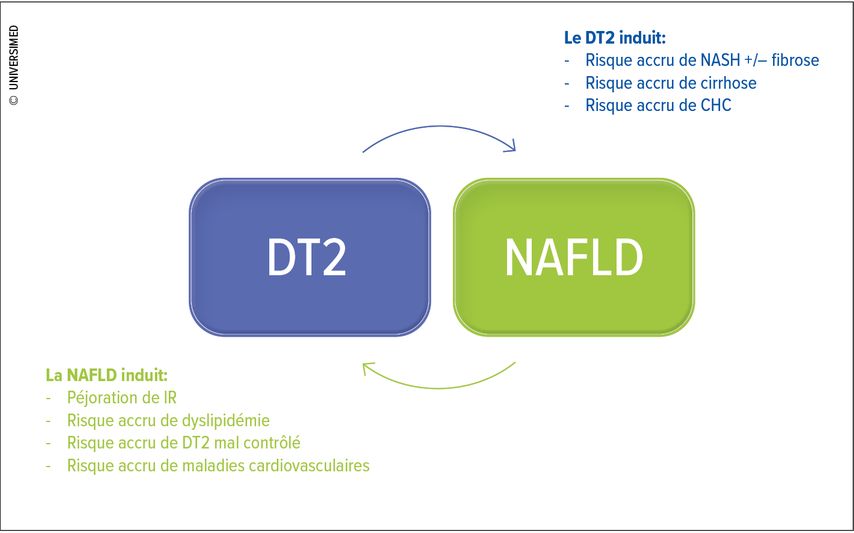
Le diagnostic de diabète de type 2 augmente les probabilités de se retrouver face à une NASH, une cirrhose hépatique et un carcinome hépatocellulaire. De la même façon, la littérature montre des associations significatives entre la NAFLD et le développement d’une résistance à l’insuline, ce qui augmente le risque de voir se développer un diabète de type 2. Mais la présence d’une NAFLD peut aussi péjorer le diabète, ainsi qu’augmenter le risque de dyslipidémie et de pathologies cardiovasculaires (Fig. 1).5
Fig. 1: Le «mauvais mariage» entre le diabète de type 2 (DT2) et la «non-alcoholic fatty liver disease» (NAFLD) (adapté d’après Budd & Cusi)5
Sur le plan physiopathologique, il y a deux entités principales pour expliquer ce «mauvais mariage»: la résistance à l’insuline et le stress oxydatif. Nous pouvons considérer la NAFLD comme un déséquilibre entre la synthèse hépatique de triglycérides (à partir de l’afflux et estérification d’acides gras libres) et leur catabolisme (via la bêta-oxydation) et exportation via les «very low density lipoproteins» (VLDL). Les acides gras hépatiques proviennent de trois voies différentes: les tissus périphériques, l’alimentation, et la lipogenèse de novo. Il est donc clair que le diabète de type 2 étant associé à une résistance périphérique à l’insuline et à un dysfonctionnement du tissu adipeux, cela génère un afflux hépatique d’acides gras libres, ce qui déstabilise cet équilibre énergétique. Cette accumulation graisseuse induit une augmentation de la concentration d’intermédiaires lipidiques toxiques, générés dans le processus d’estérification des acides gras en triglycérides. De telles molécules activent d’un côté plusieurs voies inflammatoires responsables du blocage du récepteur insulinique IRS et, en conséquence, une résistance à l’insuline majeure. Elles produisent aussi plusieurs espèces réactives de l’oxygène («reactive oxygen species», ROS), protagonistes dans la progression pathologique de la NAFLD aux formes inflammatoires et fibrotiques. Au-delà du métabolisme lipidique, un rôle important est également joué par la dysbiose du microbiote intestinal et son action sur la modification de la composition des acides biliaires, avec un effet final d’augmentation de la résistance à l’insuline et de l’inflammation.6 Pour se défendre de cet afflux exagéré d’acides gras, les hépatocytes augmentent la bêta-oxydation mitochondriale. Le cycle de Krebs et la chaine de transport des électrons sont mis à rude épreuve, ainsi que les systèmes antioxydants, jusqu’à ce que ses capacités redox soient épuisées, avec comme conséquences le stress oxydatif et une production incontrôlée de ROS.7 Les ROS, produits de manière prévalente par des enzymes connues comme les NADPH oxydases, ou NOX, agissent à plusieurs niveaux dans la pathogenèse de la NAFLD et son association avec le diabète de type 2: ils sont responsables du blocage de l’IRS et de la promotion de plusieurs cascades inflammatoires, promouvant donc la progression pathologique vers la NASH, la fibrose, la cirrhose et le carcinome hépatocellulaire.8 Nous nous rendons donc compte comment l’insulino-résistance et le stress oxydatif créent un cercle vicieux qui alimente et péjore le métabolisme de nos patients.
Dépistage
Le but du dépistage de la NAFLD et de permettre d’identifier les formes graves dont la NASH et les formes de fibrose significative. Le stade pathologique de fibrose est le plus souvent associé à des conséquences négatives. Des études histologiques multicentriques de patients diagnostiqués d’une NAFLD ont montré que la fibrose est la seule caractéristique anatomopathologique associée de manière indépendante à la mortalité globale et aux complications hépatiques.9,10 À l’heure actuelle, le dépistage de NAFLD n’est pas réalisé de manière systématique dans la population globale, mais cible plutôt des sous-groupes spécifiques, comme les patients souffrant d’obésité et les patients diabétiques de type 2. On considère également le dépistage de la NAFLD chez les patients pré-diabétiques ou diabétiques de type 2 chez lesquels on met en évidence une stéatose par imagerie ou en cas d’élévation sérique des ALAT. Finalement tout patient avec un syndrome métabolique devrait être dépisté.
En ce qui concerne la manière utilisée pour le dépistage, la tendance est d’éviter, dans la mesure du possible, de recourir à la biopsie hépatique, technique invasive et couteuse qui reste, cependant, le gold standard pour le diagnostic histologique d’une NASH. L’échographie hépatique et les transaminases se révélant peu efficaces (les enzymes hépatiques sont normales dans 50% des cas de NAFLD chez les patients diabétiques), on considère de plus en plus l’élastographie hépatique ou Fibroscan, capable d’évaluer avec une bonne sensibilité et spécificité la dureté du parenchyme hépatique, ainsi que des marqueurs sériques de fibrogenèse (ELF, FibroMeter, FibroTest) et aussi des scores de stratification du risque de fibrose, notamment le Fibrosis-4 Index (FIB-4). Ce dernier, actuellement supérieur à d’autres scores utilisés dans le passé, comme le NAFLD Fibrosis Score (NFS), tient en considération quatre paramètres simples: âge, thrombocytes, ASAT et ALAT.11
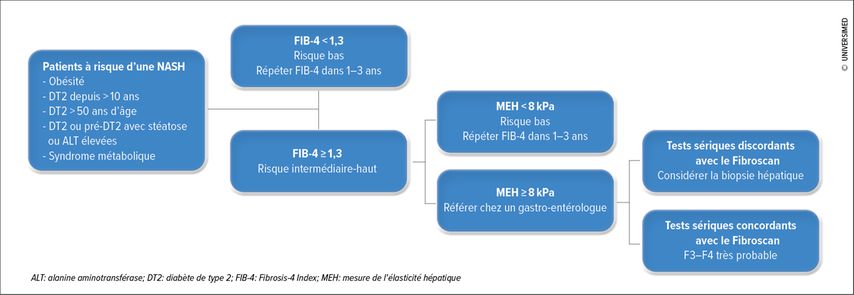
L’algorithme de dépistage proposé par les guidelines de l’European Association For the Study of the Liver (EASL) et l’American Diabetes Association (ADA) prévoit le calcul initial d’un score FIB-4. Comme visualisé dans la Figure 2, si la valeur retrouvée revient <1,3, sa répétition annuelle est recommandée. Si le score est ≥1,3, un Fibroscan est réalisé. Selon le degré de dureté hépatique (< ou ≥8kPa), l’attitude varie entre la répétition annuelle du score FIB-4 et l’adressage à un spécialiste en gastroentérologie. Ce dernier, selon concordance ou discordance entre les valeurs d’élastographie et les marqueurs sériques de fibrogenèse, décidera si il faut réaliser une biopsie hépatique. C’est au travers de l’implémentation de cette stratégie de screening, que l’utilisation de la biopsie du foie a diminué.11,12
Fig. 2: Algorithme de stratification du risque (adapté d’après Kanwal et al., 2021, et European Association for the Study of the Liver, 2021)11, 12
Traitement
Perte pondérale
Nous pouvons affirmer que nous sommes en train de nous éloigner de l’époque où la NAFLD était une maladie sans traitement. Le pilier essentiel reste, toutefois, la perte pondérale. En effet, une étude prospective de 293 patients diagnostiqués d’une NASH à l’histologie, a montré qu’à la suite de 52 semaines de travail axé sur la mise en place de mesures hygiéno-diététiques standardisées, les données anatomopathologiques changeaient de manière significative. 25% des patients arrivaient à la résolution de la NASH, 47% à une diminution du score histologique d’inflammation (NAS) et 19% à la résolution de la fibrose. Les meilleurs résultats étaient enregistrés en perdant au moins 10% du poids de départ.13 Les résultats issus de la chirurgie bariatrique sont impressionnants. 190 patients avec une NASH diagnostiquée à l’histologie ont été opérés par bypass gastrique en France durant les années 2000. 12 mois après la chirurgie, les auteurs ont constaté une disparition de la NASH dans 85% des échantillons histologiques, avec une diminution parallèle de plusieurs scores d’inflammation et de fibrose.14
Traitement médicamenteux
Concernant les effets des traitements antidiabétiques sur la NAFLD, la metformine, première ligne thérapeutique chez les patients diabétiques de type 2, non seulement est inefficace dans l’amélioration histologique des formes inflammatoires, mais semble être associée à une péjoration de l’inflammation lobulaire à distance d’un an de traitement.15 Les inhibiteurs de la DPP4 ont un effet relativement faible sur la réduction de la graisse hépatique et, à l’heure actuelle, aucune étude n’a vérifié leur impact bénéfique sur l’histologie hépatique.
Plus intéressants sont les inhibiteurs des SGLT2, s’associant à une diminution significative de la graisse parenchymateuse dans plusieurs études d’imagerie par résonance magnétique. Ils ont également montré de bons résultats dans la réduction de certains paramètres sériques inflammatoires et de marqueurs de fibrose. Notamment, une petite étude japonaise a récemment démontré, chez des patients diabétiques de type 2 et diagnostiqués d’une NAFLD, qu’après 72 semaines de traitement par ipragliflozine, on arrivait à une résolution de la NASH dans 66,7% des cas.16 D’autres évidences sont nécessaires avant d’inclure cette classe médicamenteuse dans les stratégies de traitement de la NAFLD.
Plus d’attention est réservée actuellement aux analogues des récepteurs du GLP-1 (GLP1-RA), aux analogues doubles des récepteurs GLP-1 et GIP ainsi qu’aux agonistes PPAR («peroxisome proliferator-activated receptors»). En partant des premiers, une récente revue de la littérature a considéré plusieurs études basées sur l’imagerie, d’une durée d’au moins 24 semaines et comprenant au moins 50 patients. Dans cette recherche, nous notons, grâce aux traitements de liraglutide ou dulaglutide, une réduction significative du contenu hépatique en graisse.17 Deux études histologiques principales ont montré une résolution de la NASH: Armstrong et al. ont randomisé 52 patients souffrant de surpoids et de NASH (diagnostiquée à l’histologie) et ont démontré que les patients sous liraglutide à 1,8mg/j arrivaient, après 48 semaines de traitement, à une résolution de la NASH dans 39% des cas, ainsi qu’à une diminution de la progression de la fibrose.18 Une autre étude clinique randomisée de phase 2 de Newsome et al. qui, incluant 320 patients avec une NASH diagnostiquée à la biopsie, dont 62% de diabétiques de type 2, et les assignant à des sous-groupes de traitement par sémaglutide à 0,1mg/j, 0,2mg/j, 0,4mg/j ou placebo pour une durée de 72 semaines, a montré une régression significative de la NASH pour chaque dose de GLP-1-RA utilisée. Aucune amélioration significative en termes de fibrose hépatique n’était, cependant, observée.19
Le tirzépatide, analogue double des récepteurs GLP-1 et GIP, a montré dans une étude clinique récente incluant des patients diabétiques de type 2 et en surpoids, une diminution significative du contenu hépatique en graisse et des volumes de tissu adipeux viscéral et sous-cutané après 52 semaines de traitement.20
La troisième classe médicamenteuse à citer sont les agonistes PPAR. À la différence des deux autres catégories pharmaceutiques qui agissent sur le foie de manière indirecte, en diminuant l’insulino-résistance périphérique et en promouvant la perte pondérale, les agonistes PPAR sont capable d’améliorer la qualité adipeuse et de réduire la lipotoxicité hépatique, grâce à une action sur l’équilibre des adipokines. La pioglitazone, agoniste alpha et gamma, a montré au niveau histologique une importante capacité de régression de la fibrose de stades avancés à d’autres moins sévères (de F3-4 à F0-2), ainsi que l’amélioration de plusieurs scores inflammatoires.21 Les effets du lanifibranor, pan-PPAR agoniste, sur des patients diagnostiqués d’une NASH à la biopsie, ont montré après 24 semaines de traitement une réduction significative de plusieurs scores histologiques d’inflammation.22 En conclusion, les PPAR agonistes restent une arme à disposition pour le traitement des formes avancées de NAFLD. Compte tenu des effets indésirables au niveau du poids et de l’insuffisance cardiaque, une possible association future avec des GLP-1-RA ou des inhibiteurs SGLT2 pourrait être envisagée.
D’autres thérapies qui se trouvent actuellement dans le pipeline visent soit à augmenter la sensibilité à l’insuline (p.ex. agonistes doubles des récepteurs pour le GLP-1 et le glucagon) soit à bloquer la production intra-parenchymateuse de triglycérides (p.ex. inhibiteurs de la synthase des acides gras). Un autre rôle pourra être joué par des molécules antioxydantes (p.ex. inhibiteurs des NOX) et par des thérapies génétiques.
En attendant les développements futurs, à l’heure actuelle, notre attitude thérapeutique face à des patients diabétiques de type 2 et diagnostiqués d’une NAFLD est la suivante: s’ils présentent une NAFL ou NASH sans fibrose significative, la thérapie antidiabétique restera inchangée. Si, en revanche, la fibrose devient significative, les analogues des récepteurs GLP-1 et la pioglitazone devraient être promus. L’état cirrhotique (F4), cependant, a besoin d’une individualisation multidisciplinaire des stratégies thérapeutiques.11
Littérature:
1 European Association for the Study of the Liver (EASL); European Association for the Study of Diabetes (EASD); European Association for the Study of Obesity (EASO). EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol 2016; 64: 1388-402 2 Younossi ZM et al.: The global epidemiology of NAFLD and NASH in patients with type 2 diabetes: A systematic review and meta-analysis. J Hepatol 2019; 71: 793-801 3 Goossens N et.: Nonalcoholic fatty liver disease burden − Switzerland 2018-2030. Swiss Med Wkly 2019; 149: w20152 4 Stefan N, Cusi K: A global view of the interplay between non-alcoholic fatty liver disease and diabetes. Lancet Diabetes Endocrinol 2022; 10: 284-96 5 Budd J, Cusi K: Role of agents for the treatment of diabetes in the management of nonalcoholic fatty liver disease. Curr Diab Rep 2020; 20: 59 6 Byrne CD, Targher G: NAFLD: a multisystem disease. J Hepatol 2015; 62(Suppl 1): 47-64 7 Tilg H et al.: NAFLD and diabetes mellitus. Nat Rev Gastroenterol Hepatol 2017; 14: 32-42 8 Nascè A et al.: NADPH oxidases connecting fatty liver disease, insulin resistance and type 2 diabetes: current knowledge and therapeutic outlook. Antioxidants 2022; 11: 1131 9 Angulo P et al.: Liver fibrosis, but no other histologic features, is associated with long-term outcomes of patients with nonalcoholic fatty liver disease. Gastroenterology 2015; 149: 389-97 10 Sanyal AJ et al.: Prospective study of outcomes in adults with nonalcoholic fatty liver disease. N Engl J Med 2021; 385: 1559-69 11 Kanwal F et al.: Preparing for the NASH epidemic: a call to action. Diabetes Care 2021; 44: 2162-72 12 European Association for the Study of the Liver: EASL Clinical Practice Guidelines on non-invasive tests for evaluation of liver disease severity and prognosis − 2021 update. J Hepatol 2021; 75: 659-89 13 Vilar-Gomez E et al.: Weight loss through lifestyle modification significantly reduces features of nonalcoholic steatohepatitis. Gastroenterology 2015; 149: 367-78 14 Lassailly G et al.: Bariatric surgery reduces features of nonalcoholic steatohepatitis in morbidly obese patients. Gastroenterology 2015; 149: 379-88 15 Said A, Akhter A: Meta-analysis of randomized controlled trials of pharmacologic agents in non-alcoholic steatohepatitis. Ann Hepatol 2017; 16: 538-47 16 Takahashi H et al.: Ipragliflozin improves the hepatic outcomes of patients with diabetes with NAFLD. Hepatol Commun 2022; 6: 120-32 17 Patel Chavez C et al.: The emerging role of glucagon-like peptide-1 receptor agonists for the management of NAFLD. J Clin Endocrinol Metab 2022; 107: 29-38 18 Armstrong MJ et al.: Liraglutide safety and efficacy in patients with non-alcoholic steatohepatitis (LEAN): a multicentre, double-blind, randomised, placebo-controlled phase 2 study. Lancet 2016; 387: 679-90 19 Newsome PN et al.: A placebo-controlled trial of subcutaneous semaglutide in nonalcoholic steatohepatitis. N Engl J Med 2021; 384: 1113-24 20 Gastaldelli A et al.: Effect of tirzepatide versus insulin degludec on liver fat content and abdominal adipose tissue in people with type 2 diabetes (SURPASS-3 MRI): a substudy of the randomised, open-label, parallel-group, phase 3 SURPASS-3 trial. Lancet Diabetes Endocrinol 2022; 10: 393-406 21 Musso G et al.: Thiazolidinediones and advanced liver fibrosis in nonalcoholic steatohepatitis: a meta-analysis. JAMA Intern Med 2017; 177: 633-40 22 Francque SM et al.: A randomized, controlled trial of the pan-PPAR agonist lanifibranor in NASH. N Engl J Med 2021; 385: 1547-58
Das könnte Sie auch interessieren:
Régression de l’hypertension portale dans la cirrhose du foie par abstinence d’alcool
La recompensation hépatique est un nouveau concept selon lequel le traitement efficace de l’étiologie sous-jacente permet aux patient·es atteint·es d’une maladie hépatique décompensée de ...
Les systèmes «fully closed loop» continuent d’évoluer
Les systèmes «hybrid closed loop» pour l’insulinothérapie sont disponibles depuis quelques années et utilisés par de nombreuses personnes atteintes de diabète de type 1 (DT1). L’« ...
PID: voies vers le diagnostic et «treatable traits» potentiels
Les pneumopathies interstitielles diffuses (PID) ont souvent un pronostic défavorable, en particulier lorsqu’elles sont associées à une fibrose pulmonaire. Des traitements spécifiques ...