Endométriose: que doivent savoir les médecins généralistes?
Auteur·es:
Dre méd. Isabel Ihnenfeld Arcienega
Dr méd. Daniel Passweg
Frauenklinik
Stadtspital Triemli
Zürich
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
L’endométriose est fréquente; lorsque l’on suit des femmes entre la ménarche et la ménopause en tant qu’interniste, on trouve parmi elles des patientes atteintes d’endométriose. Elle revêt une grande importance, car elle touche les femmes dans leur phase de vie productive ainsi que reproductive et peut les handicaper fortement, ce qui rend le dépistage tout comme le suivi de la maladie encore plus importants.
Keypoints
-
L’endométriose est une maladie chronique, inflammatoire, hormonodépendante, dont les différentes facettes doivent faire l’objet d’un suivi jusqu’à la ménopause. Les traitements médicamenteux et chirurgicaux peuvent être comparés et adaptés à la situation ainsi qu’aux préférences de la patiente et/ou combinés.26
-
Si les symptômes de douleurs cataméniales chez les femmes plus jeunes sont pris au sérieux, le diagnostic de suspicion d’endométriose est plus qu’évident. Le diagnostic est simple et comprend obligatoirement en premier lieu un examen gynécologique avec échographie vaginale.
-
Les traitements médicamenteux de l’endométriose et de la dysménorrhée «essentielle» se recouvrent en grande partie (COC, POP), et peuvent donc être utilisés provisoirement sans confirmation du diagnostic.
L’endométriose est définie histologiquement: le tissu endométrial (épithélium et stroma) s’implante en dehors de la cavité utérine et prolifère. Cette maladie chronique récidivante entraîne une inflammation, une fibrose et des douleurs au niveau du petit bassin. Les œstrogènes favorisent la croissance des implants d’endométriose. Ainsi, l’endométriose est hormonodépendante et se limite à la maturité sexuelle; elle perd de son importance à la ménopause. Elle ne peut généralement pas être guérie, notre rôle est plutôt d’accompagner les patientes atteintes d’endométriose sur le plan thérapeutique.
Au cours des 100 dernières années, les projets de vie ont changé dans le monde industrialisé: la naissance du premier enfant est repoussée au moins à la trentaine. Le nombre d’enfants par femme a diminué et est combiné a des phases d’allaitement plus courtes, ce qui a pour conséquence d’avoir multiplié par dix le nombre de menstruations calculé sur la vie d’une femme au cours de cette même période. L’aménorrhée physiologique due aux grossesses répétées ainsi qu’aux longues périodes d’allaitement n’a plus lieu et l’endométriose peut se développer plus facilement.
Le développement de la pilule contraceptive par Carl Djerassi et Gregory Pincus a été bénéfique pour contrôler l’endométriose. La critique et le désintérêt croissants concernant la pilule de ces dernières années ont au contraire laissé plus de place à l’endométriose.1 L’aménorrhée due à la prise à long terme d’un contraceptif oral combiné (COC) à cycle prolongé (CP) est en fait beaucoup plus physiologique que les 400 menstruations calculées que connaît une femme moderne.
Incidence
Dans une population non sélectionnée, la fréquence de l’endométriose devrait être de quelques pour cent; on ignore l’incidence chez les femmes asymptomatiques. Dans les populations à risque souffrant de douleurs chroniques dans le bas-ventre et/ou d’infertilité, elle est en revanche de l’ordre d’un pourcentage à deux chiffres (40 à 60%).
Morbidité, symptômes
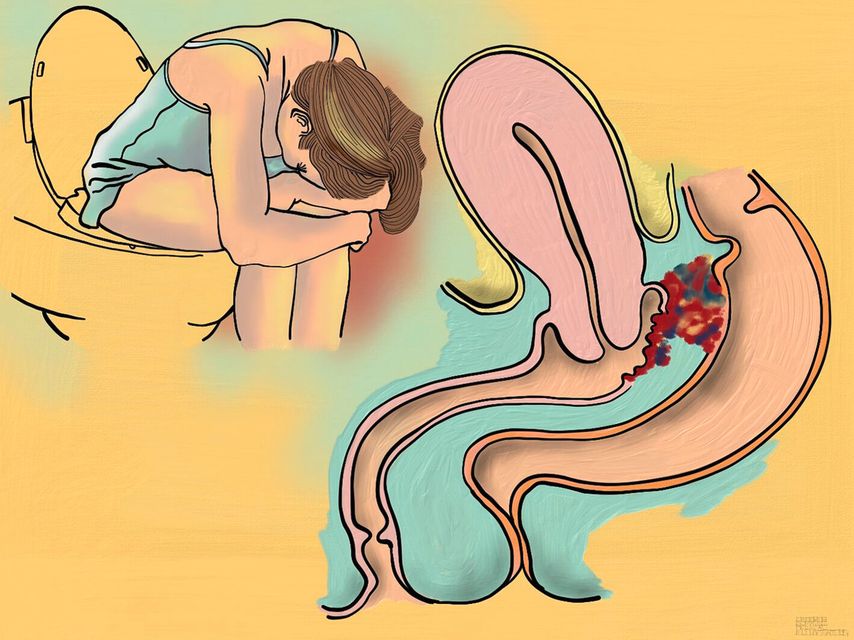
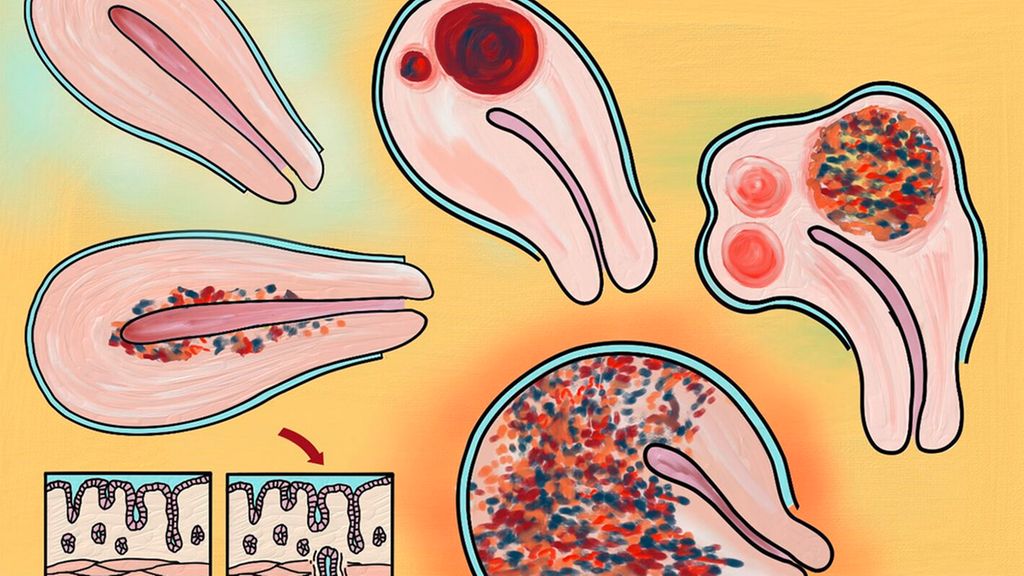
Comme souvent, l’anamnèse est centrale pour le diagnostic.2 L’endométriose provoque en premier lieu des douleurs et en second lieu une infertilité. Les douleurs sont typiquement cycliques et associées aux menstruations. Il faut interroger la patiente concernant les «4 D» de l’endométriose: la dysménorrhée, la dysurie, la dyschésie (douleur à la défécation) et la dyspareunie, la dysménorrhée étant le symptôme principal (Fig. 1).
Fig. 1: Dyschésie cataméniale et dyspareunie en cas d’implant d’endométriose au niveau du rectum et du septum rectovaginal
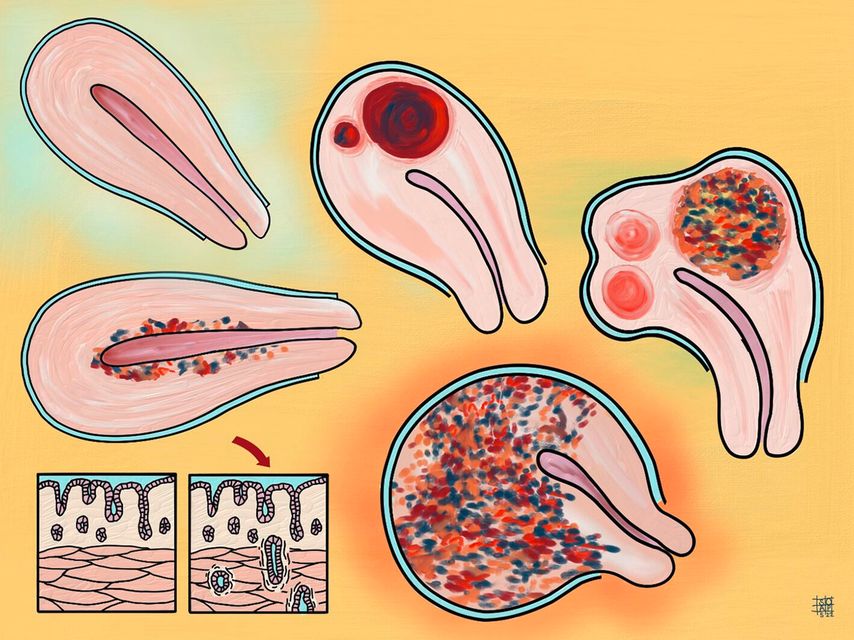
Outre les douleurs, l’infertilité est le deuxième symptôme principal de l’endométriose. Les causes d’une stérilité liée à l’endométriose sont multiples: des adhérences au niveau du petit bassin, l’obstruction des trompes, une diminution de la réserve ovarienne, le milieu inflammatoire chronique du petit bassin ou l’adénomyose, souvent associée à l’endométriose. Cela rend l’implantation plus difficile et peut déclencher des avortements (Fig. 2 et 3).
Fig. 3: L’adénomyose (endométriose du myomètre) provoque une dysménorrhée sévère et des troubles hémorragiques, mais réduit également le taux d’implantation et augmente le taux d’avortement. L’image montre les différents degrés de sévérité de l’adénomyose
Examen
L’évaluation clinique comprend un examen gynécologique. Il s’agit de détecter ou d’exclure un prolapsus de la paroi vaginale postérieure. De même, un examen bimanuel et rectal en position de lithotomie est nécessaire pour palper une atteinte des paramètres («deep endometriosis», DE) ou une endométriose ovarienne.
L’échographie vaginale est un élément central du diagnostic et est très sensible en termes de détection des endométrioses ovariennes comme profondes. La palpation guidée par échographie (déclenchement de douleurs?) est tout aussi importante que l’évaluation du déplacement des organes (ovaires) et des couches les unes par rapport aux autres («sliding sign»). Si une endométriose profonde ou ovarienne a été diagnostiquée, une échographie abdominale supplémentaire est obligatoire pour examiner les reins afin de détecter ou d’exclure une hydronéphrose.
L’IRM peut être utilisée pour comparer les constatations cliniques et échographiques, et aider à la planification préopératoire, mais elle constitue uniquement un examen déterminant dans certains cas, par exemple pour détecter une atteinte des nerfs sacrés, une atteinte intestinale multifocale ou une endométriose diaphragmatique.
Jusqu’à récemment, la laparoscopie avec visualisation de l’endométriose et confirmation histologique était le «gold standard» pour le diagnostic.3 Aujourd’hui, le diagnostic se base sur l’anamnèse, les constatations cliniques et échographiques vaginales, et l’indication pour la laparoscopie est uniquement posée à des fins thérapeutiques.4 La laparoscopie à des fins diagnostiques seules disparaît des directives.
Une élévation modérée du CA-125 dans les analyses de laboratoire est l’expression d’une pelvipéritonite chronique, mais elle est trop peu spécifique en tant qu’élément de diagnostic. Un test salivaire basé sur la recherche de microARN (miARN) ouvre depuis peu la voie à de nouvelles possibilités. Chez des patientes souffrant d’endométriose préexistante, le «next-generation sequencing» (NGS) et l’intelligence artificielle ont permis de définir une combinaison de 109 miARN dans la salive. L’optimisation mathématique permet une haute sélectivité entre les signatures miARN des patientes avec et sans endométriose, et donc un test de laboratoire offrant une très grande sécurité diagnostique. Le test est utile lorsqu’une patiente présente les symptômes typiques de l’endométriose, mais que ni l’examen clinique ni l’échographie vaginale ne mettent en évidence les constatations typiques de l’endométriose. Pour les patientes sans diagnostic clair et qui ne souhaitent pas commencer un traitement hormonal provisoire, le test salivaire constitue une alternative à la laparoscopie à des fins diagnostiques. En tant que test à des fins de dépistage seules, le test salivaire est non seulement beaucoup trop cher (>CHF 700.–), mais il perd aussi en spécificité et en sensibilité, car il a été développé pour un groupe de patientes présentant des douleurs dans lequel l’incidence de l’endométriose est naturellement très élevée. On ignore si le test indique exclusivement l’endométriose active ou également sa prédisposition génétique, s’il détecte aussi l’adénomyose, s’il peut être utilisé comme marqueur au cours de l’évolution et si le traitement peut ainsi être surveillé.5,6
Principes de base du traitement
L’endométriose est traitée par des médicaments et/ou par chirurgie. La condition préalable à tout traitement est la définition claire de l’objectif thérapeutique individuel: s’agit-il du traitement de la douleur, de la réalisation actuelle du désir d’enfant, du traitement de la douleur en tenant compte d’un futur désir d’enfant, ou le planning familial est-il terminé? Ce n’est qu’après avoir répondu à ces questions qu’une stratégie thérapeutique à long terme peut être définie.
Traitement médicamenteux, traitement hormonal
Étant une maladie hormonodépendante, le traitement médicamenteux consiste toujours en un traitement hormonal qui, tant qu’il est pris, limite la fertilité. Il n’existe pas d’autres médicaments spécifiquement destinés à lutter contre l’endométriose. L’objectif thérapeutique du traitement hormonal est d’empêcher la survenue des menstruations à long terme par la régulation à la baisse de l’axe hypothalamo-hypophysaire.
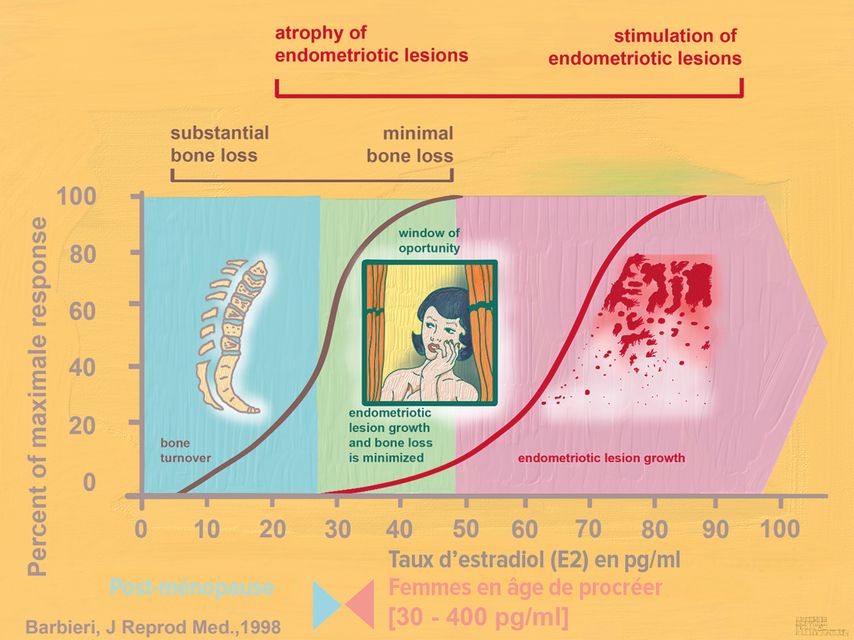
Le facteur déterminant est l’ampleur de la baisse du taux d’estradiol (E2) dans le sérum liée au traitement hormonal: si l’on abaisse le taux d’E2 en dessous de 20pg/ml, on induit en plus des troubles climatériques et une diminution de la densité osseuse. Si le taux d’E2 reste supérieur à 50pg/ml, les implants d’endométriose peuvent continuer à être stimulés. La plage thérapeutique intéressante («window of opportunity») se situe entre 20 et 50pg/ml, dans laquelle l’ostéoporose n’est pas induite et les implants d’endométriose ne sont pas stimulés (Fig. 4).7
Fig. 4: Traitement hormonal de l’endométriose. L’objectif est d’atteindre un taux d’estradiol sérique compris entre 20 et 50pg/ml (= plage thérapeutique, «window of opportunity»)
Pour le traitement de l’endométriose, on peut utiliser des progestatifs oraux, des implants progestatifs, des dispositifs intra-utérins (DIU) progestatifs, des contraceptifs oraux combinés (COC), des analogues de la GnRH et des antagonistes de la GnRH. Tous les traitements hormonaux sont efficaces, mais se distinguent par leurs effets secondaires. Pour obtenir une observance thérapeutique élevée, il est essentiel de suivre le traitement hormonal et de l’adapter, le cas échéant.
Progestatifs
Les progestatifs réduisent le taux d’œstrogènes via l’axe hypothalamo-hypophysaire et exercent également une action directe régressive, anti-inflammatoire, anti-angiogénique, anti-neurogénique et apoptotique sur les implants d’endométriose, réduisant ainsi les douleurs liées à la maladie. Le diénogest (Visanne®) 2mg/j est autorisé pour traiter l’endométriose et constitue le traitement de première intention. L’utilisation à long terme est également largement soutenue par des études.8 Contrairement aux analogues de la GnRH, le diénogest n’entraîne aucune diminution de la densité osseuse9 chez la femme adulte et, contrairement aux COC, il n’a aucun effet thrombogène. L’utilisation du diénogest comme contraceptif en monothérapie est «off-label», mais la dose de 2mg de diénogest correspond à une double dose d’inhibition de l’ovulation et offre donc, prise à long terme, une sécurité au moins aussi élevée que les doses classiques à 0,075mg de désogestrel (Cerazette®) ou 4mg de drospirénone (Slinda®). Toutefois, les préparations progestatives pures («progesteron-only pills», POP) sont souvent subjectivement moyennement bien tolérées, notamment par les adolescentes. Les troubles hémorragiques, la gêne des seins, l’acné, la prise de poids et l’humeur dépressive font partie du profil d’effets secondaires potentiels.
Les DIU au lévonorgestrel (p.ex. Mirena®) visent conceptuellement un taux intra-utérin maximal, mais à l’inverse un taux systémique de progestérone aussi bas que possible. Ils peuvent être utilisés «off-label» comme antalgiques et sont logiquement notamment bénéfique en cas d’adénomyose. En cas d’endométriose profonde ou ovarienne, le faible effet progestatif systémique ne devrait pas suffire à contrôler la maladie10
Contraceptifs oraux combinés (COC)
Les COC sont utilisés «off-label» en tant que médicaments contre l’endométriose, mais restent néanmoins très efficaces dans le traitement de la dysménorrhée.11 Ils sont subjectivement bien tolérés, connus des jeunes patientes, classés officiellement comme des contraceptifs contrairement au diénogest et ont un effet bénéfique sur la peau juvénile. Par opposition aux POP, ils présentent cependant des contre-indications importantes et ne doivent pas être utilisés en cas de thrombophilie, d’obésité, d’abus de nicotine ou de migraine avec déficits neurologiques.12 Les COC contenant du diénogest comme progestatif (p.ex. Valette®) sont à privilégier. La prise de COC à cycle prolongé sans pause mensuelle, et donc sans menstruations, est plus logique dans le traitement de l’endométriose.13 Il semble que l’éthinylestradiol des COC contrecarre l’effet progestatif, de sorte qu’il ne prévient pas suffisamment l’évolution de l’endométriose.14
Analogues de la GnRH
Les analogues de la GnRH entraînent une régulation à la baisse des récepteurs hypophysaires ainsi qu’un état hypoestrogénique, et réduisent efficacement les douleurs liées à l’endométriose: les conséquences sont toutefois aussi des troubles liés à la ménopause et une diminution de la densité osseuse. Sans «add-back therapy», il faut limiter les injections à six mois. Bien qu’autorisés pour le traitement de l’endométriose, les analogues de la GnRH sont aujourd’hui donc des médicaments de deuxième intention. Les œstrogènes (oraux ou transdermiques), les préparations combinées œstroprogestatives ou le tibolone (Livial®) conviennent comme «add-back therapy». L’effet souhaité des analogues de la GnRH sur les douleurs liées à l’endométriose n’est pas diminué par l’«add-back therapy».15
Antagonistes de la GnRH
Le rélugolix, un antagoniste de la GnRH administré par voie orale, est notamment autorisé aux États-Unis pour le traitement de l’endométriose. L’effet thérapeutique,tout comme les effets secondaires, est dose-dépendant. Le rélugolix à 40mg est parfois proposé en combinaison fixe avec de l’estradiol et de l’acétate de noréthistérone (Ryeqo®) comme «add-back therapy».16 Comme les analogues de la GnRH, les antagonistes de la GnRH sont des traitements de deuxième intention.
Traitement chirurgical
Le concept de l’endométriose comme maladie à traiter principalement par la chirurgie est de plus en plus abandonné pour laisser place à celui d’une maladie inflammatoire chronique dont les différentes facettes doivent faire l’objet d’un suivi jusqu’à la ménopause. Dans la mesure du possible, on ne veut opérer qu’une seule fois, au bon moment, avec une indication et un objectif définis, et avec la compétence professionnelle correspondante. Lors de l’opération, l’objectif thérapeutique global doit être très clair. S’il s’agit de réduire au maximum la douleur, le concept chirurgical peut être diamétralement différent de s’il s’agit d’améliorer la fertilité.
Les indications claires pour une opération sont l’endométriose urétérale avec hydronéphrose, les processus sténosants au niveau de l’intestin, la nature incertaine d’une constatation ovarienne et les douleurs qui ne peuvent pas être contrôlées par des médicaments.
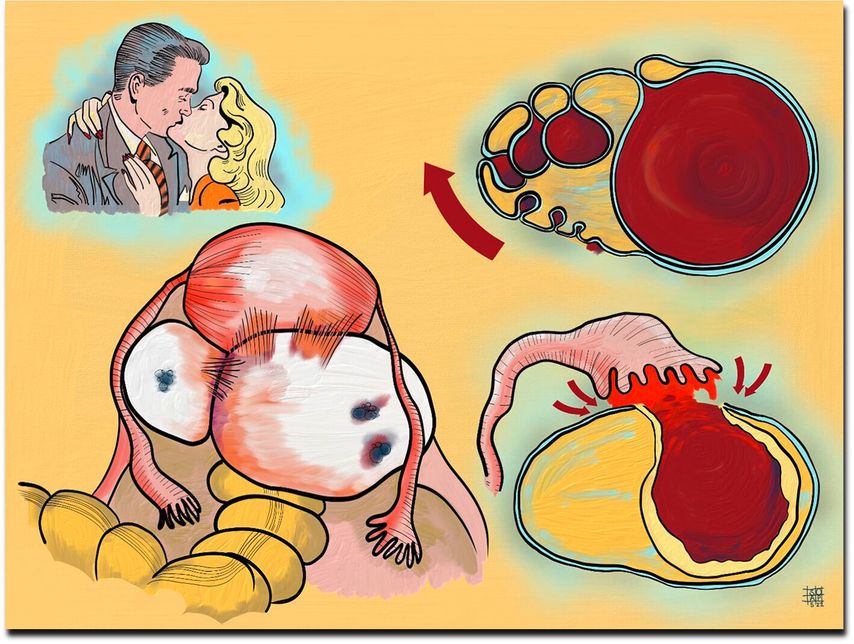
L’élimination des implants d’endométriose peut améliorer le taux de grossesse spontanée, surtout en cas d’endométriose de bas grade.17 Lorsqu’il s’agit de réaliser un désir d’enfant, les mesures médicales de fertilité doivent être anticipées dans la planification. L’exérèse des implants d’endométriose peut éventuellement améliorer le taux de grossesse spontanée,18 mais elle peut diminuer substantiellement la réserve ovarienne et faire vieillir l’ovaire de 10 ans, car la résection de la pseudo-capsule de l’endométriome (= tissu cortical invaginé) entraîne l’ablation des ovocytes qui s’y trouvent (Fig. 5).19 Le taux de naissances vivantes en cas de fécondation in vitro n’est pas amélioré par l’exérèse des endométriomes,20 n’est pas réduit par une endométriose légère, mais l’est par une endométriose sévère.21
Fig. 5: Les endométriomes résultent de l’invagination du cortex ovarien. Leur excision entraîne donc l’ablation du cortex et des ovocytes, ce qui diminue la réserve ovarienne
L’exérèse des implants d’endométriose profonde réduit les symptômes douloureux et améliore la qualité de vie.22 La chirurgie est complexe et doit souvent être interdisciplinaire. Elle améliore tout au plus la fertilité. Dans le cas du traitement chirurgical et de son traitement scientifique, l’accent est toutefois mis sur le traitement de la douleur.23
L’endométriose récidive souvent après les opérations,24 une excision complète ainsi qu’un traitement médicamenteux suppressif postopératoire sont donc plus que recommandés,25 à moins qu’une grossesse soit tout de suite planifiée.
Littérature:
1 Vercellini P et al.: Oral contraceptives and risk of endometriosis: a systematic review and meta-analysis. Hum Reprod Update 2011; 17: 159-70 2 Ballard KD et al.: Can symptomatology help in the diagnosis of endometriosis? Findings from a national case-control study--Part 1. Bjog 2008; 115: 1382-91 3 AWMF: S2k-Leitlinie Diagnostik und Therapie der Endometriose, Version: 4.0, Stand: 01.09.2020 4 ESHRE Guideline Endometriosis, Issued: 2 February 2022 5 Bendifallah S et al.: Salivary microRNA signature for diagnosis of endometriosis. J Clin Med 2022; 11: 612 6 Eberhard M et al.: Expertenstatement zum Endotest. https://www.sggg.ch/news/detail/expertenstatement-zum-endotest ; zuletzt aufgerufen am 18.8.2023 7 Barbieri RL: Endometriosis and the estrogen threshold theory. Relation to surgical and medical treatment. J Reprod Med 1998; 43: 287-92 8 Römer T: Long-term treatment of endometriosis with dienogest: retrospective analysis of efficacy and safety in clinical practice. Arch Gynecol Obstet 2018; 298: 747-53 9 Strowitzki T et al.: Dienogest is as effective as leuprolide acetate in treating the painful symptoms of endometriosis: a 24-week, randomized, multicentre, open-label trial. Hum Reprod 2010; 25: 633-41 10 Lan S et al.: Analysis of the levonorgestrel-releasing intrauterine system in women with endometriosis. J Int Med Res 2013; 41: 548-58 11 Grandi G et al.: Hormonal contraception in women with endometriosis: a systematic review. Eur J Contracept Reprod Health Care 2019; 24: 61-70 12 Merki-Feld GS et al.: Avis d’experts N° 79 (remplace le N° 72). Risque thromboembolique sous contraception hormonale. https://www.sggg.ch/fileadmin/user_upload/Dokumente/3_Fachinformationen/1_Expertenbriefe/Fr/79_Thromboembolierisko_unter_hormonaler_Kontrazeption_F.pdf ; dernier accès le 20.09.2023 13 Muzii L et al.: Continuous versus cyclic oral contraceptives after laparoscopic excision of ovarian endometriomas: a systematic review and metaanalysis. Am J Obstet Gynecol 2016; 214: 203-11 14 Chapron C et al.: Oral contraceptives and endometriosis: the past use of oral contraceptives for treating severe primary dysmenorrhea is associated with endometriosis, especially deep infiltrating endometriosis. Hum Reprod 2011; 26: 2028-35 15 Wu D et al.: Clinical efficacy of add-back therapy in treatment of endometriosis: a meta-analysis. Arch Gynecol Obstet 2014; 290: 513-23 16 Giudice LC et al.: Once daily oral relugolix combination therapy versus placebo in patients with endometriosis-associated pain: two replicate phase 3, randomised, double-blind, studies (SPIRIT 1 and 2). Lancet 2022; 18; 399: 2267-79 17 Hodgson RM et al.: Interventions for endometriosis-related infertility: a systematic review and network meta-analysis. Fertil Steril 2020; 113: 374-82 18 Candiani M et al.: Recurrence rate after „one-step“ CO(2) fiber laser vaporization versus cystectomy for ovarian endometrioma: a 3-year follow-up study. J Minim Invasive Gynecol 2020; 27: 901-8 19 Younis JS et al.: Impact of unilateral versus bilateral ovarian endometriotic cystectomy on ovarian reserve: a systematic review and meta-analysis. Hum Reprod Update 2019; 25: 375-91 20 Hamdan M et al.: The impact of endometrioma on IVF/ICSI outcomes: a systematic review and metaanalysis. Hum Reprod Update 2015; 21: 809-25 21 Hamdan M et al.: Influence of endometriosis on assisted reproductive technology outcomes: a systematic review and meta-analysis. Obstet Gynecol 2015; 125: 79-88 22 Arcoverde FVL et al.: Surgery for endometriosis improves major domains of quality of life: a systematic review and meta-analysis. J Minim Invasive Gynecol 2019; 26: 266-78 23 Bianchi PH et al.: Extensive excision of deep infiltrative endometriosis before in vitro fertilization significantly improves pregnancy rates. J Minim Invasive Gynecol 2009; 16: 174-80 24 Ceccaroni M et al.: Recurrent endometriosis: a battle against an unknown enemy. Eur J Contracept Reprod Health Care 2019; 24(6): 464-74 25 Vercellini P et al.: Post-operative endometriosis recurrence: a plea for prevention based on pathogenetic, epidemiological and clinical evidence. Reprod Biomed Online 2010; 21: 259-65 26 Vercellini P et al.: Medical treatment or surgery for colorectal endometriosis? Results of a shared decision-making approach. Hum Reprod 2018; 33: 202-11
Das könnte Sie auch interessieren:
Les conjugués anticorps-médicament ont le vent en poupe
Actuellement, de nombreux conjugués anticorps-médicament sont en cours d’évaluation dans le cancer du poumon. Qu’ils soient utilisés seuls ou en combinaison avec d’autres thérapies ...
Effets sur la santé ainsi que risques liés au travail posté et de nuit
Le travail posté et de nuit entraîne un risque accru de multiples problèmes de santé en raison de la perte de sommeil et de la désynchronisation circadienne. Il s’agit notamment de ...
Les défis des interfaces interdisciplinaires
Face à un éventail croissant d’options ciblées et immunothérapeutiques, les tests moléculaires sont de plus en plus au centre de l’attention dans les tumeurs gastro-intestinales. Des ...