Dépistage du cancer de la prostate en Suisse
Auteurs:
Anas Elyan
PD Dr méd. Ashkan Mortavezi
Urologie
Universitätsspital Basel
E-mail: ashkan.mortezavi@usb.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Un dépistage moderne du cancer de la prostate a le potentiel de réduire le surdiagnostic du cancer de la prostate n’engageant pas le pronostic vital, de mieux identifier les hommes qui ont réellement besoin d’un prélèvement de tissu et de réduire la mortalité liée à la maladie. Sur la base de ces nouvelles connaissances, l’Union européenne recommande aux pays membres d’évaluer les programmes de dépistage organisé. Quelle est la situation en Suisse?
Keypoints
-
Le cancer de la prostate est le cancer le plus fréquent et la deuxième cause de décès par cancer chez les hommes en Suisse. Il n’existe toutefois à ce jour aucune stratégie de prévention à l’échelle nationale, en raison des inquiétudes légitimes concernant le surdiagnostic et le surtraitement.
-
Un dépistage moderne du cancer de la prostate combine le PSA, des tests sanguins supplémentaires facultatifs et obligatoirement une IRM mp, ce qui réduit le nombre de biopsies effectuées et diminue le pourcentage de surdiagnostics. Il se concentre sur la détection du cancer de la prostate cliniquement pertinent.
-
De nouveaux biomarqueurs, tels que le test Stockholm3, offrent des possibilités prometteuses d’amélioration du dépistage du cancer de la prostate en évitant les biopsies inutiles tout en détectant efficacement les cancers de la prostate cliniquement pertinents.
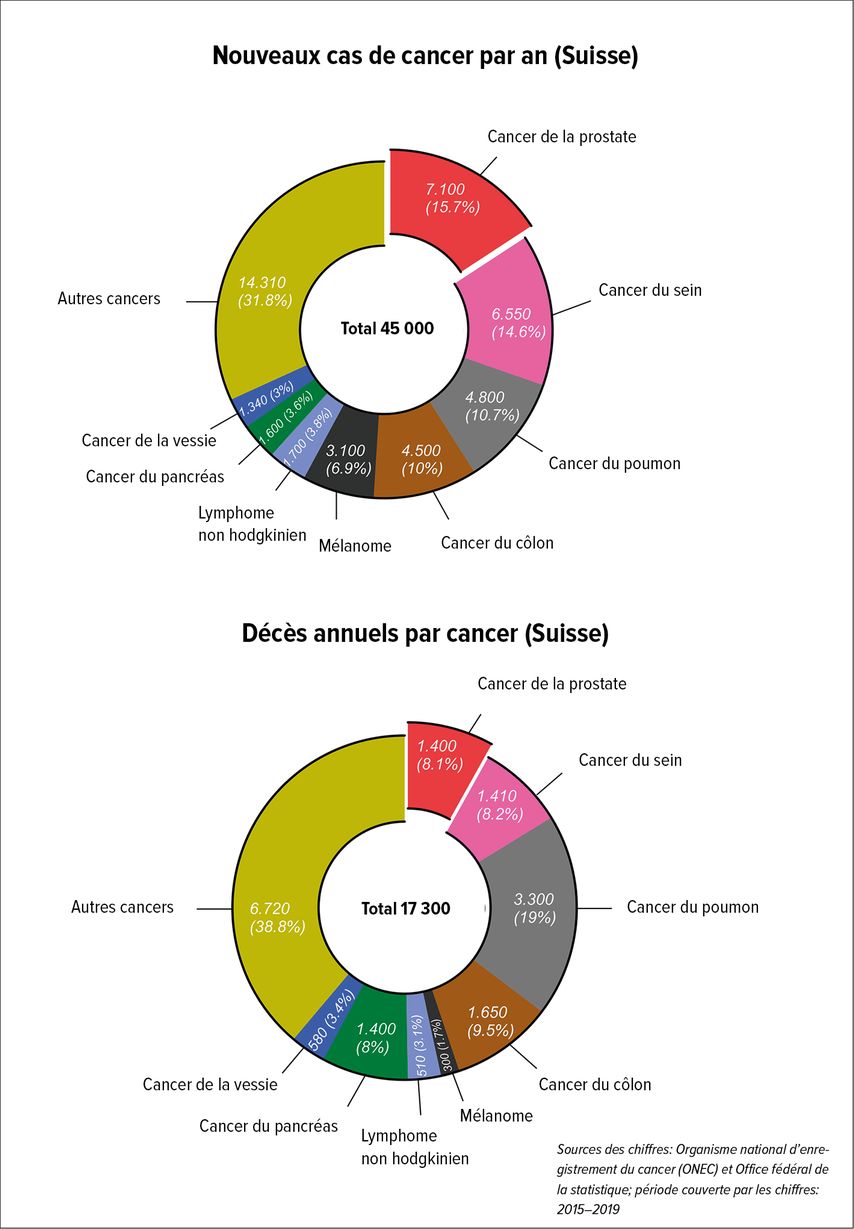
Le cancer de la prostate est le cancer malin le plus fréquent et la deuxième cause de décès par cancer chez les hommes en Suisse (Fig. 1).1 Dans le débat sur le surdiagnostic et le surtraitement de cette maladie, on n’accorde souvent pas assez d’attention à celle-ci. À cela s’ajoute le fait que le nombre d’hommes souffrant déjà d’une maladie métastasée au moment du diagnostic n’est guère pris en compte; on estime que cela concernait plus de 1100 hommes pour l’année 2019 (NICER). Le traitement systémique alors nécessaire, qui consiste en une combinaison de privation hormonale, d’anti-androgènes et, depuis peu, de chimiothérapie, a non seulement des effets négatifs significatifs sur la qualité de vie des patients, mais aussi des répercussions en termes d’économie de la santé en raison des coûts thérapeutiques élevés. Le mode de vie plus sain des hommes, grâce à la diminution de la consommation de nicotine, à une alimentation plus équilibrée, à la pratique sportive, sans oublier le traitement systématique de l’hypertension, de l’hypercholestérolémie et du contrôle de la glycémie, entraîne, selon les données des registres, une diminution constante de la part des causes de décès d’origine cardiovasculaire; les hommes atteignent un âge suffisamment avancé pour développer un cancer de la prostate et en mourir.2
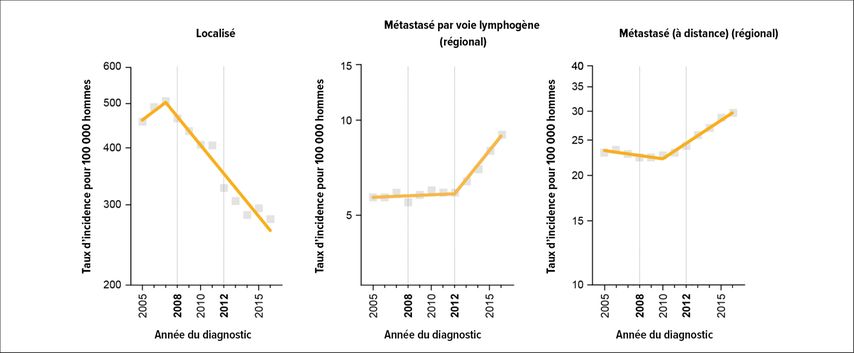
En Suisse, il existe des programmes de dépistage organisé du cancer du sein et du côlon. Parallèlement, des efforts sont fournis pour mettre en place un programme de dépistage précoce du cancer du poumon (www.swisscancerscreening.ch). Aucune initiative comparable n’a été envisagée jusqu’à présent pour le cancer le plus fréquent chez l’homme; on peut supposer que les discussions de la dernière décennie sur le surdiagnostic et le surtraitement ont fait du dépistage du cancer de la prostate un sujet délicat de la politique de santé, au détriment des hommes vivant en Suisse. Dans les autres pays européens, le thème du dépistage du cancer de la prostate a été abordé de manière très intensive ces dernières années, notamment en raison des efforts fournis par l’Association européenne d’urologie (EAU). En décembre 2022, le Conseil de l’Union européenne a mis à jour ses recommandations sur le dépistage du cancer suite à une proposition de la Commission européenne. Il a exprimé son intention d’étendre le dépistage ciblé des cancers du sein, du côlon et du col de l’utérus au cancer de la prostate. La recommandation invite les États membres à étudier la faisabilité et l’efficacité des programmes de dépistage organisé du cancer de la prostate. En Suède, la Confederation of Regional Cancer Centres a été chargée dès 2018 d’aider toutes les régions à établir des programmes de dépistage organisé du cancer de la prostate («organized prostate cancer testing»).3 Le travail de pionnier des Suédois s’explique notamment par le fait que la première cause de décès nationale chez les hommes est le cancer de la prostate, et non le cancer du poumon comme dans le reste de l’Europe, en raison du faible taux de tabagisme. Aujourd’hui, un tel programme a été mis en place dans presque toutes les régions du pays ou le sera prochainement. Sur la base de nouvelles données épidémiologiques provenant d’Amérique du Nord, les opinions concernant le dépistage du cancer de la prostate y ont également changé, après que l’utilisation du dosage du PSA a considérablement diminué au cours de la dernière décennie. L’U.S. Preventive Services Task Force (USPSTF) s’est prononcée contre le dosage du PSA pour les hommes de 75 ans et plus en 2008 en raison de l’absence de preuves quant à son utilité, puis contre pour tous les groupes d’âge en 2012. Nombre se souviennent peut-être encore de ces annonces, qui ont à l’époque également influencé durablement l’attitude des hommes et des médecins de famille vis-à-vis du PSA en Suisse. Il a fallu quelques années pour pouvoir évaluer objectivement les effets réels de ces recommandations. Plusieurs études indépendantes les unes des autres ont depuis mis en évidence une augmentation significative des cas nationaux de cancers de la prostate localement avancés et métastasés qui, après exclusion d’autres facteurs («confounders»), sont attribués à la réduction du nombre de dépistages précoces (Fig. 2).4 Cette évolution a déjà conduit l’USPSTF à réviser ses recommandations. Il n’existe malheureusement pas encore de données pour la Suisse, car aucune collecte n’a été effectuée à ce niveau avant l’instauration des registres des tumeurs. Les premières conclusions ne sont pas attendues avant 3 à 4 ans.
Fig. 2: Tendances actuelles des taux d’incidence ajustés en fonction de l’âge issus du programme SEER, 2000–2020 (États-Unis). L’USPSTF a émis une recommandation contre le dosage du PSA pour les hommes de ≥75 ans en 2008, puis pour tous les hommes en 2012 (adapté selon Jemal et al., 2021)4
Preuves scientifiques
La controverse concernant le dépistage du cancer de la prostate porte généralement sur la faible spécificité du dosage du PSA et le surtraitement des cancers non cliniquement pertinents. Dans le contexte des algorithmes classiques (aucune imagerie ni biopsie aléatoire transrectale), des études montrent qu’un dépistage opportuniste, tel qu’il a été majoritairement pratiqué en Suisse, présente un rapport coût/bénéfice négatif. En connaissance des faiblesses du diagnostic du cancer de la prostate, des efforts de recherche intensifs ont été déployés au cours des dernières décennies pour développer de nouvelles procédures et de nouveaux algorithmes de diagnostic. Ceux-ci sont spécialement conçus pour identifier les hommes atteints d’un cancer de la prostate cliniquement pertinent, défini par un score de Gleason ≥7 (nouveau: grade ≥2). Ils comprennent dans un premier temps de nouveaux biomarqueurs et nomogrammes pour améliorer la sensibilité ainsi que la spécificité lors du triage initial. Dans un deuxième temps, ils incluent l’imagerie par résonance magnétique multiparamétrique (IRMmp) et des méthodes de fusion pour des prélèvements de tissu ciblés sur les lésions détectées afin de réduire les biopsies bénignes, de surdétecter les cancers non pertinents, mais aussi d’éviter les résultats de faux négatifs. La transition définitive d’une voie transrectale à transpérinéale a notamment permis de réduire drastiquement la fréquence des complications infectieuses.
Dépistage pour réduire la mortalité
Il est important de mentionner au préalable le résultat «négatif» de l’étude nord-américaine PLCO (Prostate, Lung, Colorectal, and Ovarian Cancer Screening Trial) sur le dépistage du cancer de la prostate qui a été à l’origine de la recommandation de l’USPSTF contre le dosage du PSA il y a 10 ans.5 Après une randomisation 1:1 de 76685 hommes âgés de 55 à 74 ans dans un groupe recevant une invitation annuelle au dosage du PSA et un groupe témoin, aucune différence n’a été constatée après 13 ans en termes de mortalité par cancer de la prostate. Des analyses ultérieures, qui n’ont malheureusement été effectuées qu’après plusieurs années, ont toutefois montré que le dépistage réduisait tout de même la mortalité de 32%. La conclusion initiale ne tenait en effet pas compte de la contamination significative dans le groupe témoin avec dépistage opportuniste du PSA (85% des hommes ont réalisé un dosage du PSA au moins une fois pendant la période d’observation).6 Même si les résultats de l’étude PLCO ne sont désormais plus considérés comme pertinents pour l’évaluation de l’utilité du dosage du PSA par la plupart des experts, l’interprétation initiale constitue encore aujourd’hui la base de la controverse sur le PSA.
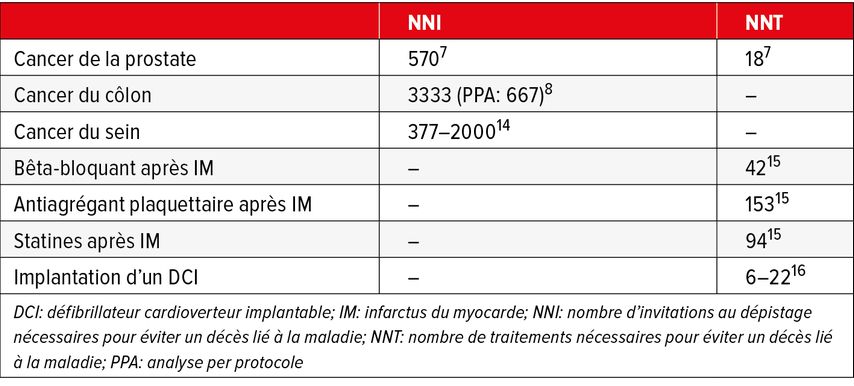
L’étude ERSPC (European Randomised Study of Screening for Prostate Cancer) a donné un résultat «positif». Celle-ci a randomisé de manière aléatoire 182000 hommes âgés de 50 à 74 ans dans un groupe qui a reçu une invitation à réaliser un dépistage du PSA tous les quatre ans ou un groupe témoin. Après 16 ans de suivi, on a constaté une réduction de 20% de la mortalité par cancer de la prostate dans le groupe avec dépistage; en chiffres absolus, 570 hommes ont été invités à réaliser un dosage du PSA et 18 cas ont dû être diagnostiqués pour éviter tout décès par cancer de la prostate.7
À titre de comparaison, voici les données les plus récentes de l’étude NordICC sur le dépistage du cancer du côlon:8 455 invitations ont dû être envoyées pour éviter un seul cas de cancer du côlon. Le dépistage n’a pas permis de réduire significativement la mortalité par cancer du côlon, même si une tendance a été observée (risque relatif: 0,90; IC à 95%: 0,64–1,16). Dans un calcul analogue à celui de l’étude ERPSC, il faudrait donc 3333 invitations pour éviter un décès par cancer du côlon; dans un scénario hypothétique où chaque patient invité se présente à l’examen (analyse per protocole), cette valeur s’élève au mieux à 667. Pour le dépistage du cancer du sein, l’efficacité dépend fortement du groupe d’âge étudié; en conséquence, la fourchette des chiffres indiqués dans la littérature est très large (377–2000) et se recoupe, pour les scénarios les plus «optimistes», avec celle du cancer de la prostate (Tab. 1).
Tab. 1: Nombre d’invitations (NNI) ou de traitements (NNT) nécessaires pour éviter un décès lié à la maladie
Progrès en matière de dépistage (précoce)
Le dosage du PSA présente certes une bonne sensibilité pour la détection du cancer de la prostate au stade précoce, mais se caractérise par une faible spécificité. Dans le cas de valeurs modérément élevées (3–10ng/ml), la cause est plus souvent une inflammation ou une hyperplasie non spécifique qu’un cancer. Il en résulte que de nombreux hommes sont guidés à travers le processus de diagnostic sans obtenir au final la confirmation d’un cancer de la prostate cliniquement pertinent. Alors qu’une IRM est peu invasive et sans exposition aux radiations, une biopsie de la prostate, même réalisée dans les règles de l’art par voie transpérinéale, est associée à des risques pertinents. Les deux examens ont en commun le stress psychologique auquel sont soumis les hommes sains et asymptomatiques.
Ces dernières années, l’amélioration du diagnostic a permis de réduire considérablement les taux de faux négatif des biopsies et la détection de cas non cliniquement pertinents. L’utilisation d’une IRM multiparamétrique de la prostate pour détecter les lésions prostatiques en combinaison avec des biopsies prostatiques ciblées a entraîné une réduction significative du taux de détection des tumeurs non cliniquement pertinentes. Les hommes dont l’IRM est normale ne doivent plus subir de biopsie. Parallèlement, la biopsie par fusion guidée par imagerie a permis d’augmenter le taux de détection des maladies cliniquement pertinentes qui étaient auparavant (p.ex. dans l’étude ERSPC) manquées à une fréquence significative par la biopsie aléatoire transrectale. Ce qui avait déjà fait ses preuves dans la pratique devait toutefois encore être démontré au niveau de la population. En effet, deux nouvelles études prospectives randomisées menées en Suède ont également pu mettre en évidence ces avantages de l’IRM dans le cadre du dépistage.9,10 Même si dans les deux études, seule une IRM biparamétrique sans produit de contraste a été réalisée, les ressources nécessaires pour un tel programme, dans lequel seul le dosage du PSA déclenche l’imagerie, et les coûts associés ne sont pas négligeables au niveau de la population. Une manière de les réduire et d’augmenter encore l’efficacité de l’algorithme de diagnostic est d’effectuer un test de triage intermédiaire pour l’IRM. Comme celui-ci est uniquement réalisé en cas de dépassement d’une valeur limite prédéfinie du PSA, on parle également de test réflexe.
Tests réflexe
Le dosage du PSA est bon marché et constitue une analyse de routine dans la plupart des laboratoires en Suisse. Il est donc parfaitement adapté comme test de triage initial dans le cadre du dépistage. On sait que le risque d’un cancer de la prostate pertinent est extrêmement faible en dessous d’une valeur de 1,5µg/l. Heureusement, 65% des hommes (tous âges confondus) ont présenté une valeur inférieure.11 À partir d’une valeur de 1,5µg/l, le risque augmente en continu. Souvent utilisée, la valeur de tolérance de 3,0µg/l (parfois même de 2,5µg/l) est un compromis entre sensibilité et spécificité, même si on manque ainsi un nombre significatif de cancers pertinents dans la plage grise de 1,5–3,0µg/l. Un concept intéressant consiste à développer un test réflexe qui n’est effectué qu’à partir d’un certain taux de PSA, par exemple 1,5µg/l. Il peut alors être plus cher et plus complexe, tant qu’il s’avère plus performant que le dosage du PSA. Selon le pays, différents tests sont déjà disponibles sur le marché, par exemple le «Prostate Health Index» ou le «4Kscore Test». Bien que tous deux aient été validés dans des cohortes d’hommes présentant un taux de PSA élevé avant biopsie, ils n’ont pas été utilisés dans le cadre d’un dépistage au sens d’un test de dépistage précoce. Le test sanguin Stockholm3, qui (comme son nom l’indique) a été développé en Suède à l’Institut Karolinska, semble donc particulièrement prometteur.12 Analysant deux tubes, il combine cinq biomarqueurs protéiques et 232 polymorphismes mononucléotidiques (SNP). Il s’agit de variations de la séquence d’ADN qui apparaissent à des endroits spécifiques du génome. Les SNP constituent le type de variation génétique le plus courant chez l’être humain et sont associées à l’apparition de certaines maladies. Le test Stockholm3 présente l’avantage de donner une indication très précise sur le risque de présence d’un cancer de la prostate pertinent avec très peu de paramètres cliniques pouvant être recueillis sans l’intervention d’un spécialiste (âge, antécédents familiaux de cancer de la prostate, biopsie prostatique antérieure non suspecte, prise d’un inhibiteur de la 5-alpha-réductase). Il a été comparé au dosage du PSA dans deux grandes études basées sur la population en Suède. Il faut noter qu’un nombre significatif de cancers pertinents ont été détectés dans la plage de PSA 1,5–3,0µg/l. Selon la valeur limite choisie (11% ou 15%), l’utilisation du test Stockholm3 chez les hommes présentant un taux de PSA >1,5µg/l permet de réduire presque de moitié le nombre d’IRM ou d’augmenter de 20% la détection des cancers pertinents12,13 – et ce, sans aucune évaluation ou examen urologique avant l’imagerie.
En raison de l’hétérogénéité des SNP au sein de la population, le test a été évalué en 2022 dans le cadre d’une étude de validation multicentrique en Suisse; la performance du test s’est maintenue même en dehors des pays scandinaves dans une population d’Europe centrale.
Conclusion
Les recherches les plus récentes ont montré qu’une approche moderne du dépistage du cancer de la prostate, combinant le PSA, un test sanguin supplémentaire et l’IRM, réduit le surdiagnostic du cancer de la prostate n’engageant pas le pronostic vital et identifie mieux les hommes qui ont réellement besoin d’un prélèvement de tissu. La valeur diagnostique de ces tests supplémentaires est évidente, mais d’autres recherches sont nécessaires pour déterminer la meilleure façon de les utiliser. Compte tenu de l’ampleur considérable du dépistage opportuniste en cours en Suisse, les cantons devraient envisager une approche progressive, y compris des projets pilotes et des études, afin d’évaluer la faisabilité ainsi que l’efficacité de la mise en œuvre de programmes de dépistage organisé du cancer de la prostate. Ces derniers doivent viser à garantir un traitement et une qualité adéquats sur la base du dosage du PSA, combiné éventuellement à un biomarqueur, mais obligatoirement à une IRM. Une prise de position de la Société suisse d’Urologie (SSU) concernant un tel effort est attendue pour l’automne prochain.
Littérature:
1 Cirillo P et al.: Schweizerischer Krebsbericht 2021. Neuchâtel: BFS, 2021 2 ReFaey K et al.: Cancer mortality rates increasing vs cardiovascular disease mortality decreasing in the world: future implications. Mayo Clin Proc Innov Qual Outcomes 2021; 5: 645-53 3 Bratt O: Organised prostate cancer testing. 2023. https://cancercentrum.se/samverkan/vara-uppdrag/prevention-och-tidig-upptackt/prostatacancertestning/organised-prostate-cancer-testing/; zuletzt aufgerufen am 15.8.2023 4 Jemal A et al.: Prostate cancer incidence 5 years after US Preventive Services Task Force recommendations against screening. J Natl Cancer Inst 2021; 113: 64-71 5 Andriole GL et al.: Mortality results from a randomized prostate-cancer screening trial. N Engl J Med 2009; 360: 1310-9 6 Shoag JE et al.: Reevaluating PSA testing rates in the PLCO trial. N Engl J Med 2016; 374: 1795-6 7 Hugosson J et al.: A 16-yr follow-up of the European randomized study of screening for prostate cancer. Eur Urolol 2019; 76: 43-51 8 Bretthauer M et al.: Effect of colonoscopy screening on risks of colorectal cancer and related death. N Engl J Med 2022; 387: 1547-56 9 Hugosson J et al.: Prostate cancer screening with PSA and MRI followed by targeted biopsy only. N Engl J Med 2022; 387: 2126-37 10 Eklund M et al.: MRI-targeted or standard biopsy in prostate cancer screening. N Engl J Med 2021; 385: 908-20 11 Crawford ED et al.: An approach using PSA levels of 1.5ng/mL as the cutoff for prostate cancer screening in primary care. Urol 2016; 96: 116-20 12 Grönberg H et al.: Prostate cancer screening in men aged 50-69 years (STHLM3): a prospective population-based diagnostic study. Lancet Oncol 2015; 16: 1667-76 13 Eklund M et al.: The Stockholm-3 (STHLM3) model can improve prostate cancer diagnostics in men aged 50-69 yr compared with current prostate cancer testing. Eur Urol Focus 2018; 4: 707-10 14 Gøtzsche PC, Nielsen M: Screening for breast cancer with mammography. Cochrane Database Syst Rev 2011; (1): CD001877 15 Ong HT: Beta blockers in hypertension and cardiovascular disease. BMJ 2007; 334: 946-9 16 Uhlig K et al.: Assessment on implantable defibrillators and the evidence for primary prevention of sudden cardiac death. Rockville (MD): Agency for Healthcare Research and Quality (US), 2013
Das könnte Sie auch interessieren:
Les conjugués anticorps-médicament ont le vent en poupe
Actuellement, de nombreux conjugués anticorps-médicament sont en cours d’évaluation dans le cancer du poumon. Qu’ils soient utilisés seuls ou en combinaison avec d’autres thérapies ...
Effets sur la santé ainsi que risques liés au travail posté et de nuit
Le travail posté et de nuit entraîne un risque accru de multiples problèmes de santé en raison de la perte de sommeil et de la désynchronisation circadienne. Il s’agit notamment de ...
Les défis des interfaces interdisciplinaires
Face à un éventail croissant d’options ciblées et immunothérapeutiques, les tests moléculaires sont de plus en plus au centre de l’attention dans les tumeurs gastro-intestinales. Des ...