
Beginn einer neuen Ära in der Dermatologie und ästhetischen Medizin
Die neueste Entdeckung der wiederkehrenden De- und Redifferenzierungen der reifen dermalen Adipozyten an der Grenze Dermis/Subkutis sowie ihrer Transdifferenzierung in Myofibroblasten wird gravierende Konsequenzen für die Dermatologie und die ästhetische Medizin haben. Diese Prozesse sind stark von der Phase des Haarfollikelzyklus abhängig und müssen in die Akne, Psoriasis, Wundheilung, Fibrosierung/Narbenbildung, androgenetische Alopezie und Hautalterung involviert werden.
Noch vor wenigen Jahren erschienen die Grundlagen der Dermatologie als klar und robust. Hautschichten und die dazugehörigen Zelltypen waren längst beschrieben worden und ihr dynamisches Verhalten mehr oder weniger definiert. Man konzentrierte sich auf die Unterschiede zwischen normaler Haut und Hautpathologien, versuchte die «Ursachen» ausfindig zu machen und dann die entsprechenden Behandlungsstrategien aufzustellen. Auf den gleichen Grundlagen basierte auch die ästhetische Medizin, welche die Effektivität der zahlreichen Behandlungsmethoden mit anatomischen und physiologischen Veränderungen in bekannten Hautstrukturen begründete.
Diese Grundlagen wurden zuletzt innerhalb weniger Jahre immer mehr angezweifelt. Zuerst wurde ein neuer Zelltyp in der Haut entdeckt. Diese Zellen befinden sich um die Haarfollikel herum sowie an der Grenze zwischen Dermis und Subkutis und sehen äusserlich wie Adipozyten aus, jedoch nur äusserlich und auch nicht alle von ihnen. Wie eine genetische Analyse zeigte, sind diese Zellen keine klassischen Fettzellen und befinden sich phänotypisch irgendwo zwischen Adipozyten und Fibroblasten. Das verleiht diesen Zellen ganz neue Eigenschaften – sie reagieren schnell, können sich rasant vermehren und demonstrieren eine hohe Plastizität. Solche Zellen wurden «dermale Adipozyten» genannt. Wenig später wurden sie sogar in ein eigenständiges Fettdepot («dermal white adipose tissue», dWAT) ausgegliedert.1 Spätestens ab diesem Moment war es offensichtlich, dass wir es mit einer neuen Hautschicht zu tun haben.
Es wurde schnell festgestellt, dass dermale Adipozyten eine wichtige Rolle in der Wundheilung, in der kutanen Fibrosierung und Narbenbildung, im Haarzyklus, bei androgenetischer Alopezie und angeborener Immunabwehr der Haut spielen. Sie wurden auch als ein wichtiger Bestandteil der Hautalterung erkannt. Eine grosse Überraschung im Zusammenhang mit diesen Zellen stand allerdings noch bevor.
Entdeckung der zyklischen Veränderungen in dWAT
Eine besondere Eigenschaft von diesem neuen Fettdepot ist seine starke (mehr als 50%) Volumenvergrösserung in der Anagen-Phase des Haarfollikel(HF)-Zyklus und eine genauso starke Volumenreduzierung in den Katagen-/Telogen-Phasen. Um es mit anderen Worten auszudrücken: Das dWAT-Volumen schwankt im Takt des HF-Zyklus. Aus welchem Grund passiert das? Sterben die Adipozyten in der Katagen-Phase und werden sie dann aus den Stammzellen in der Anagen-Phase neu produziert? Oder werden sie ihr Volumen nur durch Lipolyse in der Katagen-Phase reduzieren und später in der Anagen-Phase durch Lipogenese wiederaufbauen?
Eine Antwort auf diese Frage, die wir vor Kurzem im Rahmen einer umfangreichen experimentellen Forschungsarbeit erhalten haben, war überraschend.2 Die reifen dermalen Adipozyten sterben beim Abbau des dWAT-Depots nicht und werden bei seinem Wiederaufbau kaum neu produziert. Diese zyklischen Veränderungen des Volumens sind auch nicht mit einfachen Prozessen der Lipolyse und Lipogenese zu erklären. Reife Adipozyten, die die Eigenschaft besitzen, Lipide zu speichern, verwandeln sich während der Katagen-Phase des HF-Zyklus schlicht und ergreifend zurück in die undifferenzierten Zellen (sog. Präadipozyten), die keine Lipidtropfen tragen und sich zwischen adipositären Stammzellen und «richtigen» Adipozyten einordnen lassen. In der Katagen-Phase findet also eine Dedifferenzierung der Adipozyten statt. Während der Anagen-Phase transformieren sich solche Präadipozyten durch ihre Redifferenzierung wieder zurück in die reifen Adipozyten. Solche Zelltransformationen finden wiederkehrend in jedem HF-Zyklus statt. Schätzungsweise über 95% aller dermalen Adipozyten befinden sich in diesem Kreislauf,2 was auch bedeutet, dass solche zyklischen Umwandlungen einer physiologischen Grundlage bedürfen. Hier muss erwähnt werden, dass dWAT schon das zweite Fettdepot ist, in welchem Dedifferenzierungen der reifen Adipozyten in vivo formell nachgewiesen wurden: Ähnliche Transformationen wurden vor Kurzem in der Glandula mammaria während der Laktation festgestellt.3 Alles deutet darauf hin, dass solche De- und Redifferenzierungen der reifen Adipozyten zu einem allgemeinen physiologischen Phänomen gehören, welches man früher nicht kannte. Das ist schon spannend genug, aber bei Weitem nicht alles.
Unter gewissen Umständen transformieren sich die in der Katagen-Phase entstandenen Präadipozyten nicht zurück in reife Adipozyten, sondern in völlig andere Zellen mit ganz anderen Funktionen – nämlich in synthetisch hyperaktive Myofibroblasten.2 Wegen einer dabei entstandenen signifikanten Phänotyp-Veränderung der involvierten Zellen spricht man bei solchen Prozessen von einer Transdifferenzierung, die nicht mehr physiologisch, sondern pathologisch ist und die zu einer kutanen Fibrosierung und/oder zu einer Narbenbildung führen kann (Abb. 1).
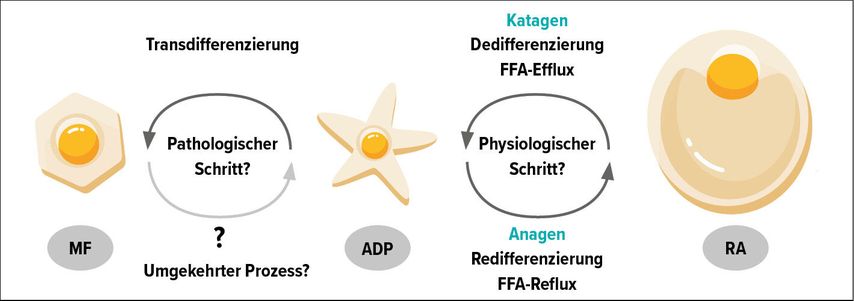
Abb. 1:Transformationen dermaler Adipozyten während des HF-Zyklus. ADP, Adenosindiphosphat; FFA, freie Fettsäuren; MF, Myofibroblasten; RA, reife Adipozyten. Modifiziert nach Kruglikov IL, Scherer PE 201918
Was können diese zyklischen Zelltransformationen in der Haut bewirken?
Die oben beschriebenen Transformationen der Hautzellen sind stark vom HF-Zyklus abhängig: Dedifferenzierte Präadipozyten entstehen nur in der Katagen-Phase, reife Adipozyten in der Anagen-Phase. Myofibroblasten können in Katagen-/Telogen-Phasen produziert werden, weil nur in diesen Phasen des HF-Zyklus dedifferenzierte Präadipozyten reichlich im Gewebe vorhanden sein sollten. Da menschliche Haare sich in der Regel nicht synchron entwickeln, bedeutet dies, dass die Haut mesoskopisch eine mosaikförmige Struktur haben muss. Dementsprechend können sich zwei benachbarte HF in völlig unterschiedlichen Hautumgebungen befinden. Dieses Hautbild ist nicht statisch und ändert sich im Rhythmus des HF-Zyklus. Somit sollten lokale physiologische und mechanische Eigenschaften der Haut von der HF-Zyklus-Phase der in einem lokalen Hautareal befindlichen Haare abhängig sein.
Es wurde schnell klar, dass solche Zelltransformationen eine wichtige Rolle in der Pathogenese verschiedener Hauterkrankungen spielen sollten. Hier sollen nur einige Beispiele kurz beschrieben werden.
Acne vulgaris
Während der Katagen-Phase des HF-Zyklus, wo kleinere Präadipozyten aus viel grösseren reifen Adipozyten entstehen (Abb. 1), werden grössere Mengen von Fettsäuren in die lokale Umgebung des HF freigesetzt.2 So eine kurzfristige lokale Freisetzung der Fettsäuren am distalen Ende eines HF kann zu einer entzündlichen Reaktion in diesem Areal führen und somit ähnliche Folgen wie eine klassische Hyperseborrhö haben. Dieser bisher nicht bekannte Mechanismus kann eine wichtige Rolle in der Pathophysiologie der Akne spielen. Die Involvierung des physiologischen Mechanismus der Adipozyten-Dedifferenzierung in die Akneentstehung kann sogar bedeuten, dass die Akne, die während der Pubertät eine Prävalenz von nahezu 100% hat, keine richtige Hauterkrankung ist.
Lokale HF-Zyklus-abhängige Zelltransformationen stellen nicht nur die Pathogenese einer Entzündung, sondern auch die anderen Grundsteine der Akne infrage. Eine Veränderung des Verhaltens der Aknebakterien C. acnes (früher P. acnes) von kommensalistisch (neutral) auf pathologisch kann damit zu tun haben, dass die undifferenzierten Zellen (Präadipozyten) deutlich weniger Abwehrmöglichkeiten gegen diese Bakterien im Vergleich zu reifen Zellen (Adipozyten) haben und die Bakterien somit einfacher in solche Zellen eindringen können. Eine solche Wechselwirkung zwischen den Wirtszellen und Pathogenen verläuft tatsächlich unterschiedlich in differenzierten und undifferenzierten Zellen. Das Ganze passt gut zum bekannten, aber lang ignorierten Phänomen, dass die Akneläsionen sich überwiegend während der Katagen-/Telogen-Phasen des HF-Zyklus entwickeln,4 wo eine grosse Anzahl solcher dedifferenzierten Zellen innerhalb einer relativ kurzen Zeit entstehen.
Eine mögliche Transformation der Präadipozyten in Myofibroblasten erklärt auch, wie eine Entzündung mit einer Narbenbildung/Fibrosierung verbunden ist und warum viele Aknepatienten Aknenarben entwickeln. Solche pathologischen Transdifferenzierungen der Adipozyten in Myofibroblasten finden allerdings nur unter gewissen Umständen statt. Einer der Hauptverdächtigen ist der transformierende Wachstumsfaktor β1 (TGF-β1). Anfängliche TGF-β1-Werte in Akneläsionen sind generell hoch. Sie normalisieren sich bei Patienten ohne Aknenarben schon wenige Tage nach der Entstehung der Akneläsionen, bleiben allerdings bei narbenbildenden Patienten langfristig hoch.5 Die Zusammenhänge werden klar, wenn man berücksichtigt, dass eine Transdifferenzierung der Präadipozyten in Myofibroblasten erst nach einer prolongierten TGF-β-Stimulation stattfinden kann.
Es sollte nicht der Eindruck entstehen, dass die oben beschriebenen Zelltransformationen ausschliesslich für die Akne von Bedeutung sein sollten. Nach dem heutigen Wissensstand sind auch die Wundheilung, Narbenbildung, Psoriasis, androgenetische Alopezie und Hautalterung betroffen. Man kann aber zum jetzigen Zeitpunkt nicht ausschliessen, dass auch die Pathogenesen einiger anderer Hauterkrankungen infrage gestellt werden sollten.
Psoriasis
Haarfollikel in psoriatischen Plaques demonstrieren eine bemerkenswerte Verschiebung von Anagen zu Telogen: Während in einer normalen Kopfhaut lediglich ca. 20% aller HF sich in der Telogen-Phase befinden, steigt dieser Anteil in psoriatischen Läsionen auf mehr als 40%.6 Dieser Effekt deutet auf eine Teilsynchronisierung der HF in betroffenen Hautarealen hin, was eigentlich sehr ungewöhnlich ist.
Tatsächlich geht man in der klassischen Dermatologie generell davon aus, dass unter physiologischen Bedingungen die benachbarten HF sich völlig unabhängig voneinander (asynchron) verhalten. Diese wichtige These wurde allerdings vor Kurzem infrage gestellt.7 Alles deutet darauf hin, dass sich die HF unter gewissen Umständen in räumlich begrenzten Hautarealen synchronisieren können. Dabei könnte eine Proteinlipidierung eine wichtige Rolle spielen. Eine solche Lipidierung kann auch zu einer synchronisierten Zellumwandlung in begrenzten Hautarealen (Clusterbildung) führen und somit Veränderungen, die bei einem asynchronen Verhalten der Haare auf die einzelnen HF konzentriert sind, auf interfollikuläre Räume ausbreiten.
Wichtig ist, dass dermale Adipozyten nicht nur Fettsäuren bei ihrer Dedifferenzierung freisetzen, sondern auch antimikrobielle Peptide (vor allem Cathelicidin) in grossen Mengen produzieren, welche zu den wichtigsten Bestandteilen der angeborenen Hautimmunabwehr gehören. Cathelicidin ruft in höheren Konzentrationen eine starke entzündliche Reaktion in der Haut hervor. Es wurde vor einigen Jahren demonstriert, dass in murinem dWAT während der Differenzierung der Präadipozyten (d.h. in der Anagen-Phase des HF-Zyklus) Cathelicidin massiv produziert wurde, was die Haut vor mikrobiellen Angriffen (in der Originaluntersuchung war das S. aureus) schützen sollte. Nun konnten wir zusätzlich zeigen, dass Cathelicidin auch in beachtlicher Menge in menschlichem dWAT produziert wird und in menschlichen psoriatischen Läsionen signifikant erhöht ist.2 Dieses Bild stimmt mit der von uns kürzlich vorgeschlagenen neuen Pathophysiologie der Psoriasis überein, welche die Entstehung psoriatischer Läsionen primär mit lokalen Veränderungen im darunterliegenden dWAT-Depot und nicht mit systemischen Veränderungen im Fettgewebe verbindet.8–10
Narben
Es ist bekannt, dass Verbrennungen erst dann zur Entwicklung von hypertrophen Narben oder Keloiden führen, wenn die Grenze Dermis/Subkutis bei der Verletzung erreicht wurde. Ausserdem entstehen solche Narben nur an solchen Körperstellen, an welchen dermale Adipozyten ausgeprägte konusförmige Strukturen um die HF herum bilden (sogenannte «dermale Konusse»),1 d.h. dort, wo dermale Adipozyten reichlich vorhanden sind. Es wurde bis jetzt angenommen, dass Myofibroblasten, die für eine Narbenbildung kausal verantwortlich sind, hauptsächlich aus normalen Fibroblasten entstehen, die sich in der gesamten Dermis verteilen. Darum war es auch nicht ganz klar, warum die zur Bildung der hypertrophen Narben und Keloiden führenden Hautverletzungen unbedingt tief sein sollten. Wenn aber nicht eine Differenzierung der Fibroblasten, sondern eine Transdifferenzierung der Präadipozyten in Myofibroblasten hauptsächlich in eine Narbenbildung involviert ist, müssen diese an der Grenze Dermis/Subkutis liegenden Zellen zuerst durch eine Verletzung erreicht werden.
Die bei der Akne entstehenden typischen atrophen Narben (über 70% aller Aknenarben) wurden bis jetzt pathogenetisch hauptsächlich mit einer signifikanten Reduktion der elastischen und kollagenen Netzwerke in der betroffenen Haut in Verbindung gebracht. Jetzt muss aber stark vermutet werden, dass dWAT höchstwahrscheinlich ursächlich in ihre Bildung involviert ist. Eine Hämatoxylin-Eosin-Färbung der Biopsien aus normaler Haut und atrophen Narben demonstrierte ein komplettes Verschwinden der typischen dWAT-Strukturen im Narbengewebe.11 Dies deutet darauf hin, dass eine Transdifferenzierung dermaler Adipozyten in atrophen Narben stattfindet und, wie es auch nach einer Bleomycin-Injektion passiert, das Fettgewebe durch eine Fibrose ersetzt wird. So eine unerwartete Pathophysiologie kann zu einer grundsätzlichen Revision der Behandlungsstrategien bei Narben führen und die Behandlungsakzente auf Präventionsbehandlungen verschieben, welche das dWAT-Verhalten vor der Narbenbildung steuern.
Hautalterung
DWAT erweitert sich kontinuierlich während der chronologischen Alterung.12 Dies führt automatisch zu einer effektiven Reduzierung der Dermisdicke, weil Dermis und dWAT zwei Schichten einer einzigen geschichteten Struktur sind.12 Allein diese Tatsache stellt die Dermisdicke als zuverlässigen Indikator der Hautalterung erheblich infrage.
Gleichzeitig wird die Anzahl der Präadipozyten während der chronologischen Alterung signifikant reduziert.13 Das bedeutet, dass weniger De- und Redifferenzierungen der reifen Adipozyten in alternder Haut stattfinden können und somit die reifen Adipozyten an der Grenze Dermis/Subkutis überproportional akkumuliert werden. Auf der anderen Seite wurde gezeigt, dass eine UV-B-induzierte Hautalterung zu einer Reduzierung der dWAT und einer lokalen Fibrosierung im Fettgewebe führt.14 Das deutet darauf hin, dass UV-B eine Transdifferenzierung der Präadipozyten in Myofibroblasten induzieren kann. Obwohl chronologische und photoinduzierte Hautalterungen letztendlich zu ähnlichen Hauterscheinungen (mit gewissen Unterschieden) führen, müssen ihre pathophysiologischen Wege entsprechend diesem Bild unterschiedlich sein.
Auch die Wirkungen der verschiedenen Anti-Aging-Präparate und energiebasierenden Behandlungsmethoden erscheinen in diesem Licht völlig anders. Zum Beispiel demonstrieren Retinoide einen Anti-Aging-Effekt, werden aber auch zur Behandlung einiger entzündlicher Hauterkrankungen eingesetzt. Sie inhibieren die Adipogenese durch Reduzierung der Differenzierung der Präadipozyten in reife Adipozyten, können aber auch die Cathelicidin-Expression während der Adipogenese erheblich stimulieren.15 Das sollte zu einer Verschiebung der Zellen in dWAT von reifen Adipozyten zu Präadipozyten führen. Dementsprechend wird die Anzahl der Präadipozyten in der Nähe der Grenze Dermis/Subkutis nach einer langfristigen Retinoid-Behandlung erhöht, was zu einer Hautbildverbesserung führen sollte. Weil für so eine Wirkung zuerst eine physiologische Dedifferenzierung der reifen Adipozyten in Präadipozyten und erst danach eine Blockade ihrer Redifferenzierung in reife Adipozyten stattfinden sollte, kann der Anti-Aging-Effekt der Retinoide erst nach einer relativ langen Anwendungszeit (im Vergleich zum gesamten HF-Zyklus) zustande kommen, was aus der Praxis auch bekannt ist.
Reife Adipozyten haben andere mechanische Eigenschaften als Präadipozyten, u.a. weil diese Zellen deutlich mehr Protein Caveolin-1 (Cav-1) produzieren.12 Cav-1 ist der wichtigste Bestandteil der Caveolae (Invaginationen in Plasmamembranen), welcher mit dem Zytoskelett auf der Innenseite und mit der extrazellulären Matrix auf der Aussenseite der Zelle interagiert. Cav-1 ist in Keratinozyten, Fibroblasten, Makrophagen, endothelialen Zellen und Adipozyten reichlich vorhanden und wurde als Masterregulator der zellulären Signaltransduktion erkannt. Niedrige Cav-1-Werte sind typisch bei verschiedenen entzündlichen und hyperproliferativen Hauterkrankungen;16–19eine Hautalterung und diabetische Wunden sind dagegen mit signifikant erhöhter Cav-1-Expression verbunden.12
Wie wir kürzlich demonstrieren konnten, sind mechanische Eigenschaften der Haut stark davon abhängig, welche Zellen sich an der Grenze Dermis/Subkutis befinden und welche extrazelluläre Struktur diese Schicht hat.20, 21 Dermale Adipozyten, die sich dort befinden, haben eine interessante Eigenschaft, welche bis jetzt nicht bekannt war: Sie können deutlich mehr Kollagen als subkutane Adipozyten produzieren.2 Besonders starke Unterschiede wurden dabei bei Kollagen vom Typ 1, 5 und 6 (Hauptkollagentyp im adipositären Gewebe) festgestellt. DWAT ist ein Bestandteil der geschichteten Hautstruktur. Eine verstärkte Kollagenproduktion in dieser Schicht wird mechanische Eigenschaften der Haut also erheblich verändern. Eine Stimulation der Kollagenproduktion in dWAT kann unter anderem durch thermomechanischen Stress hervorgerufen werden, was die Wirkungen verschiedener Anti-Aging-Behandlungsmethoden endlich vernünftig erklärt. Gleichzeitig macht das die meisten energiebasierenden Behandlungsmethoden per se nicht optimal, weil sie nicht auf die dWAT-Schicht zielen und somit nur einen Bruchteil der verfügbaren Energie in dieser Schicht wirken lassen.
Entsprechend diesem Bild sollten lokale mechanische Eigenschaften der Haut im Rhythmus des HF-Zyklus schwanken und sich parallel zur Hautalterung kontinuierlich verändern. Sollten die HF in einem Hautareal teilweise synchronisiert werden, fallen diese Veränderungen nicht mehr mesoskopisch, sondern makroskopisch aus. Das wird nicht nur die Hautalterungsprozesse, sondern auch die Erscheinungsraten verschiedener Hauterkrankungen während chronologischer und UV-induzierter Hautalterung signifikant beeinflussen.
Wie soll es weitergehen?
Die neu entdeckten wiederkehrenden Zelltransformationen sowie Transdifferenzierungen der Adipozyten in Myofibroblasten in dWAT haben nicht nur eine theoretische Bedeutung, weil sie die Pathophysiologien verschiedener Hauterkrankungen signifikant verändern. Solche Prozesse sollten auch die Festlegung der Targets in zukünftigen Behandlungsstrategien stark beeinflussen. Es geht dabei um die Zellen, die in einer begrenzten Schicht innerhalb der Haut lokalisiert sind und somit nicht mit jeder Behandlungsmethode effektiv beeinflusst werden können. Wenn die Transformationen dermaler Adipozyten gezielt manipuliert werden können, sollte es möglich sein, bei verschiedenen Hauterkrankungen sowie bei der Hautalterung nicht nur neue effektive Therapieverfahren zu entwickeln, sondern auch präventiv zu intervenieren.
Es gibt bereits erste Behandlungsmethoden, die gerade auf diese Prozesse zielen. Es geht hierbei um die speziellen energiebasierten Methoden, die einen thermomechanischen Stress gezielt an der Grenze Dermis/Subkutis produzieren. Dazu gehören beispielweise das sehr hochfrequente Ultraschallverfahren mit einer Mischung von zwei oder drei Ultraschallwellen in einem Strahl22, 23 sowie ganz spezielle Radiofrequenzanwendungen, welche die Energie gezielt neben der Grenze Dermis/Subkutis konzentrieren.24, 25
Thermomechanischer Stress reduziert die Wirkung des TGF-β, der in die Zelltransformationen in dWAT signifikant involviert ist. Das führt unter anderem auch zur Regulation der Cav-1-Expression in Dermis und dWAT. Weil verschiedene Zellen auf Cav-1-Modulation biphasisch reagieren, kann ein und dieselbe Behandlungsmethode, je nach angewendeter Intensität und Wirkzeit, zu Cav-1-Stimulation oder Cav-1-Suppression eingesetzt werden.12,16–19 Somit können solche Behandlungsmethoden vielseitig therapeutisch sowie präventiv benutzt werden, es müssen aber deutlich strengere Anforderungen an die Behandlungsschemen gestellt werden.
Interessenkonflikt: Der Autor ist geschäftsführender Gesellschafter der Firma Wellcomet GmbH. Wellcomet GmbH hat die Vorbereitung dieses Artikels nicht beeinflusst.
Dieser Artikel wurde bereits in «Kosmetische Medizin» 2.20 veröffentlicht.
Autor:
Dr. rer. nat. habil. Ilja L. Kruglikov
Wellcomet GmbH
Karlsruhe
E-Mail: i.kruglikov@wellcomet.de
Literatur:
1 Kruglikov IL: Kosmet Med 2016; 37(2): 52-9 2 Zhang Z et al.: J Clin Invest 2019; 129(12): 5327-42 3 Wang QA et al.: Cell Metab 2018; 28: 282-8 4 Van Scott EJ, MacCardle RC: J Invest Dermatol 1956; 27(6): 405-29 5 Moon J et al.: Br J Dermatol 2019; 181(6): 1226-37 6 Kasumagic-Halilovic E et al.: Acta Dermatovenerol Croat 2010; 18(3): 146-50 7 Kruglikov IL, Scherer PE: Exp Dermatol 2016; 25(4): 258-62 8 Kruglikov IL et al.: Exp Dermatol 2016; 25(10): 812-3 9 Kruglikov IL, Wollina U: Psoriasis (Auckland, NZ) 2017; 7: 17-25 10 Kruglikov IL, Wollina U: J Biol Regul Homeost Agents 2018; 32(1): 159-61 11 Gao Y et al.: Commun Biol 2019; 2: 359 12 Kruglikov IL et al.: Ageing Res Rev 2019; 55: 100959 13 Zhang LJ et al.: Immunity 2019; 50(1): 121-36 14 Kruglikov IL, Scherer PE: Aging (Albany NY) 2016; 8: 1457-69 15 Liggins MC et al.: J Immunol 2019; 203: 1589-97 16 Kruglikov IL, Scherer PE: NPJ Aging Mech Dis 2019; 5(1): 4 17 Kruglikov IL, Scherer PE: NPJ Regen Med 2019; 4(1): 9 18 Kruglikov IL, Scherer PE: Exp Dermatol 2019; 29(2): 177-83 19 Kruglikov IL, Scherer PE: Int J Mol Sci 2020; 21(1): 80 20 Kruglikov IL, Scherer PE: Nutr Healthy Aging 2018; 4(4): 291-307 21 Kruglikov IL: Kosmet Med 2018; 39(3): 24-30 22 Kruglikov IL: Der Hautarzt 2015; 66(11): 829-33
23 Kruglikov IL: Ästhet Dermatol Kosmet 2018; 11(2): 27-31 24 Kruglikov IL: BioMed Res Int 2016; 1953203 25 Kruglikov IL: Kosmet Med 2016; 37(3): 94-103
Das könnte Sie auch interessieren:
«Was wir brauchen, ist Aufklärung auf allen Ebenen»
Aufgrund der Seltenheit des hereditären Angioödems (HAE) dauert es oft lange, bis Betroffene eine korrekte Diagnose erhalten. Die Schweizer HAE-Vereinigung setzt sich seit fast 25 Jahren ...
«Wir reden in der Medizin zu wenig über Sex»
Wer im Kontext von Haut und Sexualität primär an sexuell übertragbare Infektionen (STI) denkt, könnte überrascht werden. Denn das Thema Sexualität ist gesundheitlich aus ganz ...
Die menschliche Haut in der modernen Kunst
Dr. Ralph Ubl, Professor für neuere Kunstgeschichte an der Universität Basel, stellte sich der schwierigen Herausforderung, einem Raum voller erwartungsvoller Dermatologen das Organ Haut ...


