«Wearables»: diagnostics du rythme cardiaque et plus encore
Auteurs:
Diego Mannhart
Dr méd. Simon von Gunten
PD Dr méd. Patrick Badertscher
Universitäres Herzzentrum Basel Universitätsspital Basel
E-mail:
Appelés «wearables», les dispositifs de surveillance portatifs pour l’enregistrement et le traitement des signes vitaux sont également très populaires au sein de la population suisse. Les appareils électroniques de tous les jours sont passés en très peu de temps d’appareils d’information à des outils de mode de vie, de communication et de diagnostic médical, de sorte que les médecins sont de plus en plus confrontés au quotidien à des diagnostics et des données provenant de tels «wearables».
Au printemps 2023, 96% de la population suisse possédaient un smartphone et un bon tiers un «wearable».1 Le produit le plus connu et aussi le plus répandu en Suisse est sans doute l’Apple Watch, avec une part de marché de près de 40%.2 Depuis 2018 (4e génération), l’Apple Watch offre aux utilisateurs la possibilité d’enregistrer leur rythme cardiaque sous la forme d’un ECG à 1 dérivation, et a même reçu une autorisation de la Food and Drug Administration (FDA) aux États-Unis à cet effet.
Que sont les «wearables»?
Par «wearables», on entend une technologie, aujourd’hui principalement des systèmes informatiques, qui est intégrée dans les vêtements ou portée sur le corps et qui enregistre et, le cas échéant, traite des données relatives à l’utilisateur. En 1961, Norman Holter, un biophysicien américain, a non seulement posé la première pierre de l’outil de diagnostic du rythme cardiaque portatif avec sa publication «New method for heart studies» sur l’enregistreur ECG portatif qui porte son nom, mais il a également créé un «wearable» d’une certaine manière, même si c’est au sens le plus large.3 Le terme «wearable», tel que nous l’utilisons aujourd’hui, englobe toutes les formes de technologie conçues pour être portées confortablement au quotidien et qui enregistrent ainsi en continu des données sur l’utilisateur et son environnement.
Par rapport aux dispositifs de surveillance conventionnels utilisés, tels que les tensiomètres portatifs, les thermomètres médicaux, les capteurs/patchs de glycémie, les holter ECG ou les enregistreurs d’événements implantables («loop recorders»), les «wearables» destinés au grand public sont moins chers pour les utilisateurs finaux, sont plus agréables à porter et favorisent également la motivation personnelle grâce au bénéfice supposé ainsi qu’à l’évaluation des données collectées sur sa propre condition physique ou son entraînement. On peut s’attendre à ce qu’ils soient à l’avenir largement répandus dans la population, comme les téléphones portables. Les montres intelligentes ont depuis longtemps dépassé les montres-bracelets suisses traditionnelles en termes de ventes.6
Les montres, en particulier, sont très populaires au sein de la population, car elles sont discrètes, confortables, et peuvent être portées et utilisées dans la plupart des situations quotidiennes, sans restriction ni stigmatisation. Par exemple, un ECG à 1 dérivation peut être enregistré en 30 secondes en touchant simplement la couronne d’une montre intelligente avec l’index. Elles disposent d’algorithmes automatisés capables de détecter la fibrillation auriculaire (FA). Les «wearables» font déjà partie intégrante de notre quotidien, si bien que la médecine mise elle aussi de plus en plus sur la pose d’un diagnostic par le biais de wearables; les directives ont même été adaptées en conséquence. Dans celles de la Société européenne de cardiologie (ESC) sur le diagnostic et le traitement de la fibrillation auriculaire, publiées en 2020, le diagnostic a par exemple été complété par des ECG à 1 dérivation enregistrés par des «wearables».4
Les «wearables» en cardiologie
Depuis le premier Holter ECG en 1961, les «wearables» pour le diagnostic du rythme cardiaque se sont développés de manière fulgurante, en particulier au cours des trois dernières décennies: le premier stimulateur cardiaque avec traitement numérique du signal a été implanté au début des années 19907 et la première montre-bracelet avec ECG à 1 dérivation pour l’enregistrement d’événements individuels date de 1994. Le KardiaMobile, qui couple un ECG à 1 dérivation à un smartphone, permettant ainsi d’établir et d’envoyer des enregistrements en temps réel de son propre rythme cardiaque, a été lancé sur le marché en 2013.8 Équipées de leurs propres logiciels et processeurs ainsi que d’applications pour l’évaluation des enregistrements du rythme cardiaque, les montres intelligentes ont permis d’améliorer considérablement l’enregistrement et surtout l’analyse du rythme cardiaque, possibles à tout moment, à partir de 2013. À partir de 2018, il a été possible d’acheter pour la première fois sur le marché ordinaire des «wearables» qui enregistrent le rythme cardiaque et l’analysent immédiatement — en quelques secondes — grâce à des algorithmes intégrés. Les «wearables» sélectionnés indépendamment d’une indication médicale ont été approuvés par la FDA, ont obtenu le marquage CE et ainsi le statut de dispositifs et d’applications utilisables à des fins médicales. Depuis lors, les algorithmes et l’enregistrement n’ont cessé d’être améliorés; l’intelligence artificielle a été testée pour une analyse supplémentaire et les opportunités, les limites et les contraintes de la technologie ont été décrites dans de nombreuses études.
Possibilité d’auto-diagnostic
Les publicités pour les montres intelligentes font activement la promotion du fait que les utilisateurs finaux peuvent enregistrer un ECG à tout moment, rapidement et facilement. Alors qu’il était auparavant uniquement possible de clarifier un éventuel trouble du rythme cardiaque en consultant un médecin, ce qui impliquait une anamnèse détaillée et un examen physique, la médecine connaît désormais un changement de paradigme: le diagnostic ne doit plus être initié par les professionnels de la santé, mais les patients les confrontent aujourd’hui souvent à un auto-diagnostic. Avec 31% de la population suisse utilisant des «wearables» (à titre de comparaison: 78,1% de la population mondiale et 96% de la population suisse possèdent un smartphone), une contrainte supplémentaire pour le système de santé due à ce diagnostic «consumer-initiated» est prévisible dans un avenir proche, voire est déjà une réalité dans certains pays.1
Possibilités d’application pour le diagnostic du rythme cardiaque
Fibrillation auriculaire
Les fabricants de «wearables» visent à obtenir l’approbation de la FDA et/ou le marquage CE pour le diagnostic de la fibrillation auriculaire (FA). Et pour cause: le risque d’accident vasculaire cérébral, la complication la plus fréquente de ce trouble du rythme cardiaque, peut être réduit par l’anticoagulation orale, à condition qu’il soit détecté avant sa survenue, car une FA subclinique pourrait être détectée dans les 30 jours précédant l’événement dans environ 30% des AVC.9
Depuis la publication des directives de l’ESC de 2020, il est possible de confirmer le diagnostic de fibrillation auriculaire par un ECG à 1 dérivation enregistré pendant au moins 30 secondes, en plus de l’ECG à 12 dérivations conventionnel. Ces directives recommandent également un dépistage opportuniste de la FA chez les patients souffrant d’hypertension (recommandation de classe I). En outre, elles envisagent le dépistage de la FA chez les patients atteints d’un syndrome d’apnées du sommeil (recommandation de classe IIa).4
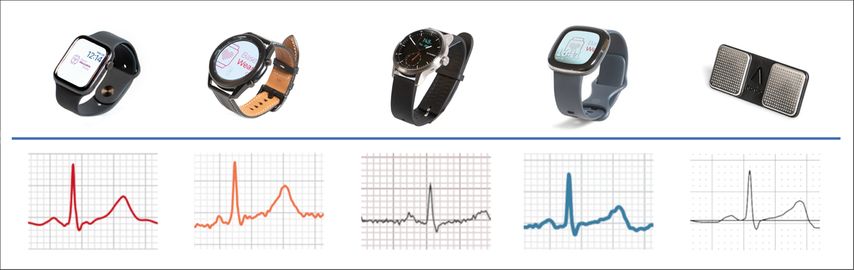
Ce qui, dans le cas d’une FA paroxystique, est une option idéale pour les patients afin d’enregistrer un diagnostic autrement difficile à établir/vérifier, peut être diagnostiqué à moindre coût et avec une sensibilité relativement élevée grâce aux «wearables», et ce relativement indépendamment des dispositifs utilisés, qui sont de plus en plus nombreux à obtenir l’approbation de la FDA ou le marquage CE.10 La Figure 1 fournit une vue d’ensemble.
Fig. 1: Vue d’ensemble de quelques montres intelligentes avec ECG à 1 dérivation et détection automatisée de la fibrillation auriculaire disponibles en Suisse
Flutter atrial
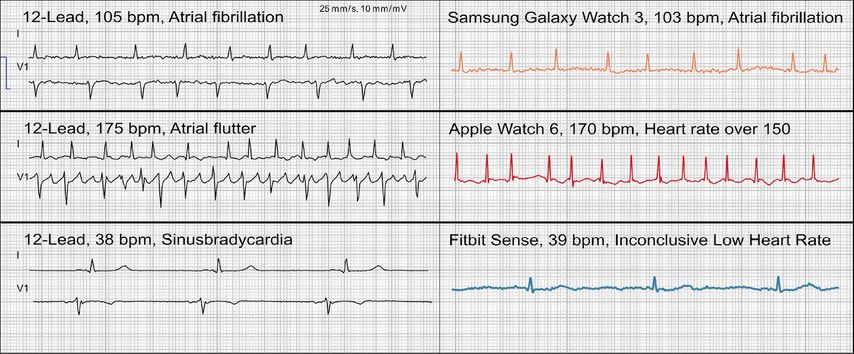
L’enregistrement d’un flutter atrial ne constitue pas un défi pour les «wearables», contrairement à l’interprétation automatisée ou manuelle. Les montres intelligentes proposent aux utilisateurs un enregistrement pendant 30 secondes d’une dérivation d’Einthoven DI dans le cadre d’une utilisation conventionnelle. Avec une amplitude éventuellement faible, le flutter atrial peut être mal diagnostiqué dans cette dérivation. Il est possible de pallier cette situation en modifiant le mode d’enregistrement: en positionnant le «wearable» sur la cheville gauche ou dans la région inguinale gauche (c’est-à-dire la position de l’électrode F dans l’ECG à 12 dérivations), une dérivation d’Einthoven DII peut être générée.11 L’enregistrement ne peut certes pas être diagnostiqué par l’algorithme automatisé (celui-ci ne propose pas le flutter atrial comme diagnostic possible), mais il peut l’être relativement bien par un œil expérimenté. Les opportunités et les limites du diagnostic d’un trouble du rythme cardiaque sont illustrées par quelques exemples dans la Figure 2.
Fig. 2: Les opportunités et les limites du diagnostic du rythme cardiaque sont illustrées par quelques examples de cas. On observe à gauche un ECG à 12 dérivations (test de référence) et à droite un ECG à 1 dérivation enregistré simultanément. Dans le premier exemple ci-dessus, la montre détecte correctement la fibrillation auriculaire (FA). Dans le deuxième exemple, on constate qu’il n’est pas possible pour la montre de détecter les flutters atriaux. Le troisième exemple illustre le fait que la plupart des montres atteignent leurs limites lorsque les fréquences cardiaques sont trop élevées ou (comme ici) trop basses. Le dernier exemple constitue un résultat faux négatif. La sensibilité et la spécificité de la montre pour la détection de la FA sont élevées, mais ne sont pas de 100%
Tachycardies paroxystiques supraventriculaires: l’augmentation du rythme cardiaque
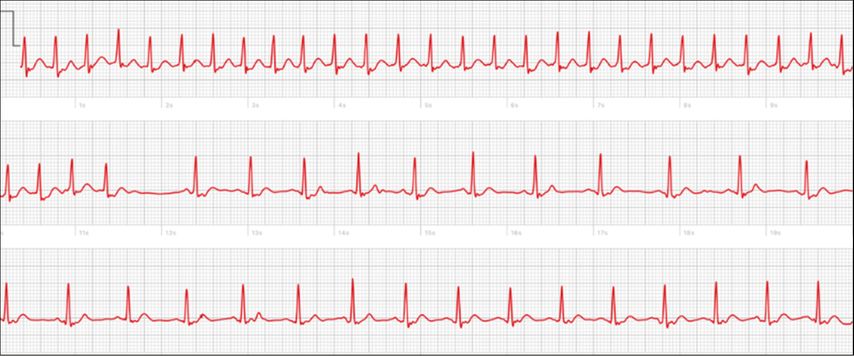
«Soudain, mon cœur s’est emballé et j’ai pris peur.» Une telle déclaration est souvent une raison suffisante pour consulter un médecin afin d’obtenir des explications, bien que l’ECG enregistré par la suite ne montre souvent aucun résultat probant malgré des symptômes subjectifs impressionnants. Dans ce cas, les «wearables» offrent une très grande opportunité. C’est surtout chez la jeune génération, les «Digital Natives», que se présente l’opportunité de détecter des troubles du rythme cardiaque autrement très difficiles à détecter et qui, jusqu’à présent, pouvaient souvent uniquement l’être en faisant coïncider le moment approprié et les outils de diagnostic disponibles. Il s’agit par exemple des tachycardies paroxystiques supraventriculaires, dont 60% sont dues à des tachycardies par réentrée nodale auriculo-ventriculaire (AVNRT), 30% à des tachycardies par réentrée auriculo-ventriculaire (AVRT) et 10% à des tachycardies auriculaires.12 Les nouvelles possibilités permettent de documenter une tachycardie d’apparition soudaine dans les secondes qui suivent le début des symptômes, même si elle ne dure que quelques minutes. Les «wearables» permettent de pallier cette lacune diagnostique avec succès.13 La Figure 3 présente un exemple de cas.
Fig. 3: Enregistrement réussi d’une tachycardie à complexes étroits, qui se termine même au cours de l’évolution. Si les personnes concernées se plaignent d’une tachycardie d’apparition soudaine, cette tachycardie peut être documentée en quelques secondes, même si elle ne dure que peu de temps (comme ici). Les «wearables» permettent de pallier cette lacune diagnostique avec succès
Intervalle QTc
En tant que «Multilead-Device», le Kardia6L est le seul dispositif de ce type à avoir obtenu l’approbation de la FDA pour la mesure de l’intervalle QT.14 La Scanwatch de Withings est le seul «wearable» à proposer des enregistrements ECG à 1 dérivation avec mesure intégrée de l’intervalle QT dans l’algorithme. Cela permet de détecter les syndromes du QT long (LQTS), qui peuvent entraîner des arythmies ventriculaires (torsades de pointes) ou une mort subite cardiaque (SCD).15,16 Ils sont congénitaux ou acquis. Les «wearables» permettent de détecter un LQTS qui est par exemple dû de manière transitoire à un trouble électrolytique17 ou à la prise de médicaments allongeant l’intervalle QT.18 Dans ce dernier cas en particulier, il est conseillé de surveiller l’intervalle et, selon le résultat, d’adapter le traitement médicamenteux.19 Les «wearables» joueront un rôle important à l’avenir.20 Il n’existe toutefois pas encore de possibilités suffisantes de surveillance de l’intervalle QT par le biais d’un ECG à 1 dérivation et la plupart des ECG à 1 dérivation enregistrés par les «wearables» nécessitent une mesure autonome de l’intervalle QT. L’ECG à 12 dérivations est à ce jour la seule stratégie de surveillance fiable permettant d’enregistrer la dispersion de l’intervalle QT et d’éviter une surestimation ou une sous-estimation de l’intervalle QT, comme cela pourrait se produire avec la surveillance par le biais d’un ECG à 1 dérivation. Dans l’ensemble, il subsiste une dépendance importante vis-à-vis de la personne réalisant l’examen.21
Ce que nous pouvons attendre des «wearables» à l’avenir
Les «wearables» offrent un énorme potentiel qui occupe actuellement beaucoup les chercheurs du monde entier. Outre la prévention et la détection des chutes, la prise de médicaments, la surveillance du sommeil et les études sur l’activité et le mouvement, aucun autre domaine que le diagnostic du rythme cardiaque avec des «wearables» ne fait actuellement l’objet d’autant d’études.22
Tout le monde se pose probablement cette question dans ce contexte: peut-on diagnostiquer un infarctus du myocarde avec un «wearable»? En bref, cela est théoriquement possible et a déjà été mis en œuvre dans des études ainsi que des compte-rendus de cas. En plaçant habilement la montre intelligente aux points de référence de l’ECG à 12 dérivations conventionnel, il est possible de documenter des enregistrements comparables,23–25 bien que l’enregistrement simultané de plus d’une dérivation ne soit pas réalisable sur le plan technique avec les montres intelligentes traditionnelles. Des dispositifs comme Kardia6L, susmentionné, offrent plus de deux points de contact et donc la possibilité de documenter simultanément plus d’une dérivation,14 ce qui a permis de documenter des troubles du rythme cardiaque tels que le syndrome de Brugada, les cardiomyopathies hypertrophiques et la dysplasie ventriculaire droite arythmogène (ARVC/D).16 De tels enregistrements expérimentaux sont jusqu’à présent facilement réalisables dans le cadre d’études, mais nécessitent une instruction précise, une surveillance de l’enregistrement ainsi que, le cas échéant, l’aide de tiers pour garantir une qualité suffisante.16
Intelligence artificielle et «wearables»
Un défi auquel les médecins de premier recours et les cardiologues sont déjà confrontés aujourd’hui est l’augmentation constante du nombre de consultations à l’initiative du patient. Environ 17 à 26% des ECG à 1 dérivation interprétés par l’algorithme automatisé ne sont pas concluants.10 L’algorithme n’est pas en mesure de donner une interprétation suffisante sur la base des paramètres enregistrés. Il peut y avoir plusieurs raisons à cela, qui sont expliquées dans la section «Limites et opportunités». Les résultats non concluants sont toutefois souvent une source d’inquiétude pour les utilisateurs finaux. Afin de ne pas devoir faire appel à un spécialiste pour chacun des ECG dont l’interprétation n’est pas automatisée, l’intelligence artificielle offre une possibilité d’augmenter la probabilité d’examen préliminaire et d’éviter au patient d’effectuer un nouvel enregistrement ou de s’inquiéter en cas de résultat initialement incertain. Pour les professionnels de la santé, l’intégration d’un algorithme d’intelligence artificielle implique une réduction du nombre de résultats non concluants et donc éventuellement des consultations à l’initiative du patient en découlant, tout en conservant la précision de l’interprétation automatisée.26 La raison pour laquelle de tels algorithmes d’intelligence artificielle ne sont pas déjà intégrés dans chaque application pour smartphone ou chaque montre intelligente réside dans les capacités limitées de ces appareils, et cela ne pourra peut-être pas être mis en œuvre dans un avenir proche. En outre, de tels algorithmes ne sont pas encore accessibles aux utilisateurs finaux et, le cas échéant, sont uniquement accessibles aux professionnels de la santé dans le cadre d’études ou d’accords spéciaux. Les prestataires tiers qui proposent un service d’interprétation d’ECG à 1 dérivation par un personnel spécialisé offrent une solution appropriée pour les médecins de premier recours afin de gagner du temps ainsi que pour les patients en cas d’incertitude ou d’absence d’interlocuteur direct.
Limites et opportunités
L’une des limites du diagnostic du rythme cardiaque par le biais d’un ECG à 1 dérivation est l’enregistrement obligatoirement actif par l’utilisateur, c’est-à-dire qu’un contact doit être établi avec le «wearable» par un mouvement conscient. Un enregistrement pendant le sommeil n’est donc pas possible. La détection de la FA par photopléthysmographie (PPG) constitue une alternative à celle par ECG à 1 dérivation. Comme pour l’oxymétrie de pouls, une montre intelligente ou un bracelet, par exemple, mesure en continu la variabilité de battement à battement et tente ainsi de détecter la FA par le biais des irrégularités. L’Apple Heart Study,27 la Fitbit Heart Study28 et la Huawei Study29 sont des études renommées à grande échelle qui visaient à représenter une large population afin de détecter la FA par photopléthysmographie. Outre la faible capacité de la batterie et la nécessité d’une confirmation du diagnostic par un ECG à 1 dérivation, les artefacts de mouvement constituent les limites de cette technologie, laquelle offre cependant un énorme potentiel par rapport à une surveillance en continu des patients.
Cet enregistrement obligatoirement autonome est à la fois la plus grande opportunité et l’une des principales limites de la technologie: les artefacts, les enregistrements interrompus et la documentation imprécise des symptômes compliquent l’interprétation et la pose du diagnostic, en plus du fait qu’une seule dérivation par enregistrement ne soit possible. De plus, les algorithmes des fabricants diffèrent non seulement dans la représentation de l’enregistrement graphique, mais aussi dans les limites de mesure. Certains «wearables» n’analysent plus une fréquence cardiaque supérieure à 50 à 120 battements par minute. De même, les extrasystoles, les artefacts de mouvement, le flutter atrial ou une brève interruption de contact sont autant de raisons pour lesquelles les mesures ont été interrompues ou les enregistrements considérés comme non concluants.
Utilisés pour l’instant dans certains domaines médicaux, les «wearables» en tant qu’outils de diagnostic nous offrent déjà aujourd’hui, mais nous offriront aussi dans un avenir proche et lointain, la possibilité d’obtenir des enregistrements rapides, d’augmenter la probabilité d’examen préliminaire des résultats et de réduire ainsi le nombre de consultations, le cas échéant. Ils joueront un rôle important en médecine à l’avenir et la feront progressivement évoluer.
Littérature:
1 Most used consumer electronics in Switzerland 2023. Statista. https://www.statista.com/forecasts/1348648/most-used-consumer-electronics-in-switzerland ; dernier accès 1.9.2023 2 Most used eHealth tracker/ smart watches by brand in Switzerland 2023. Statista. https://www.statista.com/forecasts/1348520/most-used-ehealth-tracker-smart-watches-by-brand-in-switzerland ; dernier accès 1.9.2023 3 Holter NJ: Science 1961; 134: 1214-20 4 Hindricks G et al.: Eur Heart J 2021; 42: 373-498 5 Yetisen AK et al.: Adv Mater 2018; 30: e1706910 6 Apple Watch vs Swiss watch industry shipments 2019. Statista https://www.statista.com/statistics/1194565/global-apple-watch-vs-swiss-watch-industry-shipments/ ; dernier accès 1.9.2023 7 Aquilina O: Images Paediatr Cardiol 2006; 8: 17-81 8 Saxon LA: J Cardiovasc Electrophysiol 2013; 24: 480-3 9 Mahajan R et al.: Eur Heart J 2018; 39: 1407-15 10 Mannhart D et al.: JACC Clin Electrophysiol 2023; 9: 232-42 11 Ahmed AS et al.: Hear Case Rep 2020; 6: 808-9 12 Trohman RG: Crit Care Med 2000; 28: 129-35 13 Siddeek H et al.: Ann Noninvasive Electrocardiol 2020; 25: 12742 14 Azram M et al.: Eur Heart J Digit Health 2021; 2: 643-8 15 Lane JCE et al.: Lancet Rheumatol 2020; 2: 698-711 16 Nasarre M et al.: EP Eur 2021; 24: 406-12 17 Benoit SR et al.: Eur J Cardiovasc Prev Rehabil 2005; 12: 363-8 18 Viskin S et al.: Prog Cardiovasc Dis 2003; 45: 415-27 19 Roden DM et al.: Heart Rhythm 2020; 17: 231-2 20 Mannhart D et al.: Front Cardiovasc Med 2022; 9: 906079 21 Viskin S et al.: Heart Rhythm 2005; 2: 569-74 22 Dagher L et al.: Heart Rhythm 2020; 17: 889-95 23 Samol A et al.: Sensors 2019; 19: 2894 24 Samol A et al.: Sensors 2019; 19: 4377 25 Spaccarotella CAM et al.: JAMA Cardiol 2020; 5: 1176-80 26 Mannhart D et al.: Arch Cardiovasc Dis 2023; 116: 249-57 27 Perez MV et al.; Apple Heart Study Investigators: N Engl J Med. 2019; 381: 1909-17 28 Lubitz SA et al.: Circulation 2022; 146: 1415-24 29 Guo Y et al.; MAFA II Investigators: J Am Coll Cardiol 2019; 74: 2365-75
Das könnte Sie auch interessieren:
L’asthme et le rythme circadien
Le rythme circadien ne joue pas seulement un rôle important dans le sommeil, il a également une influence considérable sur les crises d’asthme et la fonction pulmonaire. Le ciblage ...
Technologies avancées et existantes dans la gestion du diabète
Même si le terme «traitement» est compris dans le nom de la conférence, la 18th International Conference on Advanced Technologies & Treatments for Diabetes (ATTD) constitue le rendez- ...
Les défis du diabète de type 1
Dans le cas du diabète de type 1, surtout s’il ne se déclare qu’à l’âge adulte, la pose du diagnostic peut déjà constituer un défi. Le risque d’hypoglycémie, qu’il faut minimiser, et le ...