
Eisenassoziierte Störungen im Fokus
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Am 17. Mai 2018 öffnete in Zürich zum elften Mal die Iron Academy, unter der Leitung von Prof. Dr. med. Edouard Battegay, Direktor der Klinik und Poliklinik für Innere Medizin am Universitätsspital Zürich, und Dr. med. Jeroen S. Goede, Chefarzt Hämatologie, Kantonsspital Winterthur, ihre Tore. Eisen als wichtiges Element der Energiebereitstellung und der neuronalen Aktivität, Erkenntnisse über den Eisenverlust während der Menstruation, Eisenmangel als Risikofaktor für das Restless-Legs-Syndrom und die Bedeutung von Eisen bei Herzinsuffizienz: Diese Themen wurden an der diesjährigen Iron Academy von namhaften Schweizer Referenten erläutert und anschliessend in Workshops engagiert diskutiert.
Eisen: wichtig für zelluläre Energiebereitstellung Zunächst sprach Dr. Diego Moretti von der ETH Zürich über die physiologische Funktion des Eisens. Nach Angaben der Weltgesundheitsorganisation WHO leiden weltweit rund 30 % der Kinder und der Frauen im gebärfähigen Alter an Anämie. Etwa 50–60 % davon sind durch Eisenmangel bedingt.1
Der Eisenstoffwechsel wird durch zwei miteinander verbundene Systeme gesteuert: Die übergeordnete systemische Regulation basiert auf dem Peptid Hepcidin und dem Membrantransportprotein Ferroportin. Das zweite System arbeitet auf der Zellebene, wo eisenregulierende Proteine (IRP) die Expression von Genen steuern, die an der Kontrolle des intrazellulären Eisenstoffwechsels beteiligt sind. Dieser Metabolismus wird direkt vom zellulären Eisen und von der zellulären Sauerstoffkonzentration gesteuert, während Hepcidin von verschiedenen Faktoren wie Hypoxie, Eisenmangel, erythropoietischem Stress, Entzündungen und Hormonen beeinflusst wird.2 «Bei Eisenmangel sorgen die beiden Systeme durch eine Verlangsamung der Erythropoiese dafür, dass Gewebe, wie Muskel- und Parenchymzellen, die zur Aufrechterhaltung ihrer Funktion Eisen benötigen, weiterhin mit dem notwendigen Element versorgt werden», sagte Dr. Moretti. «Eisen hat nämlich auch zahlreiche nicht hämatologische Funktionen.» Der Organismus benötigt Eisen beispielsweise für die Synthese der DNA, deren Replikation, Reparation und Translation, für die Synthese zahlreicher Enzyme, die wichtig sind für das Immunsystem oder, wie die Cytochrom-P450-Familie, für die Entgiftung. Eisen ist auch essenziell für die Neurogenese, die Hirnentwicklung und die Myelinisierung sowie die Synthese verschiedener Neurotransmitter.3 Nicht zuletzt ist Eisen als effizienter Elektronentransporter auch ein wesentlicher Co-Faktor in der Produktion von ATP in den Mitochondrien (Atmungskette) und damit für die zelluläre Energiebereitstellung.4 Es erstaunt deshalb nicht, dass ein Eisenmangel auch ohne Anämie die Leistungsfähigkeit von Skelett- und Herzmuskelzellen beeinträchtigen kann. In einem Mausmodell wurde gezeigt, dass ein isolierter Eisenmangel in den Kardiomyozyten zu einer Beeinträchtigung der Mitochondrien und in der Folge zur raschen Entwicklung einer kardialen Hypertrophie und zum Herztod führt.5 Dies bestätigt, dass Eisen für das Herz essenziell ist, zeigt aber auch, dass für die Herzmuskelzellen ständig genügend Eisen zur Verfügung stehen muss.
Menstruation: durchschnittlich 40mg Eisenverlust
«Menstruation: Wann ist der Blutverlust noch normal?» – diese Frage beantwortete Dr. med. Anna Raggi Nüssli vom Zentrum für Kinderwunschbehandlung, Frauen- und Männermedizin, Olten. Die Fédération Internationale de Gynécologie et d‘Obstétrique (FIGO) hat 2012 aktualisierte Normwerte für die Menstruationsblutung veröffentlicht. Danach gelten eine Frequenz von 24 bis 38 Tagen mit einer Blutungsdauer von 4,5 bis 8 Tagen und einem Blutvolumen von durchschnittlich 30ml (5–80ml) als normal.6 «Für die Frauen ist es aber schwer, das Blutvolumen abzuschätzen. Fragen Sie deshalb, wie viele Vorlagen oder Tampons sie pro Zyklus verbrauchen und wie oft sie diese wechseln müssen», riet die Gynäkologin. Es sollten nicht mehr als 21 Vorlagen oder Tampons pro Zyklus verbraucht werden, die Wechselintervalle nicht kürzer als drei bis vier Stunden sein und nur selten nächtliche Wechsel nötig werden. Fragen nach Blutkoagula und deren Grösse sowie nach verstärkter Müdigkeit liefern weitere Hinweise.6
Pro Milliliter Blutverlust gehen 0,5mg Eisen verloren, pro normal starke Menstruation also bis zu 40mg. Verliert eine Frau aufgrund einer stärkeren Menstruation oder anderer abnormer uteriner Blutungen mehr Eisen, als sie durch die Ernährung kompensieren kann, entwickelt sich zwangsläufig eine Eisenmangelanämie. «Bei symptomatischen Patientinnen mit einem Hb unter 12g/dl und einem Ferritin von 30–50μg/l oder weniger ist eine Substitution angezeigt», sagte Dr. Raggi. Die Eisensubstitution erfolgt zunächst oral: 100–300mg/d bei Eisenmangel mit Anämie, resp. 50–100mg/d bei Eisenmangel ohne Anämie. Erzielt dies nicht die gewünschte Wirkung, empfiehlt Dr. Raggi, 500 bis 1000mg Eisen intravenös zu verabreichen.
Eisenmangel erhöht das Risiko für Restless-Legs-Syndrom
Die Neurologin Dr. med. Sigrid von Manitius, Kantonsspital St. Gallen, leitete den Workshop, in dem aktuelle Therapieempfehlungen für das Restless-Legs-Syndrom (RLS) diskutiert wurden. Das RLS ist charakterisiert durch einen Bewegungsdrang der Extremitäten, oft assoziiert mit unangenehmen, tiefsitzenden, oft schwer zu beschreibenden Gefühlsstörungen, die nicht durch andere medizinische Ursachen oder spezifisches Verhalten erklärt werden können. Verstärkt wird dieser Drang durch Ruhe, während Bewegung vorübergehend Erleichterung schafft. Typisch ist, dass die Beschwerden abends und nachts schlimmer werden und rund 75 % der Betroffenen daher an Ein- und Durchschlafstörungen leiden. Die klinische Diagnose wird mithilfe von Labor- und elektrophysiologischen Untersuchungen gesichert. Bei atypischen Verläufen oder bei Kindern kann eine Polysomnografie im Schlaflabor diagnostische Hinweise liefern.7 Etwa 60–75 % der RLS-Patienten sprechen zu Beginn auf L-Dopa an, was auch diagnostisch eingesetzt werden kann8
Obwohl das RLS etwa 5 % der Bevölkerung betrifft, ist die Pathophysiologie nicht genau bekannt. Vermutet wird die Beteiligung der dopaminergen und opioiden Neurotransmittersysteme. Auch eine familiäre Veranlagung scheint vorzuliegen, dennoch wurde bisher kein entsprechendes Gen identifiziert. Bekannt ist, dass Eisenmangel das Risiko für RLS erhöht, denn latenter Eisenmangel im Gehirn stört die dopaminerge Funktion. Die Folge ist eine Übererregbarkeit spinaler Bahnen. Vor allem sekundäre RLS-Formen werden durch Eisenmangel und Stoffwechselstörungen verursacht.9 «Bei RLS-Patienten sollte deshalb immer auch ein Blutbild gemacht sowie Ferritin, Transferrinstättigung und Serumeisen bestimmt werden», riet Dr. von Manitius.
Die Indikation zur Behandlung der RLS richtet sich nach dem subjektiven Leidensdruck. «Bei manchen Patienten hilft bereits eine gute Schlafhygiene mit regelmässigen Schlafenszeiten, regelmässige körperliche Aktivität oder das Vermeiden bestimmter Nahrungsmittel wie Kaffee, Alkohol oder Schokolade», so die Neurologin. «Ausserdem sollte daran gedacht werden, dass gewisse Medikamente, wie etwa Neuroleptika, Antidepressiva oder Betablocker, ein sekundäres RLS auslösen können.»10 Bei starken Symptomen wird in erster Linie eine dopaminerge Therapie empfohlen. Dabei gilt jedoch: so viel wie nötig und so wenig wie möglich, da diese Medikamente auch zu einer Augmentation der Symptome führen können.11
In Bezug auf die Eisentherapie bei RLS empfehlen die aktuellen Leitlinien die intravenöse Gabe von 1000mg Eisencarboxymaltose (Ferinject®) bei Erwachsenen mit moderatem bis schwerem RLS und einem Serum-Ferritinspiegel ≤ 100μg/l.12 Liegt der Ferritinspiegel > 300μg/l oder beträgt die Transferrinsättigung > 45 %, sollte keine intravenöses Eisen verabreicht werden. Orales Eisen ist gemäss Leitlinien möglicherweise wirksam bei einem Ferritinspiegel ≤ 75μg/l, aber wahrscheinlich nicht effektiv bei einem Ferritinspiegel > 75μg/l.12
Herzinsuffizienz: Eisenmangel beeinträchtigt Energiebereitstellung in Herzmuskelzellen
PD Dr. med. Thomas Dieterle, Kardiologe am Kantonsspital Baselland, Liestal, führte in den Workshop zu neuen Erkenntnissen bei der Herzinsuffizienz ein. Die aktuellen europäischen Leitlinien definieren drei Formen der Herzinsuffizienz («heart failure», HF): HF mit eingeschränkter Pumpfunktion (HFrEF; LVEF: < 40 %), HF mit erhaltener Pumpfunktion (HFpEF; LVEF: ≥ 50 %) und – neu seit 2016 – HF mit mittelgradig eingeschränkter Pumpfunktion (HFmrEF; LVEF: 40– 49 %).13 Für Letztere gibt es bislang noch keine Therapieempfehlungen.
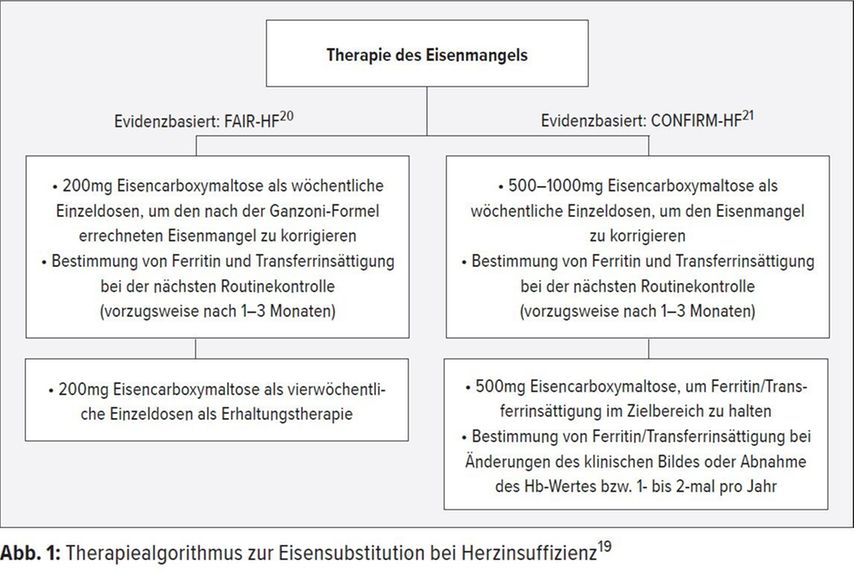
Die Diagnose basiert auf Anamnese, körperlicher Untersuchung, EKG, Labor einschliesslich der Marker «brain natriuretic peptide» (BNP) und N-terminales pro-BNP (NT-proBNP) sowie der Echokardiografie. Das Röntgen des Thoraxes ist dagegen nicht obligat, kann aber dem Ausschluss anderer Krankheiten dienen.13 «In der Therapie der HFrEF hat sich nicht viel verändert», sagte der Kardiologe. Basis bleiben ACE-Hemmer, Angiotensin-Rezeptor- Blocker, Betablocker und Mineralokortikoid- Rezeptor-Antagonisten sowie der Angiotensin-Rezeptor-Neprilysin-Inhibitor Sacubitril/Valsartan. Ergänzend werden Diuretika, Nitrate und Digoxin eingesetzt.13 «Neu ist hingegen die Empfehlung einer Eisensubstitution als symptomatischer Therapie, da inzwischen erwiesen ist, dass mehr als die Hälfte der Herzinsuffizienzpatienten an Eisenmangel leiden»,13, 14 betonte PD Dieterle. Die wichtigste Ursache dafür ist die mit der Herzinsuffizienz einhergehende chronische systemische Entzündung. Durch die Ausschüttung von proinflammatorischen Peptiden kommt es zur vermehrten Sekretion von Hepcidin, was eine geringere Eisenabsorption zur Folge hat. Eine andere Ursache ist die Therapie mit Gerinnungshemmern, die zu einem chronischen subklinischen Blutverlust führt.15 Der Eisenmangel wirkt sich nicht nur auf den Sauerstofftransport aus, sondern auch auf die mitochondriale Atmungskette in den Skelett- und Herzmuskelzellen.16 Die Folgen sind verminderte Leistungsfähigkeit, eingeschränkte Lebensqualität und höhere Mortalität/Hospitalisationraten.15 Zwei Metaanalysen zeigen, dass die Eisensubstitution den Zustand der Herzinsuffizienzpatienten und den Verlauf der Erkrankung signifikant verbessert: Das Risiko für Tod und Hospitalisation wird um bis zu 56 % reduziert, die Hospitalisationsraten sinken um bis zu 82 %, die Belastbarkeit (6-Minuten-Gehtest), die Lebensqualität und die NYHA-Klasse verbessern sich.17, 18 Daher empfehlen die aktuellen Leitlinien, auch bei allen Patienten mit HFrEF den Eisenstatus zu erheben und im Falle eines Mangels (Serumferritin < 100μg/l oder Ferritin 100–299μg/l und Transferrinsättigung < 20 %) Eisen intravenös zu substituieren (Level A; Abb. 1).13, 19
Quelle: Iron Academy «Eisenassoziierte Störungen?», 17. Mai 2018, Zürich
Literatur
1 WHO: The global prevalence of anaemia in 2011. Stand 2015 (www.who.int/nutrition/publications/micronutrients/ global_prevalence_anaemia_2011/en) 2 Hentze MW et al.: Two to tango: regulation of mammalian iron metabolism. Cell 2010; 142: 24-38 3 Radlowski EC, Johnson RW: Perinatal iron deficiency and neurocognitive development. Front Hum Neurosci 2013; 7: 585 4 Musallam KM, Taher AT: Iron deficiency beyond erythropoiesis: should we be concerned? Curr Med Res Opin 2018; 34: 81-93 5 Xu W et al.: Lethal cardiomyopathy in mice lacking transferrin receptor in the heart. Cell Rep 2015; 13: 533-45 6 Munro MG: Classification of menstrual bleeding disorders. Rev Endocr Metab Disord 2012; 13: 225-34 7 Allen RP et al.: Restless legs syndrome/Willis-Ekbom disease diagnostic criteria: updated International Restless Legs Syndrome Study Group (IRLSSG) consensus criteria--history, rationale, description, and significance. Sleep Med 2014; 15: 860-73 8 Stiasny-Kolster K et al.: Validation of the “L-DOPA test” for diagnosis of restless legs syndrome. Mov Disord 2006; 21: 1333-9 9 Garcia-Borreguero D, Williams AM: An update on restless legs syndrome (Willis-Ekbom disease): clinical features, pathogenesis and treatment. Curr Opin Neurol 2014; 27: 493-501 10 Cohrs S et al.: [Restless legs syndrome, periodic limb movements, and psychopharmacology]. Nervenarzt 2008; 79: 1263-4 11 Mackie S, Winkelman JW: Long-term treatment of restless legs syndrome (RLS): an approach to management of worsening symptoms, loss of efficacy, and augmentation. CNS Drugs 2015; 29: 351-7 12 Allen RP et al.: Evidence-based and consensus clinical practice guidelines for the iron treatment of restless legs syndrome/Willis-Ekbom disease in adults and children: an IRLSSG task force report. Sleep Med 2018; 41: 27-44 13 Ponikowski P et al.: 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2016; 37: 2129-200 14 Nanas JN et al.: Etiology of anemia in patients with advanced heart failure. J Am Coll Cardiol 2006; 48: 2485-9 15 Klip IT et al.: Iron deficiency in chronic heart failure: an international pooled analysis. Am Heart J 2013; 165: 575- 82 16 Stugiewicz M et al.: The influence of iron deficiency on the functioning of skeletal muscles: experimental evidence and clinical implications. Eur J Heart Fail 2016; 18: 762-73 17 Jankowska EA et al.: Effects of intravenous iron therapy in iron-deficient patients with systolic heart failure: a meta-analysis of randomized controlled trials. Eur J Heart Fail 2016; 18: 786-95 18 Qian C et al.: The efficacy and safety of iron supplementation in patients with heart failure and iron deficiency: a systematic review and meta- analysis. Can J Cardiol 2016; 32: 151-9 19 McDonagh T, Macdougall IC: Iron therapy for the treatment of iron deficiency in chronic heart failure: intravenous or oral? Eur J Heart Fail 2015; 17: 248-62 20 Anker SD et al.; FAIR-HF Trial Investigators: Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med 2009; 361: 2436-48 21 Ponikowski P et al.; CONFIRM-HF Investigators: Beneficial effects of long-term intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiency. Eur Heart J 2015; 36: 657-68