Pharmakotherapeutische Rückfallprophylaxe bei Alkoholabhängigkeit
Autor:
Prof. Dr. med. Michael Soyka
Psychiatrische Klinik
Universität München
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Der Verlauf und die Prognose von Alkoholkonsumstörungen sind trotz vorhandener und gut überprüfter psychosozialer Therapien häufig ungünstig.1–6 Abstinenzraten im Langzeitverlauf liegen auch nach intensiven Behandlungen selten über 40% – ein therapeutisch respektables, aber nicht völlig befriedigendes Ergebnis. Welche bewährten oder neuen pharmakologischen Ansätze gibt es in diesem Bereich?
Keypoints
-
Acamprosat und Naltrexon sind etablierte, wenn auch wenig genutzte Medikamente zur Verbesserung der Abstinenzrate oder zur Verminderung des Alkoholkonsums.
-
Den Opiatantagonisten Nalmefen kann man «as needed» zur Trinkmengenreduktion einsetzen.
-
Disulfiram wird kaum mehr verwendet und führt bei Alkoholkonsum zu Unverträglichkeitsreaktionen.
-
Second-Line-Medikamente («off-label use») sind u.a. Baclofen, Gabapentin, Topiramat und Vareniclin.
-
Neuere experimentelle, aber auch klinische Forschungsansätze zielen vor allem auf stark psychotrop wirkende Halluzinogene wie LSD.
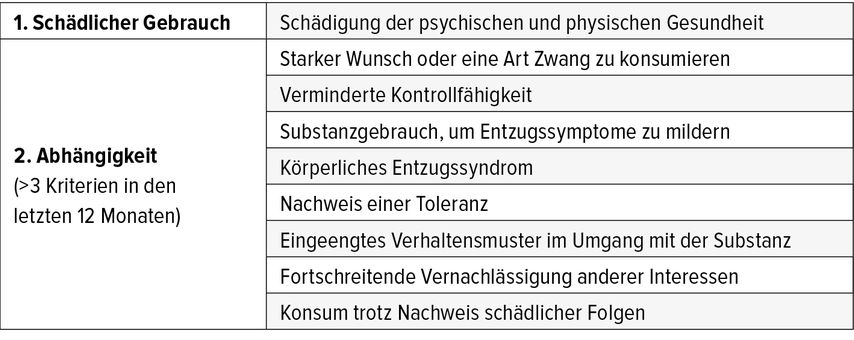
Alkoholkonsumstörungen sind häufig. Etwa 3% der erwachsenen Bevölkerung sind alkoholabhängig. Dazu kommt eine grosse Gruppe von Menschen mit schädlichem Gebrauch (Missbrauch) von Alkohol oder überhöhtem, potenziell gesundheitsschädlichem, riskantem Alkoholkonsum. Die diagnostischen Kriterien für Alkoholabhängigkeit nach ICD-10 sind in Tabelle 1 dargestellt.
Die neurobiologische Forschung bei Alkoholkonsumstörungen hat in den letzten Jahren deutliche Fortschritte gemacht. Die relevanten Hirnstrukturen, die für Suchterkrankungen relevant sind, konnten recht genau identifiziert werden. Nach Baler und Volkov (2006) zählen dazu:
-
das System für die Belohnungserwartung (insbesondere Nucleus accumbens und ventrales Pallidum)
-
das Gedächtnis- und Lernsystem (Amygdala, Hippocampus)
-
das Motivations- und Antriebsystem (orbitofrontaler Kortex)
-
das kognitive Kontrollsystem (präfrontaler Kortex)
Das mesolimbische Dopaminsystem wurde als Endstrecke für die psychotropen «rewarding effects» von Rauschdrogen wie Alkohol identifiziert. Alkohol beeinflusst die Dopaminausschüttung im Nucleus accumbens indirekt über GABAerge Interneuronen und das Opioidendorphinsystem, hat aber auch Effekte auf zahlreiche andere Neurotransmittersysteme.2 Entsprechend komplex sind seine biochemischen Effekte und mögliche pharmakotherapeutische Ansatzpunkte. Sedierende Effekte werden z.B. über GABA-A-Rezeptoren vermittelt.
Zugelassene Medikamente
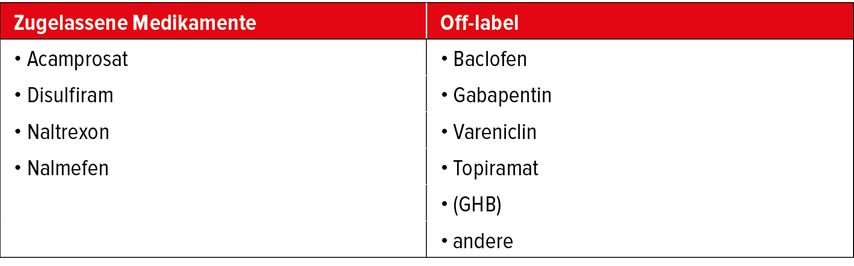
Es gibt zahlreiche Studien zur Pharmakotherapie bei Alkoholabhängigkeit.2,6–32 Ausser dem in Deutschland (aber z.B. in Österreich und der Schweiz) nicht mehr vertriebenen Disulfiram11–13, das über die Blockade der Aldehyddehydrogenase zu aversiv wirkenden Unverträglichkeitsreaktionen führt, sind zur pharmakogestützten Rückfallprophylaxe der Alkoholabhängigkeit nur die Opioidantagonisten Naltrexon2,6 und Nalmefen17–21 sowie das wahrscheinlich über Glutamatrezeptoren wirkende Acamprosat2,15 zugelassen. In einigen Ländern sind auch andere Substanzen zugelassen, wie z.B. GHB oder Baclofen (in Frankreich) (Tab. 2).
Obwohl mehrere Metaanalysen und auch die aktuelle deutsche S3-Leitlinie (siehe AWMF online) eine ausreichend gute Evidenzbasierung insbesondere für Acamprosat und Naltrexon zeigen,6 werden die Medikamente wenig eingesetzt. Die Wirksamkeit dieser Substanzen, ausgedrückt durch die Effektstärken, entspricht durchaus denen von Antidepressiva bei affektiven Erkrankungen.15 Eine Abstinenz vor Behandlungsbeginn muss nach neueren Befunden nicht unbedingt vorliegen.40
Naltrexon (50mg oral/d) blockiert die «belohnenden» Effekte von Alkohol und führt vor allem zu einer Trinkmengenreduktion bzw. geringeren Rückfallrate. Nebenwirkungen sind vor allem Übelkeit, Müdigkeit, gastrointestinale Beschwerden. Kontraindiziert ist Naltrexon bei Opiatabhängigkeit.
Der Wirkmechanismus von Acamprosat ist weniger klar, psychotrope Effekte fehlen. Genau wie Naltrexon gibt es keine pharmakologischen Interaktionen mit Alkohol. Wahrscheinlich wird das Alkoholverlangen vermindert. Eine Depotspritze von Naltrexon gibt es in den USA, hier ist sie nicht verfügbar.
Zahlreiche Metaanalysen zeigten eine höhere Abstinenzrate unter Acamprosat. Wegen der schlechten Bioverfügbarkeit müssen bei über 60kg Körpergewicht 3x2 Tabletten à 333mg genommen werden, darunter 2x2 Tabletten. Die häufigste Nebenwirkung ist ein milder Durchfall.
Seit einigen Jahren ist ein weiterer Opioidantagonist, Nalmefen, zugelassen, chemisch dem Naltrexon verwandt. Nalmefen wurde in einem «As needed»-Ansatz gezielt zur Trinkmengenreduktion (Einnahme vor Risikosituationen mit hoher Konsumwahrscheinlichkeit) untersucht.17–21 Das Nebenwirkungsprofil entspricht dem von Naltrexon.
Alternativen
Mögliche Alternativen zu den zugelassenen Medikamenten stellen Gabapentin, Topiramat, Baclofen, Vareniclin und andere dar. Das Antiepileptikum Gabapentin16,26,27 ist klinisch zugelassen zur Behandlung der (postherpetischen) Neuralgie sowie des Restless-Legs-Syndroms und wird hepatisch kaum verstoffwechselt. Einige Daten deuten auf eine Wirksamkeit bei Alkoholabhängigen hin. Von der American Psychiatric Association werden Gabapentin und Topiramat zur Behandlung von Alkoholkranken empfohlen, bei denen zugelassene Medikamente wie Acamprosat und Naltrexon nicht wirksam sind oder nicht vertragen werden. Kranzler et al.26 legten eine Metaanalyse über sieben Therapiestudien vor und fanden einen mittelgradigen Effekt auf die Anzahl von Tagen mit schwerem Alkoholkonsum («heavy drinking days»), aber nicht auf die Abstinenzraten.
Topiramat ist ein GABAerges Antiepileptikum, dass die Aktivität glutamaterger AMPA- und Kainat-Rezeptoren reguliert und spannungsabhängige Kalziumkanäle blockiert. Typische Nebenwirkungen sind Müdigkeit, Parästhesien und Appetitverlust. Die klinischen Effekte sind bislang nur begrenzt überzeugend.28,29 Topiramat ist allenfalls als Second-Line-Medikation diskutabel.
Vareniclin ist ein partieller Alpha-4-Beta-2-Agonist am Nikotinacetylcholinrezeptor und ist zur Raucherentwöhnung zugelassen. Es gibt eine Reihe von Untersuchungen zur Wirksamkeit von Vareniclin in Dosen von bis zu 2mg/d bei Alkoholkranken.30–32 Eine Metaanalyse32 zeigte, dass eine Therapie mit Vareniclin Craving nach Alkohol reduzierte, aber nicht den Alkoholkonsum. Nebenwirkungen sind z.B. Übelkeit, Verstopfung, epileptische Anfälle, vermehrtes Träumen.
Die aktuelle S3-Leitinie «Screening, Diagnose und Behandlung alkoholbezogener Störungen» (AWMF-Register 076/001, 6) sieht sowohl für Acamprosat als auch Naltrexon einen guten Wirknachweis (Level für Evidenz 1a) und empfiehlt den klinischen Einsatz mit dem Empfehlungsgrad B («sollte» eingesetzt werden). Für Disulfiram wird ein Level auf Evidenz 1b gegeben, Empfehlungsgrad 0 («kann» gegeben werden), ebenso für Nalmefen.
Pharmakogenetische Studien zur Rolle bestimmter genetisch determinierter Stoffwechselvarianten für die Wirksamkeit einzelner Substanzen sind interessant, aber klinisch bislang ohne Relevanz.33–35
Ausblick
Neuere experimentelle Ansätze betreffen Ketamin,36,37 einen nichtkompetitiven glutamatergen NMDA-Rezeptorantagonisten. Ketamin wird zunehmend z.B. bei Depressionen eingesetzt, scheint aber auch «verstärkende» Effekte von Alkohol zu vermindern. Noch aussichtsreicher ist der Einsatz von Halluzinogenen, z.B. LSD. Hier laufen bereits eine Reihe klinischer Studien, z.B. in der Schweiz. Diese Therapieansätze sind aber mit den oben skizzierten neurochemischen Hypothesen (mesolimbisches Dopaminsystem) kaum in Verbindung zu bringen und sicher auch nicht risikolos.
Entscheidend dürfte zunächst sein, die etablierten Medikamente vermehrt zu nutzen.38,39 Das Feld ist forschungsaktiv und für Überraschungen gut.
Literatur:
1Soyka M et al. (Hrsg.): Suchtmedizin. München: Elsevier; 2019 2 Kranzler HR et al.: JAMA 2018; 320: 815-26 3 World Health Organization (WHO): Global Status Report on Alohol and Health 2018. Geneva: WHO 2018 4 Kendler KS et al.: Am J Psychiatry 2017; 73: 575-81 5 Rehm J et al.: Alcohol Clin Exp Res 2014; 38: 1068-77 6 AWMF: Screening, Diagnose und Behandlung alkoholbezogener Störungen. AWMF-Register 076-001 (2021) 7 Goh ET et al.: Aliment Pharmacol 2017; 45: 865-82 8 Donoghue K et al.: Addiction 2015; 110: 920-30 9 Maisel NC et al.: Addiction 2013; 108: 275-93 10 Palpacuer C et al.: Addiction 2018; 113: 220-37 11 Rösner S et al.: Suchtmed 2014; 16: 47-52 12 Mutschler J et al.:Pharmacopsychiatry 2016; 49(4): 137-41 13 Fuller RK et al.: JAMA 1986; 1149-455 14 Jonas DE et al.: JAMA 2014; 311: 1889-900 15 Rosner S et al.: Cochrane Database Syst Rev 2010; (9): CD004332 16 Anton RF et al.: JAMA Intern Med 2020; 180: 728-36 17 Gual A et al.: Eur Neuropsychopharmacol 2013; 23: 1432-42 18 Mann K et al.: Biol Psychiatry 2013; 73: 706-13 19 Van den Brink W et al.: J Psychopharmacol 2014; 28: 733-44 20 Van den Brink W et al.: Alcohol Alcohol 2013; 48: 570-8 21 Palpacuer C et al.: Plos Med 2015; 12: e1001924 22 Addolorato G et al.: Alcohol Alcohol 2002; 37: 123-135 23 Garbutt JC et al.: Alcohol Clin exp res 2010; 34: 1849-57 24 Minozzi S et al.: Cochrane Database Syst Rev 2018; 11: CD012557 25 Rose AK et al.:Addiction 2018; 113: 1396-406 26 Kranzler HR et al.: Addiction 2019; 114: 1547-55 27 Ahmed et al.: Prim Care Companion CNS Disord 2019; 21:: 19r02465 28 Johnson BA et al.: Lancet 2003; 361: 1677-85 29 Blodgett JC et al.: Clin Exp Res 2014; 38: 1481-8 30 Litten RZ et al.: J Addict Med 7: 277-86 31 De Bejczy A et al.: Alcohol Clin Exp Res 2015; 39: 2189-99 32 Gandhi KD et al.: J Clin Psychiatry 2020; 81: 19r12924 33 Hartwell EE et al.: Expert Opin Drug Metab Toxicaol 2019; 15: 553-64 34 Biernacka JM et al.: Neuropsychopharmacology 021; 46: 2132-9 35 Ho M-F et al.:Br J Pharmacol 2022; 179: 3330-45 36 Das RK et al.: Nature Communications 2019; 10: 5187 37 Worell SD et al.: Neurosci Biobehav Rev 2021; 126: 573-89 38 Soyka M et al.: Nervenarzt 2021; 92: 57-65 39 Grodin EN et al.: Alcohol Alcohol 2022; 57: 589-94
Das könnte Sie auch interessieren:
Management of chronic insomnia according to the latest European guidelines
Insomnia is among the most prevalent sleep disorders, affecting up to one third of adults and 6–10% with chronic forms. The 2023 European Insomnia Guidelines1 emphasize that insomnia is ...
Kognitive und soziale Folgen eines Schlaganfalls
Jährlich erleiden in der Schweiz rund 249 von 100000 Menschen einen Schlaganfall, dessen Folgen weit über die akute medizinische Versorgung hinausreichen. Neben motorischen ...
Gesundheitsbelastungen und Gefährdungen durch Schicht- und Nachtarbeit
Schicht- und Nachtarbeit führen durch Schlafverlust und zirkadiane Desynchronisation zu einem erhöhten Risiko für vielfältige Gesundheitsprobleme. Dazu gehören verbreitete somatische ...