Nahrungsmittelallergien bei Kindern: Auslöser, Diagnose und Management
Autor:innen: Maria Breiding
PD Dr. med. Johannes Trück
Abteilung für Allergologie
Universitäts-Kinderspital, Zürich
E-Mail: maria.breiding@kispi.uzh.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Nahrungsmittelallergien im Kindesalter sind weit verbreitet und wirken sich erheblich auf die Lebensqualität betroffener Familien aus. Eine gründliche und gezielte Diagnostik ist entscheidend, um eine präzise Diagnose zu stellen und die Familien angemessen beraten zu können. Dank neuer Therapieoptionen eröffnet sich die Möglichkeit einer zunehmend personalisierten Medizin, die jedoch ein hohes Mass an gegenseitigem Vertrauen und eine enge Zusammenarbeit mit den Familien erfordert.
Keypoints
-
Nahrungsmittelallergien im Kindesalter präsentieren sich mit einem breiten Spektrum von Symptomen einer Allergie vom Soforttyp bis zu verzögert auftretenden Allergien, die häufig mit gastrointestinalen Beschwerden einhergehen.
-
Eine frühzeitige und präzise Diagnose hat einen erheblichen Einfluss auf das Management und die Prognose der Patient:innen.
-
Neue Aspekte, wie die frühe Einführung von Allergenen in die Beikost oder die orale Immuntherapie als Therapieoption bei IgE-vermittelten Nahrungsmittelallergien, müssen in die individuelle Beratung der Patient:innen und ihrer Familien miteinfliessen.
Nahrungsmittelallergien sind unerwartete, durch einen immunologischen Prozess vermittelte, klinisch manifeste Reaktionen auf normalerweise harmlose Umweltsubstanzen. Im Gegensatz dazu stehen toxische Reaktionen oder Intoleranzen, die nicht auf eine Immunreaktion zurückzuführen sind, wie zum Beispiel die Laktoseintoleranz. Allergische Reaktionen auf Nahrungsmittel zeigen sich in einer Vielzahl von Symptomen, von isolierten Hautreaktionen oder milden gastrointestinalen Beschwerden bis hin zu einer lebensbedrohlichen Anaphylaxie.
Nahrungsmittelallergien kommen am häufigsten im Säuglings- und Kleinkindalter vor, zudem ist in den letzten Jahrzehnten eine Zunahme an Nahrungsmittelallergien zu beobachten.1,2 Eine solche Diagnose stellt das Leben der Kinder sowie ihrer Familien vor grosse Herausforderungen, mit Auswirkungen auf das soziale Leben und die Lebensqualität. Die Prävalenz variiert je nach Literatur zwischen 2 und 10%3–5, mit deutlich höheren Raten bis zu 30% bei Kindern mit atopischer Dermatitis.6 Die gezielte Identifikation von Auslösern und eine angemessene moderne Betreuung mit personalisierten und in gemeinsamen Gesprächen mit der Familie entwickelten Therapieentscheidungen sind Voraussetzung für die optimale Betreuung. Dieser Artikel konzentriert sich auf die verschiedenen Auslöser und Arten von Nahrungsmittelallergien, ihre Differenzierung sowie das Management und gibt einen Ausblick auf die neuesten Entwicklungen im Bereich der Prävention und Therapie.
Einteilung der Nahrungsmittelallergien
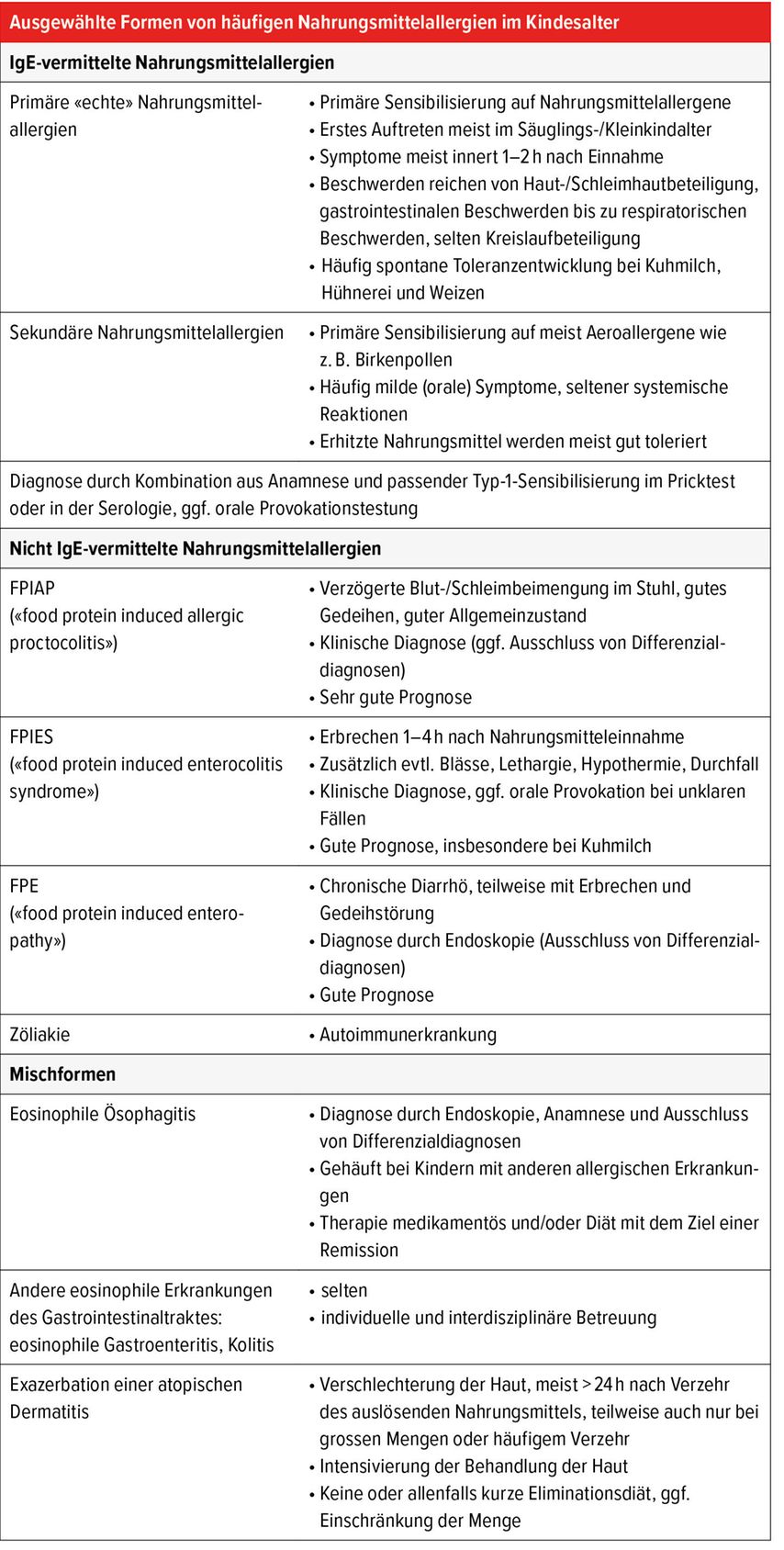
Nahrungsmittelallergien werden gemäss ihrer Pathophysiologie eingeteilt.7 Man unterscheidet zwischen IgE-vermittelten, nicht IgE-vermittelten Nahrungsmittelallergien und Mischformen (Tab. 1). Diese Kategorisierung ermöglicht meist anhand der klinischen Symptomatik und der allergologischen Diagnostik eine hilfreiche Unterteilung der Nahrungsmittelallergien im Kindesalter und hat Auswirkungen auf das weitere diagnostische und therapeutische Vorgehen. In der allergologischen Spezialsprechstunde sind primäre IgE-vermittelte Nahrungsmittelallergien am häufigsten. Neben dem in verschiedenen Ländern beobachteten Anstieg der Prävalenz von IgE-vermittelten Nahrungsmittelallergien scheint auch die Häufigkeit von nicht IgE-vermittelten Nahrungsmittelallergien in den letzten Jahren zuzunehmen.8–10
IgE-vermittelte Nahrungsmittelallergien
Nahrungsmittelallergien entstehen durch ein komplexes Zusammenspiel von genetischen und immunologischen Faktoren sowie der regelmässigen Auseinandersetzung mit der Umwelt. Obwohl die Forschung in den letzten Jahren zunehmend wertvolle Einblicke geliefert hat, bleibt die genaue Ursache für die Entwicklung von Nahrungsmittelallergien weiterhin unklar. Die genetische Prädisposition spielt eine entscheidende Rolle.11 So weisen Kinder, deren Geschwister oder Eltern an einer Allergie leiden, ein deutlich erhöhtes Risiko auf, selbst Allergien bzw. Erkrankungen aus dem atopischen Formenkreis zu entwickeln. Auch das Umfeld, in dem das Kind aufwächst, scheint einen Einfluss auf die Allergieentwicklung zu haben. Die Hygienehypothese postuliert, dass Kinder, die in ländlicher Umgebung aufwachsen, weniger anfällig für Allergien sind. Ebenso scheint das Mikrobiom einen Einfluss zu haben, das in den letzten Jahren verstärkt erforscht wird.12
Risikopopulationen und Beikosteinführung
Insbesondere Kinder mit atopischer Dermatitis haben ein erhöhtes Risiko, IgE-vermittelte Nahrungsmittelallergien zu entwickeln. Neuere Erkenntnisse legen nahe, dass v.a. die gestörte Hautbarriere bei atopischer Dermatitis und die damit verbundene Exposition gegenüber Allergenen auf «unnatürlichem Weg» über die Haut die Entwicklung von IgE-vermittelten Nahrungsmittelallergien begünstigen.13 Demgegenüber scheint die frühzeitige Exposition gegenüber Allergenen über den Magen-Darm-Trakt das Risiko von Nahrungsmittelallergien zu verringern.14–16 Ein wichtiges «Toleranzfenster» zur Primärprävention von IgE-vermittelten Nahrungsmittelallergien mit einer frühen Beikosteinführung im Alter von 4–6 Monaten konnte für Erdnuss gezeigt werden. Ebenso ist die frühzeitige Einführung von erhitztem Hühnerei im ersten Lebensjahr mit einem geringeren Allergierisiko verbunden. Weiterhin zeigte sich in longitudinalen Studien, dass eine diverse Ernährung im Säuglingsalter protektiv in Bezug auf IgE-vermittelte Nahrungsmittelallergien ist.17 Es ist anzunehmen, dass das Prinzip der frühen Beikosteinführung auch für andere potenziell allergene Nahrungsmittel gilt, weshalb wir eine frühe Einführung von Nahrungsmitteln, die regelmässig in Familien verzehrt werden, empfehlen.
Auslöser und Symptomatik
Die häufigsten Auslöser für IgE-vermittelte Nahrungsmittelallergien bei kleinen Kindern sind in erster Linie das Hühnerei, die Kuhmilch und die Erdnuss, während bei älteren Kindern Schalenfrüchte (echte Nüsse) und die Erdnuss dominieren.18,19 Unter den echten Nüssen ist die Cashewnuss aktuell der häufigste Auslöser, wahrscheinlich aufgrund ihrer vermehrten Verwendung in der westlichen Ernährung. Weitere verbreitete Allergene sind Sesam, Fisch und Meeresfrüchte sowie Weizen (Gluten).
Die Symptomatik der IgE-vermittelten Nahrungsmittelallergien umfasst ein breites Spektrum von milden Hautbeschwerden bis hin zur Anaphylaxie. Während einer allergischen Reaktion ist eine Beteiligung der Haut (Urtikaria, Juckreiz) oder der Schleimhäute (Angioödem) sehr häufig, aber nicht zwingend. Ebenfalls häufig sind gastrointestinale Beschwerden, die sich bei kleinen Kindern meist mit Erbrechen und bei älteren Kindern und Jugendlichen häufiger mit Bauchschmerzen bemerkbar machen. Eine Beteiligung der Atemwege weist auf eine höhergradige allergische Reaktion hin und zeigt sich mit in- oder exspiratorischem Stridor/Giemen, Husten und Atemnot. Kreislaufsymptome mit arterieller Hypotonie und biphasische Verläufe sind im Kindesalter selten. In der (Deutsch-)Schweiz erfolgt die Einteilung einer allergischen Reaktion meist nach H.L. Müller, die ursprünglich für Insektengiftallergien entwickelt wurde. International standardisierte Einteilungen von allergischen Reaktionen auf Nahrungsmittel wie der oFASS-5 (ordinal Food Allergy Severity Score20) haben sich im Alltag noch nicht durchgesetzt.
Sekundäre Nahrungsmittelallergien im Kindesalter basieren oft auf einer primären Sensibilisierung gegenüber Pollen, wobei Reaktionen auf kreuzallergene Strukturen in pflanzlichen Nahrungsmitteln auftreten. In der Regel manifestiert sich dies durch eine milde Symptomatik, und eine Erhitzung der Nahrungsmittel führt zu einer verbesserten Verträglichkeit, wodurch eine Auslassdiät weniger strikt durchgeführt werden muss. Dennoch können schwerwiegendere, systemische Reaktionen auftreten, insbesondere in Verbindung mit Augmentationsfaktoren, worauf die Patient:innen hingewiesen werden sollten.
Diagnostik
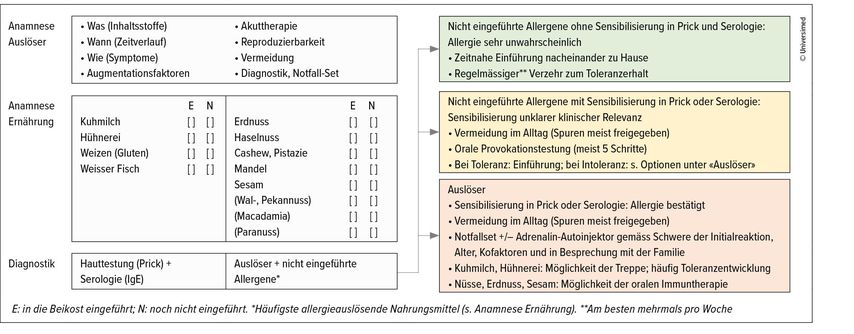
Die Diagnostik beginnt mit einer präzisen Anamnese, wobei der Fokus auf möglichen Auslösern, dem zeitlichen Ablauf und den genauen Symptomen liegt. Auch Augmentationsfaktoren, die eine allergische Reaktion begünstigen können, indem sie die Reaktionsschwelle herabsenken wie Infektionen, sportliche Aktivitäten, Stress, Hitze, Einnahme von NSAR oder Alkoholkonsum müssen erfragt werden. Eine IgE-vermittelte Soforttypreaktion entwickelt sich in der Regel innerhalb von 2 Stunden nach der Einnahme eines Allergens, in den meisten Fällen jedoch innerhalb von 30 Minuten. Die vertiefte Anamnese beinhaltet eine detaillierte Ernährungsanamnese, einschliesslich bereits tolerierter Nahrungsmittel. Eine persönliche Anamnese mit Schwerpunkt auf weitere allergische Erkrankungen, wie atopische Dermatitis, Asthma bronchiale oder allergische Rhinokonjunktivitis, sowie die Familienanamnese sollten ebenfalls erfasst werden.
Im nächsten Schritt wird untersucht, ob eine Typ-1-Sensibilisierung auf mögliche Auslöser (Index-Nahrungsmittel) oder noch nicht eingeführte Nahrungsmittel vorliegt. Dies erfolgt mit einer Hauttestung, meist anhand eines Prick-to-Prick-Tests, bei dem unverarbeitete Nahrungsmittel mit einer feinen Nadel in die oberste Hautschicht des Unterarms appliziert werden. Zusätzlich werden im Blut spezifische IgE-Antikörper auf Nahrungsmittel untersucht (Abb. 1). Die serologische Komponentendiagnostik, wie z.B. die IgE-Bestimmung der Speicherproteine (Erdnuss: Arah2, Cashewnuss: Anao3 oder Haselnuss Cora14), kann weitere Hinweise auf die Relevanz einer möglichen Typ-1-Sensibilisierung geben und im zeitlichen Verlauf Informationen über eine mögliche Toleranzentwicklung geben. In den letzten Jahren ist der Basophilen-Aktivierungstest (BAT) auch für Nahrungsmittel zunehmend verfügbar geworden. Derzeit spielt er jedoch im klinischen Alltag noch keine entscheidende Rolle.
Klinisches Management
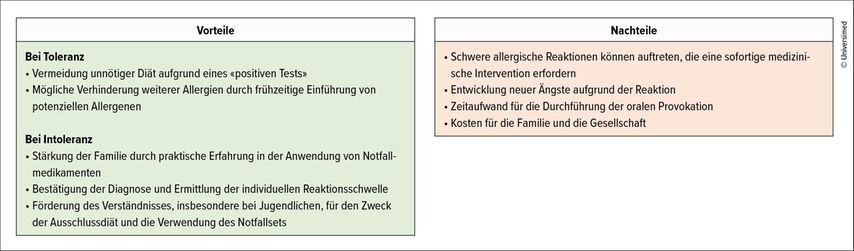
Das weitere klinische Vorgehen wird durch die gesamtheitliche Bewertung der Anamnese und der Resultate aus der Haut- und Bluttestung bestimmt. Dabei lassen sich drei Kategorien an Nahrungsmitteln definieren, bei denen unterschiedlich vorgegangen wird (Abb. 1). Insbesondere die zeitnahe Testung und – bei unauffälligem Resultat – Freigabe von noch nicht eingeführten Nahrungsmitteln sind von besonderer Bedeutung, um die Entstehung von weiteren Nahrungsmittel-Sensibilisierungen und -Allergien zu vermeiden (grüner Kasten in Abb. 1). Noch nicht eingeführte Nahrungsmittel mit Nachweis einer Sensibilisierung sollten in einem dafür geeigneten Setting mittels standardisierter oraler Provokationstestung (OPT) ausgetestet werden (gemäss PRACTALL-Guidelines21). Bis zur Durchführung der OPT müssen diese Nahrungsmittel im Alltag gemieden werden (gelber Kasten in Abb. 1). Bei Toleranz im OPT kann das Nahrungsmittel freigegeben werden, wobei im Anschluss ein regelmässiger Verzehr zu Hause für den Toleranzerhalt wichtig ist. Die Indikation für die Durchführung einer OPT muss immer gemeinsam mit der Familie beurteilt werden und die Vorteile den Nachteilen und dem organisatorischen Aufwand gegenübergestellt werden (Abb. 2). Aus medizinischer Sicht ist es wichtig, unnötige Eliminationsdiäten zu verhindern, um die Lebensqualität nicht weiter einzuschränken und die Entwicklung zusätzlicher Allergien zu verhindern.
In der dritten Kategorie stehen Nahrungsmittel, die klinische Reaktionen auslösen und durch den Nachweis einer Typ-1-Sensibilisierung somit eine Allergie diagnostiziert werden kann. Diese Nahrungsmittel müssen im Alltag vermieden und die Familie mit dem Umgang mit der Allergie instruiert werden. Häufig lohnt sich ein Einbezug von auf Allergien spezialisierte Ernährungsberater:innen und die Aufklärung und Instruktion des erweiterten Umfelds einschliesslich Lehrpersonal und teilweise auch weiterer Betreuungspersonen. Wichtig ist das Bereitstellen eines individuellen Behandlungsplans und eines Notfallsets, das häufig einen Adrenalin-Autoinjektor beinhaltet.
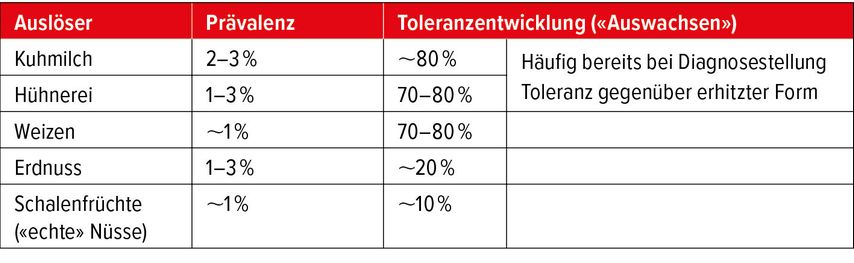
Prognostisch besteht bei einer Allergie auf Kuhmilch, Hühnerei und Weizen (Gluten) eine hohe Wahrscheinlichkeit einer natürlichen Toleranzentwicklung bis zum Schulalter (Tab. 2).22–29 Erhitzte Formen von Hühnerei und Kuhmilch werden häufig bereits bei der Diagnosestellung toleriert,30,31 sodass zur raschen und unkomplizierten Einführung dieser Nahrungsmittel sogenannte Hühnerei- und Kuhmilchtreppen eingesetzt werden können. Das Prinzip dieser Treppen ist die schrittweise Einführung von Kuhmilch und Hühnerei über 4–6 Monate in zunehmender Menge und in abnehmender erhitzter Form. Diese Art der Therapie sollte nur in enger Begleitung eines spezialärztlichen Teams und der Ernährungsberatung erfolgen.
Orale Immuntherapie
Bei persistierenden Nahrungsmittelallergien besteht die Möglichkeit einer oralen Immuntherapie (OIT), welche von der europäischen Gesellschaft für Allergologie und klinische Immunologie (EAACI) bereits seit 2018 für Erdnuss, Kuhmilch und Hühnerei ab dem Alter von 4 Jahren empfohlen wird.7 Diese Strategie wird jedoch zunehmend auch für andere Allergene, v.a. «echte» Nüsse sowie Sesam angewendet und scheint sich im Alltag zu bewähren. Das Ziel einer OIT sind die Anhebung der Reaktionsschwelle und die Verminderung des Risikos, eine schwere allergische Reaktion zu erleiden. Durch die schrittweise Verabreichung des allergieauslösenden Nahrungsmittels in steigenden Dosen soll der Körper dazu gebracht werden, weniger empfindlich auf das Allergen zu reagieren. Die OIT hat das Potenzial, die Schwere der allergischen Reaktionen zu reduzieren und im Idealfall sogar zu einer Toleranzentwicklung gegenüber dem allergieauslösenden Stoff zu führen. Da eine lang dauernde Toleranz v.a. bei jungen Kindern mit (noch) niedrigen Allergen-spezifischen IgE-Konzentrationen erreicht werden kann, wird die OIT zunehmend im jungen Alter eingesetzt, teilweise noch bevor eine Persistenz der Nahrungsmittelallergie nachgewiesen werden kann.32
Die Durchführung einer OIT ist mit grossem Einsatz und zeitlichem Aufwand für die Familien verbunden und weist während der Therapie ein höheres Nebenwirkungspotenzial als die Strategie der Allergenvermeidung auf.33 Die Familien müssen deshalb ausführlich aufgeklärt und instruiert und die Vor- und Nachteile einer solchen Therapie gegeneinander abgewogen werden. Zudem ist mit den Familien eine klare Zielsetzung zu definieren und bei Auftreten von Komplikationen muss eine Ansprechperson des Behandlungsteams jederzeit erreichbar sein. Die Therapie sollte nur von allergologisch spezialisierten Ärzt:innen mit Erfahrung in der Anwendung einer OIT durchgeführt werden.
Nicht IgE-vermittelte Nahrungsmittelallergien
Nicht IgE-vermittelte Nahrungsmittelallergien umfassen verschiedene Krankheitsbilder, die meist isoliert den Verdauungstrakt betreffen, sich jedoch im Schweregrad und der Prognose deutlich unterscheiden. Die Betreuung der Betroffenen erfolgt in der pädiatrischen Allergologie oder Gastroenterologie, wobei eine enge Zusammenarbeit zwischen den Spezialdisziplinen von grosser Bedeutung ist.
«Food protein induced enterocolitis syndrome» (FPIES)
Kinder mit FPIES präsentieren sich mit wiederholtem Erbrechen, Lethargie, Blässe, Hypothermie und Diarrhö bis hin zum hypovolämen Schock. Typischerweise treten die Symptome verzögert 1–4 Stunden nach Nahrungsmittelverzehr auf. Häufige Auslöser sind Kuhmilch, Hühnerei, Fleisch, Fisch, Meeresfrüchte, Getreide sowie Avocado und Bananen. Die Diagnose erfolgt klinisch nach definierten internationalen Kriterien,34 und bei unklaren Fällen sind orale Provokationen notwendig. Aufgrund der unspezifischen Symptomatik wird die Diagnose häufig verpasst oder erst nach mehreren Krankheitsepisodengestellt. Die Akuttherapie besteht in der Gabe von Flüssigkeit und Ondansetron als Antiemetikum (ab dem Alter von 6 Monaten). Chronische Formen, die gehäuft bei Säuglingen auftreten, können mit einer chronischen Diarrhö und damit verbunden einer Gedeihstörung einhergehen, insbesondere wenn die Diagnose nicht frühzeitig gestellt wird. Die Prognose ist bei jüngeren Kindern insgesamt günstig, und Toleranz entwickelt sich oft innerhalb von Monaten oder Jahren. Bis zur Bestätigung der Toleranz muss eine Eliminationsdiät eingehalten werden, begleitet von einer Ernährungsberatung. Für den Notfall wird Ondansetron verschrieben. Bei einem Teil der Patienten besteht eine Typ-1-Sensibilisierung auf die symptomauslösenden Nahrungsmittel mit der Möglichkeit eines Übergangs zu einer IgE-vermittelten Nahrungsmittelallergie.
«Food protein induced allergic proctocolitis» (FPIAP) und «food protein induced enteropathy» (FPE)
FPIAP ist eine häufig auftretende milde Form einer nicht IgE-vermittelten Nahrungsmittelallergie, verbunden mit Blut- und Schleimbeimengungen bei kleinen Säuglingen, meist im Alter von 1–8 Lebenswochen. Charakteristisch für dieses Krankheitsbild ist der sehr gute Allgemeinzustand, eine unauffällige körperliche Untersuchung sowie gutes Gedeihen. Das FPIAP kommt bei gestillten und mit Milchpulver ernährten Säuglingen vor. Kuhmilch ist der häufigste Auslöser, selten sind Soja, Hühnerei und Weizen auslösend.35 Die Diagnose erfolgt klinisch, und die Prognose ist gut. Eine probatorische Eliminationsdiät für 2 bis 4 Wochen kann diagnostisch und therapeutisch durchgeführt werden. Meist ist eine Einführung des symptomauslösenden Nahrungsmittels noch vor dem 12. Lebensmonat möglich.
FPE ist selten und zeigt sich mit chronischer Diarrhö, gegebenenfalls auch Erbrechen und Gedeihstörung. Kuhmilch ist der Hauptauslöser und die Prognose insgesamt gut mit Toleranzentwicklung innerhalb von Monaten oder wenigen Jahren.
Mischformen, z.B. eosinophile Ösophagitis (EoE)
Die EoE ist eine in den letzten Jahren an Prävalenz zunehmende Mischform und umfasst eine IgE- und nicht IgE-vermittelter Pathogenese.36 Die Symptomatik im Kindesalter unterscheidet sich von derjenigen bei Jugendlichen oder Erwachsenen, bei welchen häufig Dysphagie und Bolusimpaktion auftreten. Bei Kindern dominieren Gedeihstörung, Essstörung, Übelkeit oder Erbrechen und Refluxsymptome nach Nahrungsmittelverzehr. Die Diagnose erfordert eine endoskopische Untersuchung mit Nachweis von eosinophilen Granulozyten in der Schleimhautbiopsie. Neben den üblichen Therapieoptionen mit Medikamenten (z.B. PPI, Steroide) und Eliminationsdiäten könnten Biologika wie Dupilumab in Zukunft eine grosse Rolle spielen.
Fazit
Nahrungsmittelallergien im Kindesalter sind verbreitet und beeinflussen das Leben betroffener Familien erheblich. Eine frühe und gezielte Diagnostik bei Kindern mit Verdacht auf Nahrungsmittelallergie ist entscheidend. Sie ermöglicht nicht nur das Vermeiden unnötiger Diäten, sondern auch die Verhinderung von schweren allergischen Reaktionen im Alltag. Bei einer Ausschlussdiät sollte das Ziel stets lauten: «so wenig wie möglich, so viel wie nötig.» Eine differenzierte und personalisierte Herangehensweise an Nahrungsmittelallergien ist essenziell, um die Lebensqualität der Kinder zu verbessern und gleichzeitig ihre Sicherheit zu gewährleisten.
Literatur:
1 Conrado AB et al.: Food anaphylaxis in the United Kingdom: analysis of national data, 1998-2018. BMJ 2021; 372: n251 2 Motosue MS et al.: Increasing emergency department visits for anaphylaxis, 2005-2014. J Allergy Clin Immunol Pract 2017; 5: 171-5 3 Osborne NJ et al.: Prevalence of challenge-proven IgE-mediated food allergy using population-based sampling and predetermined challenge criteria in infants. J Allergy Clin Immunol 2011; 127: 668-76 4 Nwaru BI et al.: Prevalence of common food allergies in Europe: a systematic review and meta-analysis. Allergy 2014; 69: 992-1007 5 Gupta RS et al.: The public health impact of parent-reported childhood food allergies in the United States. Pediatrics 2018; 142: e20181235 6 Christensen MO et al.: Prevalence of and association between atopic dermatitis and food sensitivity, food allergy and challenge-proven food allergy: A systematic review and meta-analysis. J Eur Acad Dermatol Venereol 2023; 37: 984-1003 7 Pajno GB et al.: EAACI Guidelines on allergen immunotherapy: IgE-mediated food allergy. Allergy 2018; 73: 799-815 8 De Rooij WE et al.: Emerging incidence trends of eosinophilic esophagitis over 25 years: Results of a nationwide register-based pathology cohort. Neurogastroenterol Motil 2021; 33: e14072 9 Giriens B et al.: Escalating incidence of eosinophilic esophagitis in Canton of Vaud, Switzerland, 1993–2013: a population-based study. Allergy 2015; 70: 1633-9 10 Hill DA et al.: Eosinophilic esophagitis is a late manifestation of the allergic march. J Allergy Clin Immunol Pract 2018; 6: 1528-33 11 Hourihane JO et al.: Peanut allergy in relation to heredity, maternal diet, and other atopic diseases: results of a questionnaire survey, skin prick testing, and food challenges. BMJ 1996; 313: 518-21 12 Savage JH et al.: A prospective microbiome-wide association study of food sensitization and food allergy in early childhood. Allergy 2018; 73: 145-52 13 Du Toit G et al.: Food allergy: Update on prevention and tolerance. J Allergy Clin Immunol 2018; 141: 30-40 14 Du Toit G et al.: Randomized trial of peanut consumption in infants at risk for peanut allergy. N Engl J Med 2015; 372: 803-13 15 Perkin MR et al.: Randomized trial of introduction of allergenic foods in breast-fed infants. N Engl J Med 2016; 374: 1733-43 16 Bellach J et al.: Randomized placebo-controlled trial of hen’s egg consumption for primary prevention in infants. J Allergy Clin Immunol 2017; 139: 1591-9 17 Roduit C et al.: Increased food diversity in the first year of life is inversely associated with allergic diseases. J Allergy Clin Immunol 2014; 133: 1056-64 18 Dölle-Bierke S et al.: Food-induced anaphylaxis: Data from the European Anaphylaxis Registry. J Allergy Clin Immunol Pract 2023; 11: 2069-79 19 Grabenhenrich LB et al.: Anaphylaxis in children and adolescents: The European Anaphylaxis Registry. J Allergy Clin Immunol 2016; 137: 1128-37 20 Fernández-Rivas M et al.: Development and validation of the food allergy severity score. Allergy 2022; 77: 1545-58 21 Sampson HA et al.: Standardizing double-blind, placebo-controlled oral food challenges: American Academy of Allergy, Asthma & Immunology–European Academy of Allergy and Clinical Immunology PRACTALL consensus report. J Allergy Clin Immunol 2012; 130: 1260-74 22 Lack G: Food allergy. N Engl J Med 2008; 359: 1252-60 23 Fleischer DM et al.: The natural history of tree nut allergy. J Allergy Clin Immunol 2005; 116: 1087-93 24 Arik Yilmaz E et al.: Factors associated with the course of egg allergy in children. Ann Allergy Asthma Immunol 2015; 115: 434-8 25 Keet CA et al.: The natural history of wheat allergy. Ann Allergy Asthma Immunol 2009; 102: 410-5 26 Santos A et al.: Predictive factors for the persistence of cow’s milk allergy. Pediatr Allergy Immunol 2010; 21: 1127-34 27 Savage JH et al.: The natural history of egg allergy. J Allergy Clin Immunol 2007; 120: 1413-7 28 Skripak JM et al.: The natural history of IgE-mediated cow’s milk allergy. J Allergy Clin Immunol 2007; 120: 1172-7 29 Gupta RS et al.: Factors associated with reported food allergy tolerance among US children. Ann Allergy Asthma Immunol 2013; 111: 194-8 30 Leonard SA et al.: Dietary baked egg accelerates resolution of egg allergy in children. J Allergy Clin Immunol 2012; 130: 473-80 31 Nowak-Wegrzyn A et al.: Tolerance to extensively heated milk in children with cow’s milk allergy. J Allergy Clin Immunol 2008; 122: 342-7 32 Jones SM et al.: Efficacy and safety of oral immunotherapy in children aged 1–3 years with peanut allergy (the Immune Tolerance Network IMPACT trial): a randomised placebo-controlled study. Lancet 2022; 399: 359-71 33 The PALISADE Group of Clinical Investigators: AR101 Oral Immunotherapy for Peanut Allergy. N Engl J Med 2018; 379: 1991-2001 34 Nowak-Węgrzyn A et al.: International consensus guidelines for the diagnosis and management of food protein-induced enterocolitis syndrome: Executive summary—Workgroup Report of the Adverse Reactions to Foods Committee, American Academy of Allergy, Asthma & Immunology. J Allergy Clin Immunol 2017; 139: 1111-26 35 Labrosse R et al.: Non-IgE-mediated gastrointestinal food allergies in children: an update. Nutrients 2020; 12: 2086 36 Dellon ES et al.: Updated International Consensus Diagnostic Criteria for Eosinophilic Esophagitis: Proceedings of the AGREE Conference. Gastroenterol 2018; 155: 1022-33
Das könnte Sie auch interessieren:
Mehr als nur eine trockene Angelegenheit: Die Sjögren-Erkrankung im Fokus
Die Sjögren-Erkrankung (SjD) ist eine chronisch-entzündliche, systemische Autoimmunerkrankung mit hoher klinischer Variabilität. Sie gehört zur Familie der Kollagenosen, zu der ...
Tinnitusmanagement 2025
Die Behandlung von Tinnitus hat sich in den letzten Jahren weiterentwickelt. Die AWMF-Leitlinien zum Tinnitusmanagement bieten evidenzbasierte Empfehlungen zur Diagnostik und Therapie ...
Restless-Legs-Syndrom
Das Restless-Legs-Syndrom (RLS) kann die Lebensqualität der Betroffenen erheblich beeinträchtigen. Welche Störungen dem RLS zugrunde liegen, welche Symptome es auslöst und wie Diagnostik ...