10 x individualisierte Medizin bei Entscheiden rund um die Antikoagulation
Autor*innen:
Dr. med. Pratintip Lee1,2
Prof. Dr. med. Jürg Hans Beer1,2
FMH Innere Medizin und Hämatologie
1Departement Innere Medizin
Kantonspital Baden
2Labor für Molekulare Kardiologie
Universität Zürich, Schlieren
E-Mail: pratintip.lee@uzh.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Praktische Fragen zu Thrombose, Hämostase und Antikoagulation sind komplex, häufig und betreffen alle Fachgebiete; sie sind meist von längerfristiger Tragweite. Differenzierte, massgeschneiderte Entscheide können Thromboembolien, kardiovaskuläre Ereignisse und Blutungskomplikationen reduzieren oder verhindern. Anhand von typischen, klinischen Situationen sollen die individualisierten Risikoabwägungen und Entscheidungsfindungen unterstützt werden, dies vor dem Hintergrund der Evidenz, der Guidelines und der individuellen Patientensituationen, in denen auch weiche Faktoren, Risikomodifizierer und Patientenpräferenzen eine gewichtige Rolle spielen.
Die Themen dieser Übersicht sind als Fragen/Antworten dargestellt und sollen Ermessens-Spielraum geben. Oft empfiehlt sich die Entscheidungsfindung in komplexen Situationen mit den involvierten Spezialisten «am runden Tisch», gerade bei kontroversen Entscheiden mit längerfristigem Charakter, aber auch in Akutsituationen (z.B. perioperatives Management), wo gegenläufige Risiken (venöse Thromboembolie [VTE] vs. Blutung) gegeneinander abgewogen werden müssen.
1) Wie hoch sind das Rezidivrisiko und das Blutungsrisiko?
1a) Rezidivrisiko nach stattgehabter VTE
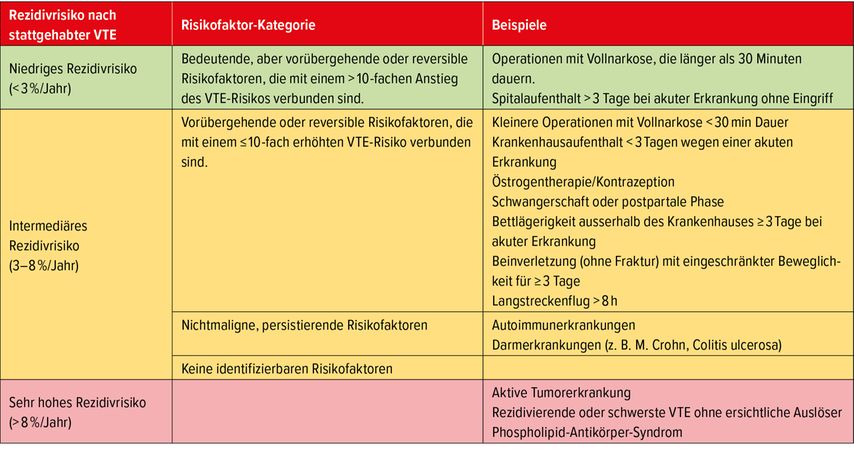
Allgemein gesehen wird im Durchschnitt jeder dritte Patient in den folgenden 5–10 Jahren nach Absetzen der Antikoagulation (AK) ein Thromboembolie-Rezidiv durchmachen.1,2 Im Einzelfall ist das Rezidivrisiko jedoch unterschiedlich hoch (Tab.1) und gegen das Blutungsrisiko abzuwägen.
-
Grün/relativ geringes Rezidivrisiko (<3%/Jahr), wenn der Provokationsfaktor sehr stark und entsprechend plausibel, aber klar transient war; also ein vorübergehender Risikofaktor, der das VTE-Risiko kurzfristig um das 10-Fache erhöht hat, aber danach nicht mehr vorhanden ist. Beispiele dafür sind: >3 Tage Bettruhe, Hospitalisation, chirurgischer Eingriff in Allgemeinanästhesie mit >30min Dauer. In diesen Fällen wird die AK in der Regel nach 3 (–6) Monaten abgesetzt.
-
Rot/sehr hohes Rezidivrisiko (>8%/Jahr): Am anderen Ende des Spektrums ist der Entscheid zur Weiterführung der AK in der Regel relativ einfach. Hierfür sollte der Begriff «Langzeit-AK» verwendet werden und nicht von von einer «lebenslänglichen AK» gesprochen werden. Abgesehen vom negativen Beigeschmack machen gewisse neue Aspekte und Lebensumstände nicht selten dann doch eine Revision des Entscheids nötig. Beispiele für die Kategorie rot sind: aktive Tumorerkrankung, rezidivierende oder schwerste VTE ohne ersichtliche Auslöser, Phospholipid-Antikörper-Syndrom, mechanische Herzklappenprothesen.
-
Gelb/intermediäres Risiko (3–8%/Jahr): Diese Risikokategorie lässt recht viel Ermessens-Spielraum zu und trifft zu, wenn z.B. kein sicherer zeitlich umschriebener Risikofaktor vorliegt, so u.a. nicht maligne, aber persistierende Risikofaktoren wie Autoimmunerkrankungen oder entzündliche Darmerkrankungen (M. Crohn, Colitis ulcerosa) vorliegen. In diese Kategorie gehören auch transiente Risikosituationen, die das Risiko um weniger als das 10-Fache erhöhen (z.B. Schwangerschaft, Wochenbett, Östrogen-Therapie/Kontrazeption, kleinere chirurgische Eingriffe (<30min), <3 Tage Hospitalisation, Langstreckenflug >8h).
Tab. 1: Individualisierte Einschätzung des Jahres-Rezidivrisikos für eine venöse Thromboembolie (VTE) (modifiziert nach Konstantinides et al., 2019; Áinle et Kevane, 2020; Lip et al., 2011)3, 5, 6
1b) Blutungsrisiko bei AK (womit und wie lange antikoagulieren?)
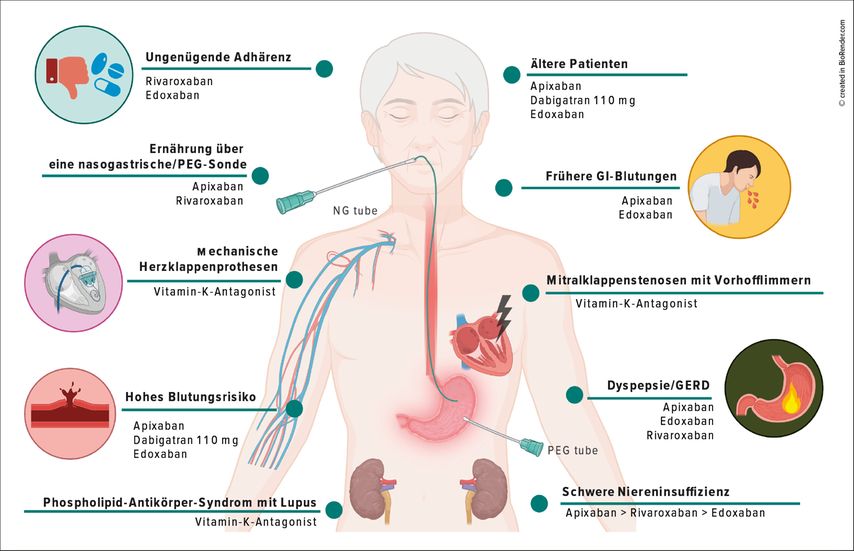
Gegen das Rezidivrisiko ist die Blutungsgefahr unter AK abzuwägen. Nützliche Scores für die Beurteilung des Risikos für Thromboembolien und Blutungen (z.B. CHA2DS2 VASc, ISTH-Bleeding Score, HAS-BLED-Score, HEMORR2HAGES Score)6–10 berücksichtigen unter anderem differenziert Faktoren wie Alter, Leber- und Niereninsuffizienz, Anämie/Thrombopenie, frühere Blutungen, kombinierte duale oder gar Tripelantikoagulation (ist zeitlich so kurz wie möglich zu halten), weitere Medikamente mit ulzerogenem Potenzial (NSAR) ebenso wie mögliche Interaktionen. Die Wahl des Antikoagulans und die Dauer der Antikoagulation bedürfen spezieller Abwägungen (Abb.1; s. Punkt 3).
Abb. 1: Individualisierte Wahl des Antikoagulans nach den Pathologien und Präferenzen des Patienten (modifiziert nach Chan et Eikelboom, 2019; Lüscher et al., 2021)11, 12
2) Welche «Risk-Modifyers» sind zu beachten?
Neben der persönlichen Anamnese sollte immer auch die Familienanamnese beachtet werden, besonders wenn in jüngerem Alter und gehäuft thromboembolische Ereignisse auftreten. Hereditäre Faktoren sind heute recht gut untersucht und ihr Einfluss sollte mitberücksichtigt werden in der «aufsummierten» Risikokonstellation; so kann aufgrund der Familienanamnese das Risiko von der gelben in die rote Kategorie wechseln11 (Abb.1). Ebenso können ein BMI >40 mit verminderter Mobilität, eine erhöhte Sturzgefahr, Frailty oder eine Tumorerkrankung eine entsprechende Modifikation induzieren. «Globalentscheide» werden auch durch die Lebensqualität, persönliche Präferenzen der Patienten, Demenzerkrankungen u.Ä. entscheidend geprägt, was vom behandelnden Arzt mitberücksichtig werden muss, um einen indivivuellen Entscheid fällen zu können.
3) Welches Antikoagulans für welchen Patienten?
Zu dieser Frage gibt Abbildung 1 detailliert Auskunft. In der Literatur finden sich neuere, gute Angaben, die für die individualisierte Auswahl hilfreich sein können:12 Vitamin-K-Antagonisten (VKA) sind weiterhin unbestritten bei künstlichen Herzklappenprothesen, bei Phospholipid-Antikörper-Syndrom mit Lupus-Antikoagulans und bei Mitralklappenstenosen mit Vorhofflimmern; die direkten oralen Antikoagulanzien (DOAK) sind bzgl. Blutungsrisiko, insbesondere auch für intrazerebrale Blutungen, den VKA überlegen und bzgl. Reduktion des Thromboembolie(TE)-Risikos als Gruppe gleich gut oder besser. Für die Wahl des DOAKs sind individuelle Faktoren wichtig. Stehen bspw. das Alter, eine Niereninsuffizienz und die Blutungsgefahr (insbesondere intrazerebral und gastrointestinal) im Vordergrund, wird man eher Apixaban oder die niedrigere Dosierung von Dabigatran wählen. Bevorzugt man die einmalige Gabe des Medikamentes pro Tag, kommen Rivaroxaban und Edoxaban infrage.
4) Welches Antikoagulans bei Tumorpatienten?
Heparine resp. «low molecular weight heparins» (LMWH) haben sich bei Tumorpatienten gegenüber VKA etabliert; in stabilen (und nicht thrombopenen) Phasen sind äquivalente Effekte für Edoxaban13 und Apixaban14 im Vergleich zu LMWH dokumentiert worden, in einer retrospektiven Analyse ebenso für Rivaroxaban.15–20
5) In welchen Situationen und nach welcher Zeit kann die Dosierung reduziert werden?
Mit Rivaroxaban und Apixaban wurde bei der VTE-Prophylaxe gezeigt, dass die Dosierung nach 6 Monaten ohne Nachteil resp. ohne Effektverlust halbiert werden konnte und nach der Dosisreduktion tendenziell weniger Blutungen auftraten.21–23 Cave: Dies gilt nicht bei Vorhofflimmern und bei Hochrisiko-Situationen (rote Risikokategorie, BMI>40kg/m2, schwere familiäre Thrombophilie-Formen) ist Vorsicht geboten. Bei Niereninsuffizienz muss die Dosis angepasst/reduziert werden (s. Punkt 7).
6) Wann ist eine Spiegelbestimmung sinnvoll?
Die grossen Studien wurden ohne Spiegelkontrollen und in Fixdosierungen durchgeführt; deshalb sind Spiegelbestimmungen allgemein nicht notwendig. Dosisanpassungen aufgrund der Plasmaspiegel werden nicht empfohlen. Dennoch gibt es einige Situationen, in denen die rasche Spiegelbestimmung hilfreich sein kann (zu hohe Spiegel bei Blutungen, zu niedrige Spiegel bei Durchbruchs-TE trotz AK). Typischerweise wird in Analogie zu den LMWH-Messungen entweder der Spitzenspiegel 3–4h nach Gabe (Effektivität?), oder der Talspiegel vor Gabe (Toxizität/zu hohe Werte?) gemessen. Beispiele dazu sind: Frage der Compliance bei thrombotischem Ereignis (Spiegel nahezu 0), Frage der Überdosierung (inkl. Suizidversuche) bei Blutungen, Spiegelbestimmung bei ischämischem Schlaganfall vor allfälliger Lysetherapie, Blutungen im Alter und bei Organinsuffizienz, bei Verdacht auf Medikamenteninteraktionen, vor dem Entscheid des Einsatzes von Antagonisten, vor dringenden (neuro-)chirurgischen (Notfall-)Eingriffen.
7) Welches Vorgehen bei Niereninsuffizienz?
Bei Niereninsuffizienz wird die Dosis angepasst/reduziert: Bei einer Kreatinin-Clearance von (15–)30–50ml/min wird Rivaroxaban von 20 auf 15 mg, Apixaban von 2 x 5 mg auf 2 x 2,5 mg und Edoxaban von 60 auf 30 mg reduziert (Tab. 2).
Tab. 2: Dosisanpassungen entsprechend der Leber- und Nierenfunktion (modifiziert nach Steffel et al., 2018)23
8) Wie wird perioperativ vorgegangen?
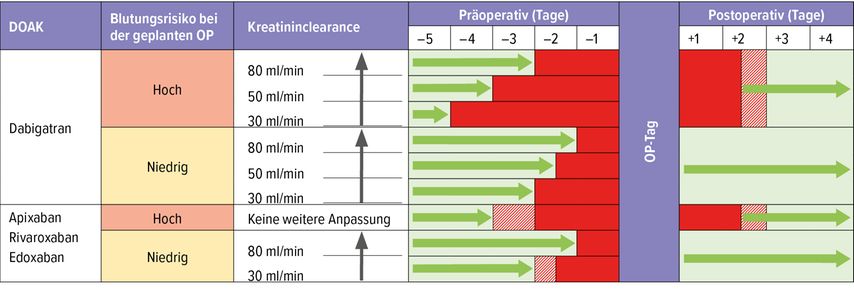
Das perioperative Vorgehen ist in Tabelle 3 dargestellt. Im Vergleich zum Vorgehen mit VKA hat es sich vereinfacht, führt aber weiterhin zu vielen Fragen und auch Missverständnissen (oft wird fälschlicherweise viel zu lange vor einem Eingriff abgesetzt). Die postoperative Überlappung zeigt den Spielraum beim Wiederbeginn.
Tab. 3: Perioperatives Management von DOAK je nach Blutungsrisiko des Eingriffs und Nierenfunktion. Der postoperative Overlap illustriert den Ermessensentscheid des Operateurs zum Wiederbeginn der Antikoagulation. Die rot schraffierten Felder zeigen die Flexibilität des Unterbrechungs- und Wiederaufnahmeschemas von DOAK, die vom Blutungs- und Thromboserisiko sowie prozeduralen Faktoren des Patienten abhängt (modifiziert nach Veitch et al., 2021; Douketis et al., 2019; Dubois et al., 2017)24–26
9) Wie ist das Vorgehen bei Adipositas oder nach Magen-Bypass-Operation?
Bei einem BMI>40kg/m2 sind die Daten knapp. Soweit vorhanden, scheinen jedoch Apixaban27 und Edoxaban28 gleich gut oder besser als VKA abzuschneiden.29–31 Bei Zweifeln zur Frage der Resorption ist hier eine Spiegelbestimmung angemessen; bei subtherapeutischen Spiegeln ist ein Wechsel auf VKA zu erwägen. Da Rivaroxaban nahrungsabhängig aufgenommen wird, ist hier Vorsicht am Platz.32, 33
10) Ist es möglich zu antagonisieren?
Ja, es stehen sehr gut charakterisierte, spezifische und potente parenterale Antagonisten zur Verfügung: Idarucizumab für das Dabigatran und Andexanet alpha für die FXa-Hemmer Rivaroxaban und Apixaban. Sie werden jedoch noch relativ selten gebraucht, auch wegen der relativ kurzen Halbwertszeit der DOAK und wegen des Preises. Alternativ kann PCC (Prothrombinkomplex-Konzentrat) zum Einsatz kommen, dies in relativ hoher (cave: Thrombosen) Dosierung von 50E/kg.34, 35
Und generell: Wie vermeide ich «einsame» Entscheide, resp. wie federe ich sie ab?
Am besten durch den Einbezug aller involvierten Spezialisten «am runden Tisch», den Einsatz der klassischen Guidelines36,37 und die Meinung des Patienten («No decision about the patient without the patient.»). Hilfreich sind auch vordefinierte Reevaluations-Intervalle, z.B. 1–3-monatlich initial, später 6-monatlich durch den Hausarzt unter Berücksichtigung von Blutungen, TE-Ereignissen, Verträglichkeit, neuen Erkenntnissen, Hb, Nierenfunktion etc. im Verlauf, Einfluss von neuen Diagnosen, neuen Medikamenten etc.).
Literatur:
1 Kearon C et al.: J Thromb Haemost 2016; 14: 1480-3 2Khan F et al.: Ann Intern Med 2021; 174: 1420-9 3 Konstantinides SV et al.: Eur Heart J 2019; 41: 543-603 4 Khan F et al.: BMJ 2019; 366: l4363 5 Áinle FN, Kevane B: Blood Adv 2020; 4: 5595-06 6 Lip GY et al.: J Am Coll Cardiol 2011; 57: 173-80 7 Hindricks G et al.: Eur Heart J 2021; 42: 373-4988 Friberg L et al.: Eur Heart J 2012; 33: 1500-10 9Gage BF et al.: Am Heart J 2006; 151: 713-9 10 Rodeghiero F et al.: J Thromb Haemost 2010; 8: 2063-5 11 Chan NC, Eikelboom JW: Blood 2019; 133: 2269-78 12 Lüscher TF et al.: Eur Heart J 2021; 43: 940-58 13 Raskob GE et al.: N Engl J Med 2018; 378: 615-24 14 Agnelli G et al.: N Engl J Med 2020; 382: 1599-1607 15 Key NS et al.: J Clin Oncol 2020; 38: 496-520 16 Lyman GH et al.: Blood 2021; 5: 927-74 17Costa OS et al.: Blood 2020; 4: 4045-51 18Klemen N et al.: J Clin Oncol 2022; 40: 320-3 19 Li A et al.: Thromb Res 2019; 173: 158-63 20 Pernod G et al.: J Med Vasc 2020; 45: 6S17-6S23 21 Carlin S, Eikelboom JW: J Thromb Haemost 2021; 19: 2680-6 22 Diener HC et al.: Eur Heart J 2016; 38: 860-8 23 Steffel J et al.: Eur Heart J 2018; 39: 1330-93 24 Veitch AM et al.: Gut 2021; 70: 1611-28 25Douketis JD et al.: JAMA Intern Med 2019; 179: 1469-78 26 Dubois V et al.: Thrombosis J 2017; 15: 14 27Sulaiman KA et al.: Thrombosis J 2022; 20: 25 28Boriani G et al.: J Clin Medicine 2021; 10: 2879 29 Martin K et al.: J Thromb Haemost 2016; 14: 1308-13 30 Wang TF, Carrier M: Blood 2020; 135: 904-11 31 Martin K et al.: J Thromb Haemost 2016; 14: 1308-13 32 Shaikh F et al.: Front Cardiovasc Med 2021; 8: 732828 33 Spyropoulos AC et al.: Thromb Res 2019; 182: 159-66 34 White K et al.: Br J Cardiol 2022; 29: 1 35 Bonetti N. et al.: Cardiovasc Med 2014; 17: 213-20 36 Chen A et al.: J Am Heart Assoc 2020; 9: e017559 37 Ziswiler T, Beer JH: der informierte arzt 2022
Das könnte Sie auch interessieren:
Mehr als nur eine trockene Angelegenheit: Die Sjögren-Erkrankung im Fokus
Die Sjögren-Erkrankung (SjD) ist eine chronisch-entzündliche, systemische Autoimmunerkrankung mit hoher klinischer Variabilität. Sie gehört zur Familie der Kollagenosen, zu der ...
Tinnitusmanagement 2025
Die Behandlung von Tinnitus hat sich in den letzten Jahren weiterentwickelt. Die AWMF-Leitlinien zum Tinnitusmanagement bieten evidenzbasierte Empfehlungen zur Diagnostik und Therapie ...
Restless-Legs-Syndrom
Das Restless-Legs-Syndrom (RLS) kann die Lebensqualität der Betroffenen erheblich beeinträchtigen. Welche Störungen dem RLS zugrunde liegen, welche Symptome es auslöst und wie Diagnostik ...