Klinisches Management bei TIA, Stroke Mimic und Stroke-Chamäleon
Oberarzt, Neurologische Klinik und Stroke Center<br>Stv. Leiter der Stroke Unit<br>Neurologische Klinik und Stroke Center<br>Universitätsspital Basel<br>Petersgraben 4, 4031 Basel<br>E-Mail: gian.demarchis@usb.ch
Neurologische Klinik und Stroke Center<br>Universitätsspital Basel
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
In diesem Beitrag gehen wir folgenden Fragen nach: Wann ist eine ambulante Behandlung bei Patienten mit TIA vertretbar? Falls ein Patient mit einem Stroke Mimic mittels intravenöser Thrombolyse behandelt wird, wie gross ist das Risiko für eine intrakranielle Blutung? Wie oft werden Hirnschläge initial fehldiagnostiziert (Stroke-Chamäleons) und wie ist ihre Prognose?
Keypoints
-
Bei klinischem Verdacht auf TIA empfehlen wir ein notfallmässiges Schädel-MRI und eine Karotisbildgebung (Angio-CT, -MRI oder Karotis-Ultraschall), deren Ergebnisse in den ABCD3-I-Score einfliessen. Bei einem ABCD3-I-Score >7 beträgt das 7-Tages-Hirnschlagrisiko 10% – eine Hospitalisierung wird empfohlen. Ein ABCD3-I-Score ≤7 Punkte wird bei gut 80% der Patienten beobachtet – eine ambulante Behandlung ist hierbei vertretbar.
-
Unabhängig vom ABCD3-I-Score soll die antithrombotische Behandlung möglichst rasch verabreicht werden.
Ein rascher Beginn vermindert das Risiko für Hirnschläge um das Fünffache. Eine duale Plättchenhemmung empfehlen wir bei einem ABCD2-Score >4 oder einem NIHSS ≤3 (Aspirin 100mg und Clopidogrel 75mg). Die Dauer der dualen Plättchenhemmung beträgt
3 Wochen, anschliessend wird eine Monoantiaggregation auf Dauer empfohlen. -
Bei Stroke Mimics ist das Risiko für intrakranielle Blutungen unter systemischer Thrombolyse geringer als bei ischämischem Schlaganfall.
-
Stroke-Chamäleons – initial fehldiagnostizierte Hirnschläge – sind häufiger bei jüngeren Patienten ohne bekanntes zerebrovaskuläres Risikoprofil und haben eine ungünstigere Prognose, nicht zuletzt wegen der verpassten Chance einer Thrombolyse.
Transitorische ischämische Attacke (TIA)
ABCD2- und ABCD3-I-Score
Das Risiko, in den ersten sieben Tagen nach einer TIA einen ischämischen Schlaganfall zu erleiden, liegt über alle Patientengruppen hinweg bei ca. 2%.1
Eine individuellere Abschätzung dieses Risikos ermöglichen der sog. ABCD2- und der ABCD3-I-Score, welche zu den gebräuchlichsten Risikoscores zählen (Tab. 1). Dabei sind vor allem drei Faktoren massgeblich: An erster Stelle stehen klinische Parameter, die im ABCD2-Score zusammengefasst sind. Dazu zählen Alter, Blutdruck, Art und Dauer der Symptome sowie das Vorhandensein eines Diabetes mellitus.1 Die nächsten beiden Punkte, welche Einzug in den ABCD3-I-Score gehalten haben, sind die Schädel-MRT und die Karotisbildgebung.1 Die Schädel-MRT dient der Klärung der Frage nach akuten zerebralen Ischämien und sollte noch gleichentags durchgeführt werden. Ein Vorhandensein akuter Ischämien führt zu einer Erhöhung des Risikos für nachfolgende Schlaganfälle.1 Zur Darstellung der Karotiden eignen sich sowohl der Ultraschall als auch die CT- oder MR-Angiografie. Dabei haben insbesondere die Patienten mit stenosierenden atherosklerotischen Plaques im Bereich der grossen hirnversorgenden Arterien ein hohes Risiko, nach einer vorausgegangenen TIA einen ischämischen Schlaganfall zu entwickeln.1, 3
Der ABCD3-I-Score ist dank bildmorphologischer Parameter zuverlässiger als der ABCD2-Score in der Identifikation derjenigen Patienten mit dem höchsten Risiko für einen Schlaganfall nach TIA.1
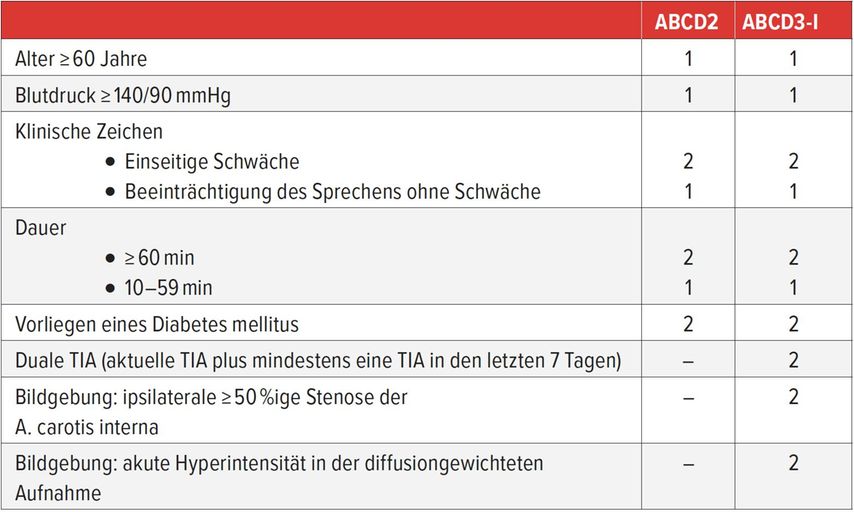
Tab. 1: ABCD2- und ABCD3-I-Score (adaptiert nach Song et al.)2
Ambulante oder stationäre Abklärung?
Der ABCD3-I-Score bietet sich als pragmatische Entscheidungsgrundlage bei der Frage an, ob ein Patient mit durchgemachter TIA zur Überwachung und für die weiterführende Abklärung stationär aufgenommen werden sollte oder ob eine ambulante Abklärung vertretbar ist. Liegt der ABCD3-I-Score >7 Punkte, empfiehlt sich eine stationäre Zuweisung (Abb. 1). 80% der Patienten mit TIA weisen einen ABCD3-I-Score ≤7 Punkten auf und können somit ambulant abgeklärt werden.4 Der Schlüssel zur Senkung des Schlaganfallrisikos in den ersten Tagen nach TIA – unabhängig davon, ob im ambulanten oder stationären Umfeld – ist der rasche Beginn einer antithrombotischen Therapie, wie die EXPRESS-Studie gezeigt hat.5 Eine duale Plättchenhemmung (Acetylsalicylsäure/Clopidogrel) wird bei ABCD2 ≥4 oder NIHSS ≤3 empfohlen. Als Dauer werden 3Wochen empfohlen, gefolgt von einer Monoantiaggregation auf Dauer.6
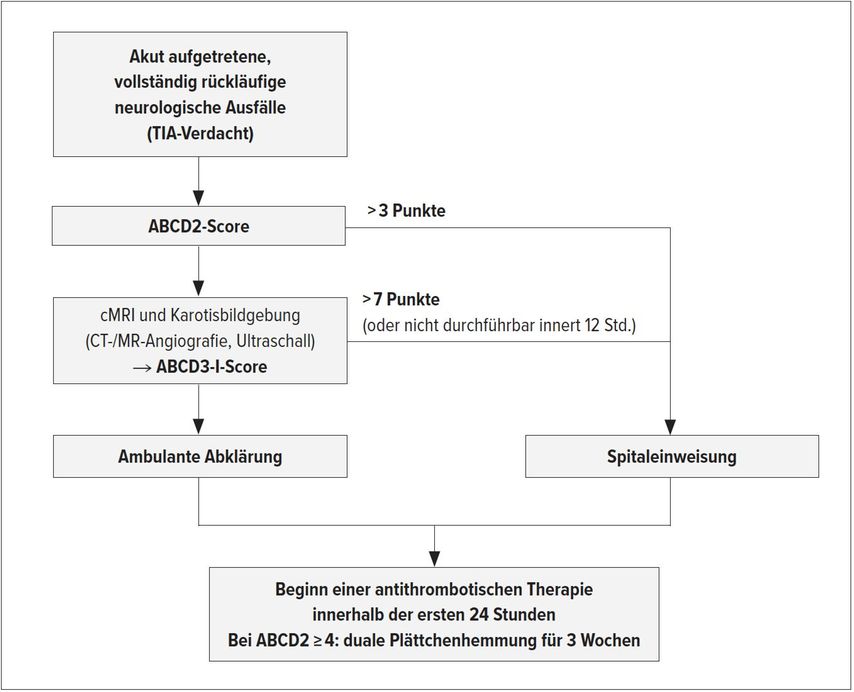
Abb. 1: Algorithmus bei Verdacht auf eine transitorische ischämische Attacke (TIA)
Stroke Mimics
Zur etablierten Akutbehandlung des ischämischen Schlaganfalls innerhalb der ersten 4,5 Stunden nach Symptombeginn zählt die systemische Thrombolyse.7 Innerhalb dieses Zeitfensters gilt: Je früher der Beginn, desto wirksamer ist sie. Bis zu 10% der Patienten, die eine intravenöse Thrombolyse erhalten, haben retrospektiv ein sogenanntes «Stroke Mimic».7 Unter Stroke Mimics versteht man Zustandsbilder, die durch ihre klinische Präsentation initial nicht, nur schwer oder nur mittels zeitaufwendiger Abklärungen von einem Schlaganfall unterschieden werden können. Zu den drei häufigsten Vertretern zählen dabei die Migräne mit Aurasymptomatik, epileptische Anfälle (z.B. mit postiktaler Lähmung oder Sprachstörung) und psychogene Symptome.7 Im klinischen Kontext stellt sich die Frage, wie man Patienten mit akut aufgetretenen neurologischen Defiziten ohne richtungsweisenden Befund in der initialen kranialen Bildgebung behandelt. Dabei befinden wir uns in einem Spannungsfeld zwischen dem zeitlichen Aspekt als wichtigstem Faktor für den Erfolg einer Therapie des Hirnschlags einerseits und schweren Blutungskomplikationen unter intravenöser Thrombolyse bei Stroke Mimics andererseits. Das Risiko für symptomatische intrakranielle Blutungen bei Stroke Mimics unter intravenöser Thrombolyse ist etwa 10-mal niedriger als bei Patienten mit ischämischem Schlaganfall (0,5% vs. 5%).7 Trotzdem bleiben eine sorgfältige Anamnese und eine neurologische Untersuchung zur Fahndung nach Alternativdiagnosen unerlässlich.7 Sicherheitsbedenken sollten, bei begründetem Verdacht auf ein ischämisches zerebrovaskuläres Ereignis und Fehlen von Kontraindikationen, jedoch kein Ausschlusskriterium für die Thrombolyse sein.7
Stroke-Chamäleons
Die Kehrseite der Medaille der StrokeMimics bilden die sogenannten Stroke-Chamäleons. Darunter versteht man klinische Erscheinungsbilder, welche initial fälschlicherweise nicht als ischämischer Hirnschlag identifiziert wurden.8 Etwa 2% aller akuten Schlaganfälle werden initial fehldiagnostiziert.8 Von diesen Patienten hätte im Nachhinein einer von vier für die intravenöse Thrombolyse qualifiziert.8 Erwartungsgemäss weisen Patienten mit Stroke-Chamäleons eine höhere 12-Monats-Mortalität und eine stärkere funktionelle Beeinträchtigung auf.8 Besonders bei jüngeren Patienten ohne bekanntes zerebrovaskuläres Risikoprofil werden akute ischämische Schlaganfälle initial häufiger übersehen.8 Zudem gibt es andere Krankheitsbilder, welche einen akuten ischämischen Hirnschlag maskieren können.8 Patienten mit Stroke-Chamäleons präsentieren sich häufiger mit leichteren Symptomen eines Hirnschlages oder sind komatös, haben weniger oder keine objektivierbaren fokalen neurologischen Defizite und zerebelläre Infarkte.8 Der akute Hirnschlag sollte somit auch bei unklaren neurologischen Zustandsbildern früh in differenzialdiagnostische Überlegungen miteinbezogen werden.
Literatur:
1 Kelly PJ et al.: Lancet Neurol 2016; 15: 1238-472 Song B et al.: Stroke 2013; 44: 1244-8 3 Giarola BF et al.: Cerebrovasc Dis Extra 2018; 8: 101-5 4 Kiyohara T et al.: Stroke 2014; 45: 418-25 5 Rothwell PM et al.: Lancet 2007; 370:1432-426 Hao Q et al.: BMJ 2018; 363: k5108 7 Tsivgoulis G et al.: Stroke 2015; 46:1281-7 8 Richoz B et al.: Neurology 2015; 85: 505-11
Das könnte Sie auch interessieren:
Mehr als nur eine trockene Angelegenheit: Die Sjögren-Erkrankung im Fokus
Die Sjögren-Erkrankung (SjD) ist eine chronisch-entzündliche, systemische Autoimmunerkrankung mit hoher klinischer Variabilität. Sie gehört zur Familie der Kollagenosen, zu der ...
Tinnitusmanagement 2025
Die Behandlung von Tinnitus hat sich in den letzten Jahren weiterentwickelt. Die AWMF-Leitlinien zum Tinnitusmanagement bieten evidenzbasierte Empfehlungen zur Diagnostik und Therapie ...
Restless-Legs-Syndrom
Das Restless-Legs-Syndrom (RLS) kann die Lebensqualität der Betroffenen erheblich beeinträchtigen. Welche Störungen dem RLS zugrunde liegen, welche Symptome es auslöst und wie Diagnostik ...