Regulation des Eisenstoffwechsels
Körpereigenes Eisen gelangt nicht nur aus unterschiedlichen Kompartimenten in den Blutkreislauf. Es wird auch in verschiedenen Organen in zum Teil erheblichen Mengen gespeichert.1 Der Eisengehalt in Blut und Speicher kann mit verschiedenen Biomarkern gemessen werden. Ein Verständnis der Eisenstoffwechselregulation ist dafür zentral.
Hepcidin und Erythroferron: zwei wichtige Regulatoren des Eisenstoffwechsels
Hepcidin wird in der Leber exprimiert und reguliert die Eisenkonzentration im Plasma, indem es den Eisentransporter Ferroportin hemmt. Dadurch wird im Darm weniger Eisen durch die Nahrung aufgenommen und der Rücktransfer von Eisen aus den Makrophagen wird gehemmt. Die Ausschüttung von Hepcidin wird durch verschiedene Faktoren beeinflusst. Ein Eisenmangel beispielsweise führt dazu, dass die Hepcidinfreisetzung supprimiert wird. Auf diese Weise wird mehr Eisen aus der Nahrung resorbiert, aber auch vermehrt Eisen aus den Makrophagen freigesetzt. Ein weiterer wichtiger Regulator des Eisenstoffwechsels ist das Hormon Erythroferron. Eine gesteigerte Erythropoese hat eine vermehrte Erythroferronsynthese zur Folge. Diese supprimiert die Freisetzung von Hepcidin in der Leber, sodass die Eisenverfügbarkeit zunimmt. Zu den Faktoren, die die Hepcidinsynthese stimulieren, gehören Entzündungsmediatoren, wie beispielsweise Interleukin 6. Das führt dazu, dass der Eisenbedarf nicht ausreichend gedeckt werden kann, weil das Eisen in der Darmzelle und den Makrophagen festgehalten wird.2
«Ein Eisenmangel mit/ohne Anämie führt zu zwei Bedürfnissen: Die Erythropoese muss angeschaltet und Eisen verfügbar gemacht werden. Beide Signale, das Erythropoesesignal über Erythroferron und der Mangel an Eisen, bremsen die Hepcidinfreisetzung. Dadurch werden die Schleusen der Darmzellen und des retikulozytären Systems geöffnet, um Eisen zu mobilisieren und für die Erythropoese verfügbar zu machen.»
A. von Eckardstein, Zürich
Bei welchen Patienten sollte man nach einem Eisenmangel suchen?
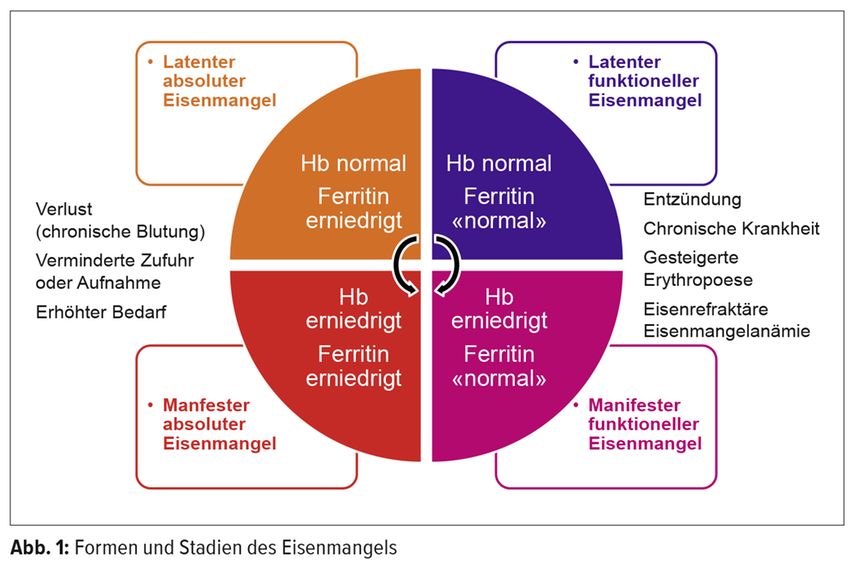
Neben der Einteilung in einen latenten und einen manifesten Eisenmangel, wird zusätzlich zwischen einem absoluten und einem funktionellen Eisenmangel unterschieden (Abb. 1).
Vor allem der funktionelle Eisenmangel ist schwierig zu diagnostizieren. Um einem funktionellen Eisenmangel auf die Spur zu kommen, ist es wichtig, an die zahlreichen klinischen Manifestationen zu denken.3 Nach einem Eisenmangel gesucht werden sollte bei Personen mit klassischen Zeichen, wie einer Anämie und klinischen Symptomen. Daneben gibt es eine grosse Gruppe von Personen, bei denen man unabhängig von der Symptomatik einen Eisenmangel ausschliessen oder diagnostizieren sollte. Dazu gehören u. a. Personen mit akuten und chronischen Blutungen. An einen funktionellen Eisenmangel gedacht bzw. gesucht werden sollte insbesondere bei Personen mit chronischen Erkrankungen, beispielweise einer Herzinsuffizienz.
Mit welchen Tests sollte man nach einem Eisenmangel suchen?
Die empfohlene Diagnostik bei einer Eisenmangelanämie umfasst gemäss den meisten Guidelines die Bestimmung von Hämoglobin, Ferritin, Transferrinsättigung und CRP.
Ferritin gibt Auskunft über den Eisenspeicher und reflektiert den Eisenstatus. Aus analytischer Sicht sind die erhebliche Methodenabhängigkeit und die schlechte Reproduzierbarkeit ein Schwachpunkt. Die Transferrinsättigung gibt das Verhältnis von Eisen zu Transferrin im Serum an und ist der wichtigste Parameter zur Diagnose einer Hämochromatose.
Ein verbreiteter Parameter der erweiterten Eisenstoffwechseldiagnostik ist der lösliche Transferrinrezeptor. Dieser kann bei Patienten mit erhöhten CRP-Werten (≥ 5 mg/l) und normalen Ferritinwerten Hinweise auf einen funktionellen Eisenmangel liefern. Problematisch bei der Bestimmung des löslichen Transferrinrezeptors ist ebenfalls die starke Methodenabhängigkeit.
Wie sollte das Labor einen Eisenmangel berichten?
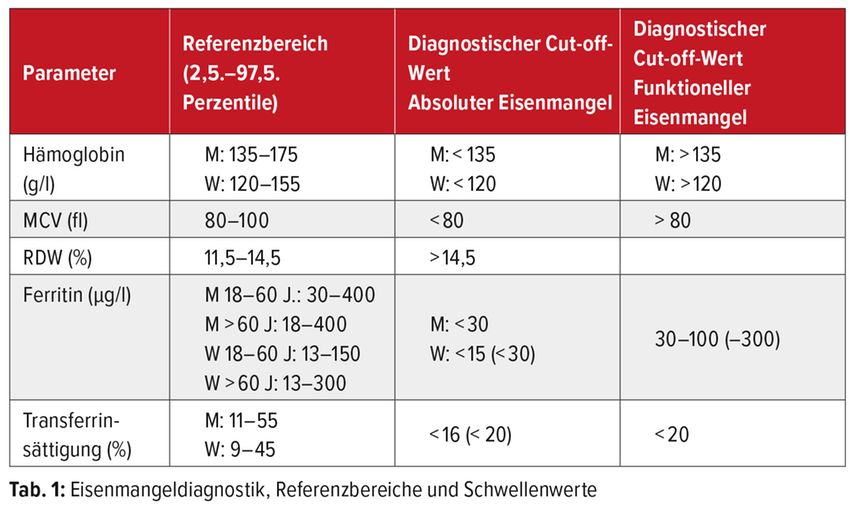
Der Referenzbereich in der Eisendiagnostik liegt zwischen der 2,5. und 97,5. Perzentile. Während die diagnostischen Cut-off-Werte des Hämoglobins mit dem angegebenen Referenzbereich übereinstimmen, ist das bei anderen Parametern oft nicht der Fall (Tab. 1).
Für Patienten mit entzündlichen oder chronischen Erkrankungen sind die angegebenen Cut-off-Werte für das Ferritin ungeeignet. So sollte beispielsweise bei Patienten mit chronischer Herzinsuffizienz und einem Ferritin < 100 µg/l oder einem Ferritin von 100–299 µg/l und einer Transferrinsättigung < 20 % eine i.v. Eisensubstitution in Erwägung gezogen werden.
Um das Problem besser sichtbar zu machen, hat man sich am Universitätsspital Zürich darauf verständigt, die Ferritinwerte zweimal zu berichten. Einmal den Messwert im Verhältnis zum normalen Referenzbereich und einmal bei erhöhtem Risiko (Tab. 2). Diese differenzierte Darstellung habe sich in der Klinik bewährt.
Bericht: Regina Scharf, MPH; Redaktorin
Quelle:
Referat von Prof. Dr. med. Arnold von Eckardstein, Institut für Klinische Chemie, Universitätsspital Zürich, im Rahmen der Iron Academy, 19. November 2020, Zürich
Literatur
1. Blum HE, Müller-Wieland D: Klinische Pathophysiologie. 10. Aufl. Stuttgart, New York, Delhi, Rio: Thieme Verlagsgruppe, 2018. S. 979
2. Sebastiani G: Pharmacological targeting of the hepcidin/ferroportin axis. Front Pharmacol 2016; 7: 160
3. Cappellini MD et al.: Iron deficiency anaemia revisited. J Intern Med 2020; 287: 153-70
4. Von Haehling S et al.: Iron deficiency in heart failure: an overview. JACC Heart Failure 2019; 7: 36-46