Eisentherapie bei Herzinsuffizienz: Wie ist die Datenlage?
Eisenmangel ist eine häufige Begleiterscheinung bei Patienten mit Herzinsuffizienz. Daten aus der Schweiz und Deutschland zeigen, dass circa die Hälfte aller Patienten mit Herzinsuffizienz und eingeschränkter linksventrikulärer Funktion (HFrEF) an Eisenmangel leidet. Dieser ist definiert als Ferritin < 100 µg/l oder ein Ferritin zwischen 100 und 299 µg/l und gleichzeitig eine Transferrinsättigung < 20 %.1 Ein Eisenmangel wirkt sich ungünstig auf die Symptome und die Prognose der Herzinsuffizienz aus.2, 3
Konsequenzen des Eisenmangels bei Herzinsuffizienz
Sowohl ein absoluter wie auch ein funktioneller Eisenmangel mit und ohne Anämie bei HFrEF sind möglich. Typische Ursache eines absoluten Eisenmangels bei Herzinsuffizienz ist ein Blutverlust, ausgelöst durch die Behandlung mit Antikoagulanzien oder Thrombozytenaggregationshemmern, beispielsweise bei Patienten mit einem Vorhofflimmern oder einer koronaren Herzkrankheit. Der funktionelle Eisenmangel ist auf die erhöhte Hepcidinsynthese infolge der chronischen Entzündung bei Herzinsuffizienz zurückzuführen. Der Eisenmangel beeinflusst nicht nur das hämatopoetische Gewebe, sondern auch viele andere Gewebe im Körper und führt über die Abnahme des Sauerstofftransports und der Sauerstoffaufnahme zu einer Abnahme der Leistungsfähigkeit bei den Betroffenen.4
Evidenz für die Eisensubstitution
Die heutigen Empfehlungen zur parenteralen Eisentherapie bei HFrEF basieren auf den Ergebnissen der FAIR-HF-Studie.5 Diese hat gezeigt, dass die parenterale Substitution von 200 mg Eisencarboxymaltose über 24 Wochen die Symptomatik, die funktionelle Kapazität und die Lebensqualität bei Patienten mit HFrEF und einer NYHA-Klasse II–III sowie einem Eisenmangel mit/ohne Anämie im Vergleich zu Placebo signifikant verbessern kann.
Die Ergebnisse konnten in einer anschliessenden Langzeitstudie bei Patienten mit HFrEF bestätigt werden.6 Eine neuere Untersuchung zeigt nun, dass die parenterale Eisensubstitution einen Einfluss auf die maximale Sauerstoffaufnahme (VO2max) und damit auf die Leistungsfähigkeit bei Patienten mit HFrEF hat. Während die VO2max unter der Standardtherapie (keine Eisensubstitution) innerhalb des 24-wöchigen Beobachtungszeitraums abnahm, blieben die Werte unter der wöchentlichen Eisensubstitution nahezu konstant.7
Die Antwort auf die viel gestellte Frage, warum eine parenterale anstelle der einfacheren und kostengünstigeren oralen Eisensubstitution empfohlen wird, lieferte die IRONOUT-HF-Studie.8 Diese zeigte, dass die orale Einnahme von hoch dosiertem Eisen-Polysaccharid bei Patienten mit HFrEF nur einen geringen Effekt auf das Ferritin und die Transferrinsättigung hatte.
«Seit fast 20 Jahren ist bekannt, dass die Anämie ein Parameter für die schlechte Prognose der Herzinsuffizienz ist. Später wurde klar, dass nicht allein die Anämie eine Rolle spielt, sondern der Eisenmangel.»
Michael Maeder, St. Gallen
Was empfehlen die Guidelines?
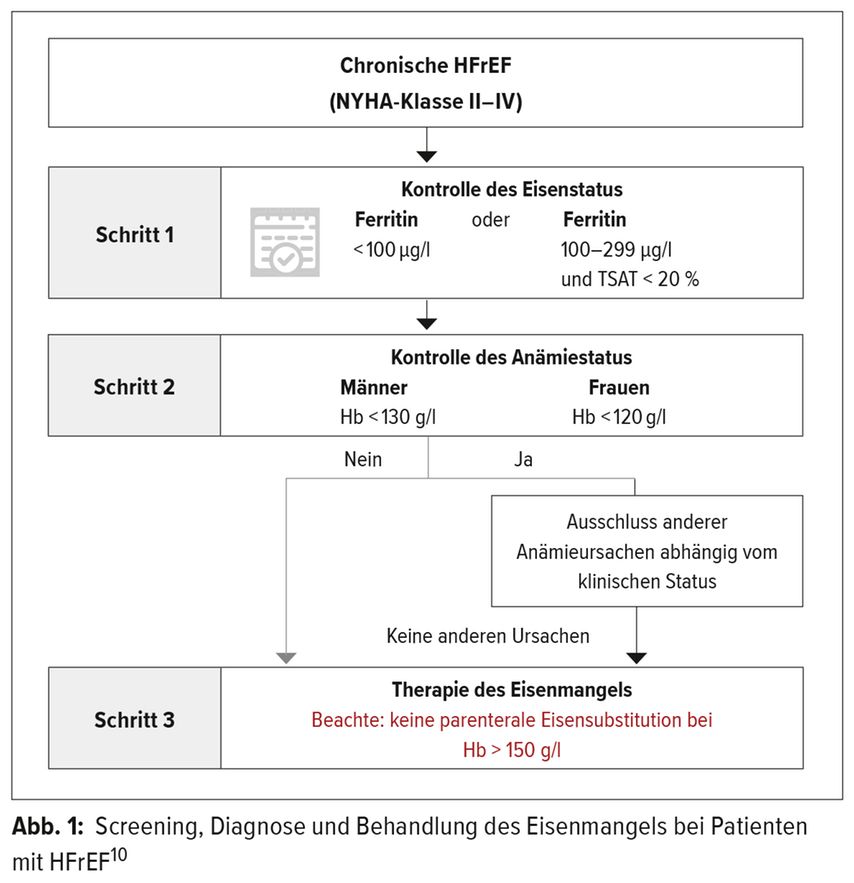
Die ESC-Guidelines empfehlen, bei Patienten mit Herzinsuffizienz einen Eisenstatus zu erheben (Klasse 1, Level C). Liegt ein Eisenmangel vor, sollte zunächst nach einer potenziell behandelbaren Ursache gesucht werden. Bei Patienten mit Ferritinwerten < 100 µg/l bzw. Ferritinwerten von 100–299 µg/l und einer Transferrinsättigung < 20 % kann zur Verbesserung der Symptomatik eine Eisensubstitution in Erwägung gezogen werden (Klasse 2a, Level A).9 Der optimale Zeitpunkt für die Eisensubstitution innerhalb des Behandlungsalgorithmus wurde von der ESC nicht festgelegt. Ein Vorschlag, wie sich die ESC-Empfehlungen praktisch umsetzen lassen, ist kürzlich publiziert worden (Abb. 1).10
Bislang gibt es keine Daten, die zeigen, dass die Eisensubstitution die Prognose von Patienten mit HFrEF verbessern kann. Die bisherigen Studiendaten, die eine Therapie des Eisenmangels unterstützen, werden durch die aktuellen Ergebnisse der AFFIRM-AHF-Studie ergänzt, die Mitte November 2020 am Kongress der American Heart Association vorgestellt worden sind.11 Diese zeigen, dass das Hospitalisationsrisiko von Patienten, die zuvor wegen akuter Herzinsuffizienz (EF < 50 %) und gleichzeitigem Eisenmangel im Spital behandelt wurden, durch eine parenterale Eisentherapie reduziert werden kann.
Bericht: Regina Scharf, MPH; Redaktorin
Quelle:
Referat von PD Dr. med. Micha Maeder, Klinik für Kardiologie, Kantonsspital St. Gallen, im Rahmen der Iron Academy, 19. November 2020, Zürich
Literatur
1. Wienbergen H et al.: Usefulness of iron deficiency correction in management of patients with heart failure [from the registry analysis of iron deficiency-heart failure (RAID-HF) registry]. Am J Cardiol 2016; 118: 1875-80
2. Jankowska EA et al.: Iron deficiency: an ominous sign in patients with systolic chronic heart failure. Eur Heart J 2010; 31: 1872-80
3. Klip IT et al.: Iron deficiency in chronic heart failure: an international pooled analysis. Am Heart J 2013; 165: 575-82.e3
4. van Veldhuisen DJ et al.: Anemia and iron deficiency in heart failure: mechanisms and therapeutic approaches. Nat Rev Cardiol 2011; 8: 485-93
5. Anker SD et al.: Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med 2009; 361: 2436-48
6. Ponikowski P et al.: Beneficial effects of long-term intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiency. Eur Heart J 2015; 36: 657-68
7. van Veldhuisen DJ et al.: Effect of ferric carboxymaltose on exercise capacity in patients with chronic heart failure and iron deficiency. Circulation 2017; 136: 1374-83
8. Lewis GD et al. Effect of oral iron repletion on exercise capacity in patients with heart failure with reduced ejection fraction and iron deficiency: the IRONOUT HF randomized clinical trial. JAMA 2017; 317: 1958-66
9. Ponikowski P et al.: 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016; 37: 2129-200
10. McDonagh T et al.: Screening, diagnosis and treatment of iron deficiency in chronic heart failure: putting the 2016 European Society of Cardiology heart failure guidelines into clinical practice. Eur J Heart Fail 2018; 20: 1664-72
11. Ponikowsli P et al.: Ferric carboxymaltose for iron deficiency at discharge after acute heart failure: a multicentre, double-blind, randomised, controlled trial. Lancet 2020; 396: 1895-904v
Kurzfachinformation
Ferinject®. Z: Eisencarboxymaltose. I: Eisenmangel, wenn orale Eisentherapie ungenügend wirksam, unwirksam oder nicht durchführbar ist. D: Die kumulative Gesamtdosis von Ferinject muss individuell berechnet werden. Ferinject kann als i.v. Infusion (verdünnt in 0,9% NaCl) oder als i.v. Injektion (unverdünnt) in wöchentlichen Einzeldosen von bis zu 20 mg/kg, maximal 1000 mg, bis zum Erreichen der berechneten kumulativen Gesamtdosis verabreicht werden. KI: Überempfindlichkeit gegenüber Wirkstoff oder Hilfsstoffen, Anämie ohne gesicherten Eisenmangel, Eisenüberladung, erstes Schwangerschaftstrimester. VM: Patienten vor jeder Verabreichung von Ferinject nach früheren UAW von i.v. Eisenpräparaten befragen. Nur anwenden, falls medizinisches Fachpersonal, das anaphylaktische Reaktionen bewerten und behandeln kann, sofort verfügbar ist, sowie nur in einer Einrichtung, in der alle Vorrichtungen zur Reanimation vorhanden sind. Patienten während mind. 30 Min. nach Verabreichung auf Anzeichen und Symptome einer Überempfindlichkeitsreaktion beobachten. Paravenöse Verabreichung kann eine braune Verfärbung und Reizung der Haut verursachen und ist deshalb zu vermeiden. Bei akuter oder chronischer Infektion, Asthma oder atopischen Allergien nur mit Vorsicht anwenden. Natriumgehalt von bis zu 5,5 mg/ml berücksichtigen. Parenterales Eisen kann zu Hypophosphatämie führen, in den meisten Fällen transient und ohne klinische Symptome. In Einzelfällen wurde bei Patienten mit bekannten Risikofaktoren und nach dauerhafter höherer Dosierung über behandlungsbedürftige Hypophosphatämie berichtet. S/S: KI im 1. Trimester, im 2. und 3. Trimester nur bei zwingender Indikation anwenden. Fetale Bradykardie kann infolge einer Überempfindlichkeitsreaktion der Mutter auftreten; Fetus sollte während der Verabreichung überwacht werden. UAW: Häufig: Hypophosphatämie, Kopfschmerzen, Gesichtsrötung (Flush), Schwindel, Hypertonie, Übelkeit, Reaktionen an der Injektions-/Infusionsstelle. Gelegentlich: Überempfindlichkeitsreaktionen vom Soforttyp, Parästhesien, Tachykardie, Hypotonie, Erröten, Dyspnoe, gastrointestinale Beschwerden, Dysgeusie, Hautausschlag, Pruritus, Urtikaria, Hautrötung, Myalgie, Rückenschmerzen, Arthralgie, Muskelkrämpfe, Gliederschmerzen, Fieber, Müdigkeit, Schmerzen im Brustkorb, peripheres Ödem, Schüttelfrost, Schmerz, Anstieg der AST, ALT, Gamma-GT, LDH und ALP. IA: Bei gleichzeitiger Verabreichung von oralen Eisenpräparaten ist deren Absorption reduziert. P: 5 Stechampullen zu 100 mg (2 ml) oder 500 mg (10 ml), 1 Stechampulle zu 500 mg (10 ml) oder zu 1000 mg (20 ml). Liste B. Detaillierte Informationen: www.swissmedicinfo.ch. Zulassungsinhaberin: Vifor (International) AG, CH-9001 St. Gallen. Vertrieb: Vifor AG, CH-1752 Villars-sur-Glâne. Stand: August 2020.