Interpretation des mikroskopischen Blutbildes
Autor:
Dr. med. Kornelius D. Arn
Leitender Arzt Hämatologie
Leiter Hämatologie-Labor
Luzerner Kantonsspital
Luzern
E-Mail: kornelius.arn@luks.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Interpretation von manuellen bzw.mikroskopischen Blutausstrichen bleibt auch im Zeitalter der Digitalisierung ein wichtiges diagnostisches Instrument, dessen Einsatz jedoch nur kombiniert mit der automatischen Blutbildanalyse und einer spezifischen Fragestellung Sinn macht. Meist ist es das Vorhandensein quantitativ abnormer oder qualitativ auffälliger Ergebnisse (Warnhinweise, «flags») in der automatischen Blutbildanalyse, welche als Reflexanalyse auf die Notwendigkeit einer manuellen Überprüfung des peripheren Blutbildes hinweisen.
Keypoints
-
Bei hämolytischen Anämien (mit oder ohne Thrombozytopenie) hilft der Blutausstrich, rasch gefährliche Ursachen, wie eine thrombotische Mikroangiopathie, zu diagnostizieren oder auszuschliessen.
-
Der Blutausstrich liefert bei unklaren Zytopenien oder «Zytosen» in vielen Fällen entscheidende Hinweise und ist oft richtungsweisend für die Differenzialdiagnose und weitere Abklärung.
-
Als unverzichtbare Untersuchung ist der Blutausstrich Eckpfeiler bei der Diagnose parasitischer Protozoen mit Blutbefall.
Die Untersuchung eines Blutausstrichs liefert in vielen klinischen Situationen als schnell verfügbare und apparativ einfache Untersuchung wichtige Informationen und kann als wesentlicher Bestandteil zur integrativen diagnostischen Abklärung beitragen. Um zuverlässige Ergebnisse zu gewährleisten, müssen präanalytische Faktoren berücksichtigt werden, welche die Qualität des Blutausstrichs beeinflussen können: Hierzu gehören das korrekte Antikoagulans (Ethylendiamintetraessigsäure, EDTA), das richtige Verhältnis von Blut zu Antikoagulans und eine zeitnahe Verarbeitung nach Blutentnahme, möglichst innerhalb von 2 bis 4 Stunden. Bei verzögerter Anfertigung eines Blutausstrichs kommt es zu degenerativen Veränderungen der zellulären Elemente des Blutes. Die Herstellung des Ausstrichpräparates erfolgt durch geschultes Personal, der getrocknete Ausstrich wird mit Methanol oder Ethylalkohol fixiert und mit einer Pappenheim-Färbung (May-Grünwald-Giemsa) angefärbt. Bei der mikroskopischen Beurteilung werden nebst der manuellen Differenzierung von 100–200 Leukozyten abnorme morphologische Befunde auf verschiedene Weise angegeben: 1. als einfache Beschreibung, 2. durch Verwendung von Begriffen wie vorhanden oder nicht vorhanden, 3. als semiquantitative Bestimmung: leicht (+), mässig (++), ausgeprägt (+++), oder 4. als quantitativer Prozentsatz der morphologischen Anomalien: normal (<5%), leicht (5–25%), mässig (25–50%), ausgeprägt (>50%) – wobei bestimmte morphologische Anomalien, z.B.Fragmentozyten, bereits bei niedrigeren Prozentzahlen eine grössere Bedeutung haben.
Beurteilung der Erythrozyten
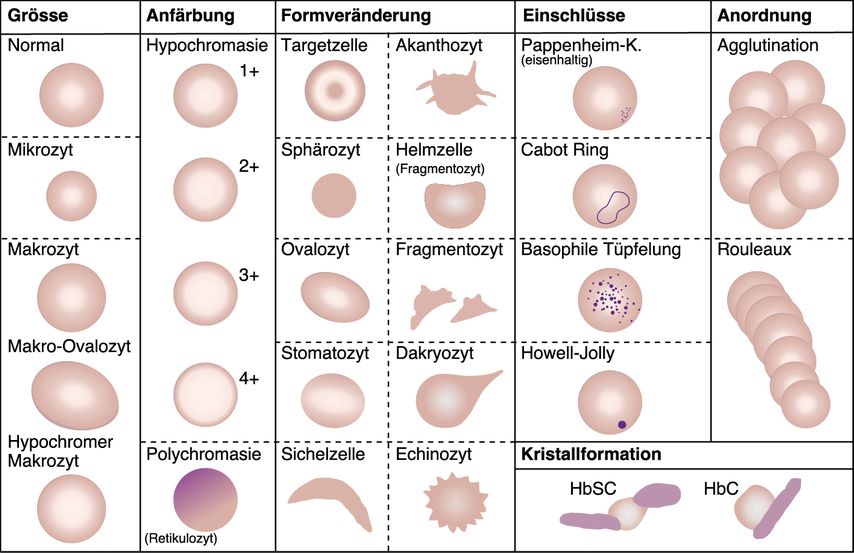
Die automatische Blutbildanalyse liefert eine genaue und präzise Erythrozytenzahl und die Erythrozytenindizes informieren über die Verteilung der Erythrozytenpopulation, deren Grösse und Hämoglobingehalt. Auf einem gefärbten Blutausstrich haben normale Erythrozyten einen Durchmesser von durchschnittlich 7,5µm und eine runde oder leicht ovale Form mit einer zentralen Aufhellung, die etwa das mittlere Drittel der Zelle einnimmt. Die mikroskopische Untersuchung der Erythrozyten identifiziert Anomalien in Bezug auf Grösse, Form und Färbung sowie das Vorhandensein von Einschlüssen (Abb. 1).
Abb. 1: Anomalien der Erythrozyten in Bezug auf Grösse, Form und Färbung sowie Vorhandensein von Einschlüssen (adaptiert nach Jones KW, 2009)
Grösse der Erythrozyten
Die Anisozytose beschreibt eine erhöhte Variabilität der Erythrozytengrösse. Sie ist unspezifisch und spiegelt sich in einer erhöhten Erythrozytenverteilungsbreite («red cell distribution width», RDW) wider. Als Mikrozyten bezeichnet man kleine Erythrozyten mit einem Durchmesser von weniger als 7µm (MCV<80fl), sie können mit einem verminderten Hämoglobingehalt (Hypochromasie) einhergehen. Makrozyten sind vergrösserte Erythrozyten mit einem Durchmesser von mehr als 8,5 µm, (MCV>100fl) und weisen eine runde oder ovale Form auf. Als interne Referenz zur Beurteilung der Erythrozytengrösse im mikroskopischen Blutbild dient die Kerngrösse eines kleinen Lymphozyten mit einem Durchmesser von ca. 8µm. Der Grad der Mikro- oder Makrozytose kann anhand des MCV-Werts genauer beurteilt werden und hilft entscheidend in der differenzialdiagnostischen Abklärung von Anämien. Typische Ursachen einer erythrozytären Mikrozytose mit oder ohne Anämie sind der Eisenmangel, die Anämie bei chronischer Erkrankung sowie die Thalassämien und Hämoglobinopathien. Eine erythrozytäre Makrozytose findet sich bei megaloblastärer (z.B. Vitamin-B12- oder Folsäuremangel) oder makroblastärer Erythropoiese (u.a. Alkoholismus, Lebererkrankungen, myelodysplastisches Syndrom, Hypothyreose).
Form der Erythrozyten
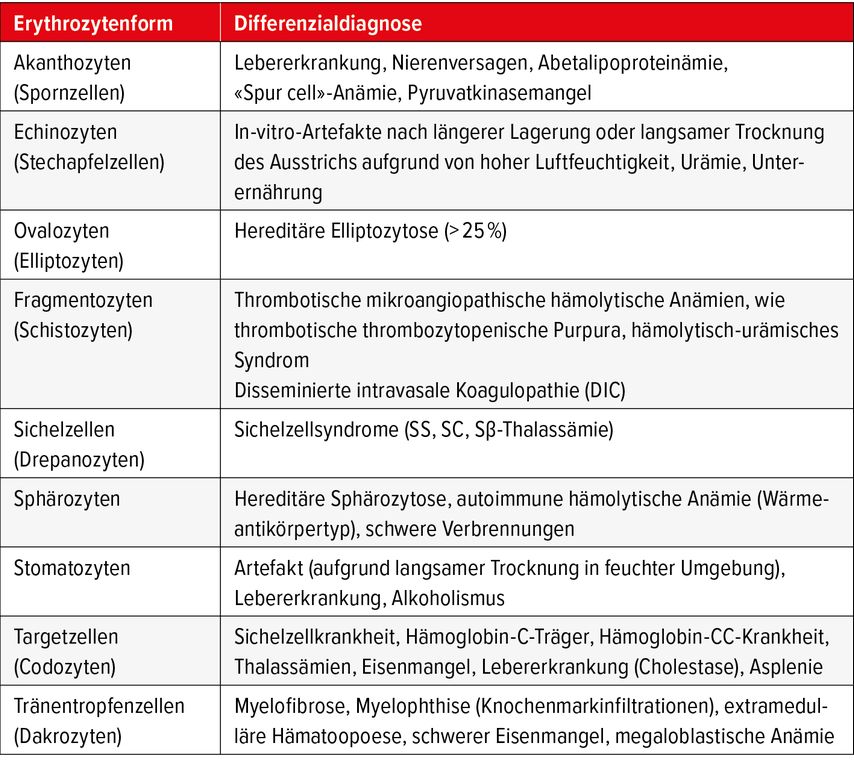
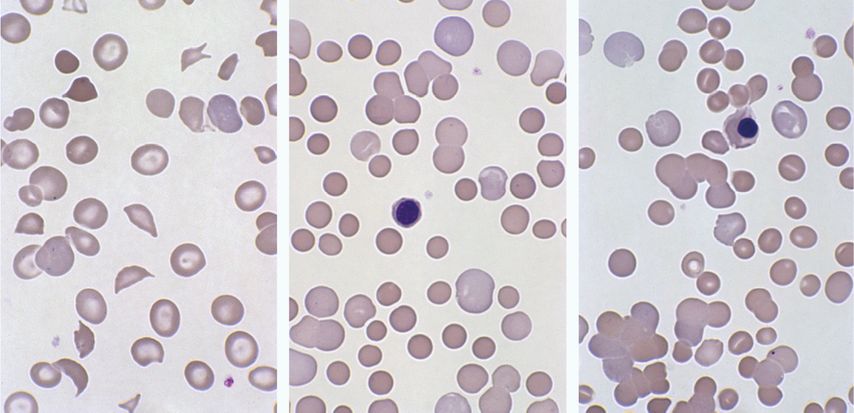
Die Poikilozytose bezeichnet Erythrozyten mit abnormaler Form und ist Ausdruck von Defekten der Membran und/oder des Zytoskeletts oder Folge der Präzipitation, Kristallisation oder Polymerisation des Hämoglobins. Je nach zugrunde liegender Pathologie sind ganz unterschiedliche Formvarianten bekannt, welche hier nicht abschliessend behandelt werden (Tab. 1). Vor allem bei der Differenzialdiagnose hämolytischer Anämien ist eine sorgfältige mikroskopische Beurteilung des roten Blutbildes wertvoll (Abb. 2). So kann der Nachweis von Fragmentozyten wichtige Hinweise auf eine mikroangiopathische hämolytische Anämie (thrombotisch-thrombozytopenische Purpura bzw. hämolytisch-urämisches Syndrom) liefern. Bei der autoimmunhämolytischen Anämie finden sich Mikrosphärozyten, welche durch einen Phagozytose-bedingten Verlust von Membranmaterial entstehen. Bei den angeborenen Membranopathien (hereditäre Sphärozytose, hereditäre Elliptozytose) sind die Sphäro- bzw. Elliptozyten durch Mutationen in Membranproteinen bedingt, welche zu einer veränderten Verformbarkeit der Erythrozyten und einem vermehrten Abbau in der Milz führen. Bei Verdacht auf eine Thalassämie oder Hämoglobinopathie kann der Nachweis z.B. von Targetzellen oder Sichelzellen ein diagnostischer Baustein sein, wobei hier zur Diagnosesicherung weitere Untersuchungen mittels Hämoglobin-Elektrophorese (HPLC) oder Molekulargenetik notwendig sind.
Abb. 2: Differenzialdiagnose hämolytischer Anämie. Links: thrombotisch-thrombozytopenische Purpura (TTP) mit mehreren Fragmentozyten. Mitte: autoimmun-hämolytische Anämie vom Wärmeantikörpertyp mit vielen Mikrosphärozyten, Polychromasie und einem Erythroblasten. Rechts: autoimmun-hämolytische Anämie vom Kälteantikörpertyp mit Agglutination der Erythrozyten
Erythrozyteneinschlüsse
Erythrozyteneinschlüsse sind meist Folge einer gestörten Reifung der Erythrozyten, einer oxidativen Schädigung der Zellen oder von Infektionen. Howell-Jolly-Körper sind Kernüberreste, die bei Patienten nach einer Splenektomie und bei anatomischer oder funktioneller Asplenie auftreten. Die basophile Punktierung, im Zytoplasma verteilte denaturierte RNA-Fragmente, ist mit Hämoglobinopathien (Thalassämien), Blei- oder Arsenvergiftungen und Zuständen mit gesteigerter Erythropoiese bzw.Dyserythropoiese assoziiert. Siderotische Granula oder Pappenheim-Körper werden bei Eisenverwertungsstörungen, wie sideroblastischen Anämien, beobachtet und müssen mittels Eisenfärbung bestätigt werde. Infektiöse Ursachen sind intrazelluläre Parasiten wie Plasmodien oder Babesien. Einige Erythrozyteneinschlüsse können nur mittels Supravitalfärbung (Retikulozytenfärbung) erkannt werden, hierzu gehören die Heinz-Körper (denaturiertes Hämoglobin bei Oxidationsschäden, G6PD-Mangel) oder Hämoglobin-H-Einschlüsse.
Anordnung der Erythrozyten
Nicht zuletzt kann auch die Anordnung der Erythrozyten Hinweise auf eine zugrunde liegende Krankheit geben – die Bildung von Rouleaux (Geldrollen) kann auf eine Paraproteinämie/Plasmazelldyskrasie hinweisen, eine Agglutination der Erythrozyten wird typischerweise bei der Kälteagglutininerkrankung beobachtet.
Beurteilung des weissen Blutbildes
Die Differenzierung der Leukozyten umfasst die Klassifizierung auf der Grundlage von Grösse, Kernform, Chromatinmuster sowie zytoplasmatischem Aussehen und Inhalt. Das moderne Hämatologie-Analysegerät liefert in den allermeisten Fällen präzise Leukozytenzahlen und eine korrekte Differenzierung der 5 wichtigsten Zelltypen: Lymphozyten, Monozyten, Neutrophile, Eosinophile und basophile Granulozyten. Bei Vorhandensein pathologischer Leukozytenpopulationen kann die automatische Zählung bzw.Differenzierung jedoch falsch sein, das Gerät gibt in diesen Fällen oft einen Warnhinweis («flag») an. Ein typisches Beispiel hierfür sind z.B. Haarzellen bei der Haarzell-Leukämie, welche zu den Monozyten gezählt werden können.
Leukozytenvorstufen
Reife Neutrophile haben einen segmentierten Zellkern mit 2 bis 5 Kernsegmenten, die durch einen dünnen Kernfaden verbunden sind. Zu den weniger reifen Formen gehören in dieser Reihenfolge stabkernige Neutrophile, Metamyelozyten, Myelozyten, Promyelozyten und Myeloblasten. Das Vorhandensein unreifer Granulozyten bzw. myeloischer Vorstufen im peripheren Blut wird von gewissen Analysegeräten angegeben und zum Teil sogar quantifiziert, jedoch ohne Unterscheidung der einzelnen Reifungsstufen. Diese Linksverschiebung wird reaktiv im Rahmen von schweren Infektionen bzw. nach Applikation von G-CSF («granulocyte-colony stimulating factor») oder aber pathologisch z.B. bei der chronischen myeloischen Leukämie gesehen, wobei die grosse Anzahl myeloischer Vorstufen und eine meist begleitende Eosino-/Basophilie für Letztere sprechen. Ein Nachweis von Blasten im peripheren Blut ohne Zeichen der Linksverschiebung ist verdächtig für das Vorliegen eines myelodysplastischen Syndroms mit Blastenvermehrung oder aber einer akuten Leukämie. Das Vorhandensein von Auerstäbchen ist beweisend für eine myeloische Neoplasie.
Neutrophile Granulozyten
Bei den neutrophilen Granulozyten werden die Kernkonfiguration (Segmentierung) und die Zytoplasmabeschaffenheit, insbesondere die Granulation, beurteilt. Als toxische Veränderungen gelten die vergröberte Granulation, die zytoplasmastische Vakuolisierung und der Nachweis von blass-bläulichen Einschlüssen, den Döhle-Körperchen. Die Hyposegmentierung (oft in Form sog. Pseudo-Pelger-Zellen) bzw. Hypersegmentierung der Neutrophilenkerne wie auch die Hypogranularität gelten als Dysplasie und werden so z.B. beim myelodysplastischen Syndrom, die Hypersegmentierung relativ typisch auch bei der megaloblastären Anämie (Vitamin-B12-Mangel) beobachtet.
Lymphozyten
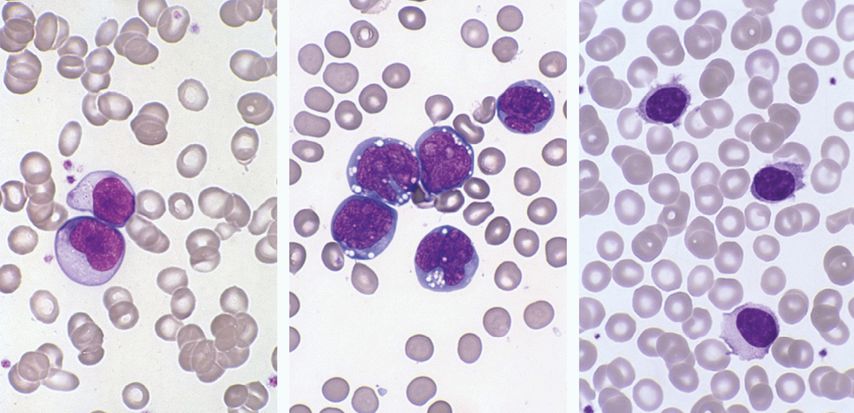
Die Terminologie der Lymphozyten ist nicht einheitlich geregelt und teilweise verwirrend, da viele verschiedene Begriffe verwendet werden, wie z.B. variante, reaktive, abnormale, aktivierte und atypische Lymphozyten. Verschiedene Fachgesellschaften haben Empfehlungen zur Klassifikation der Lymphozyten abgegeben, wie das European LeukemiaNet (ELN) oder die Arbeitsgruppe Laboratorium der DGHO. Diese unterscheidet typische von atypischen Lymphozyten, wobei Letztere wiederum unterteilt werden in «atypische Lymphozyten, vermutlich reaktiv» und «atypische Lymphozyten, vermutlich neoplastisch». Auch eine Arbeitsgruppe mehrerer grosser Laboratorien in der Deutschschweiz hat sich dieser Thematik angenommen und die Empfehlung der DGHO mehrheitlich übernommen (vorgestellt an der Swiss MedLab 2016). Grosse Lymphozyten mit zytoplasmatischen Granula, sog. LGL-Zellen («large granular lymphocytes»), werden zu den typischen Lymphozyten gezählt und entsprechen zytotoxischen T-Lymphozyten oder NK-Zellen; sie machen normalerweise weniger als 10% der Lymphozyten aus. Im Rahmen von (meist) viralen Infekten finden sich reaktiv veränderte Lymphozyten, welche sich in ihrer Morphologie vom typischen Lymphozyten unterscheiden. Daneben existieren ganz unterschiedliche maligne lymphoproliferative Erkrankungen der B- und T-Lymphozyten bzw. der natürlichen Killerzellen (NK-Zellen) mit leukämischer Ausschwemmung morphologisch atypischer lymphatischer Zellen mit oder ohne Lymphozytose (Abb. 3), wobei für die definitive Diagnosesicherung eine Immunphänotypisierung oder Histologie notwendig ist. Abnorme lymphatische Zellen, die einem bestimmten neoplastischen Zelltyp zugeordnet werden können, z.B. Haarzellen oder Sézary-Zellen, sollten als solche beschrieben werden. Kernschatten bzw. lädierte Zellen, welche bei der Ausstrichherstellung entstehen, können sowohl bei Infekten als auch bei Lymphomen (oft in grosser Zahl bei der chronischen lymphatischen Leukämie) vorkommen, die Bezeichnung «Gumprecht’sche Kernschatten» wird nur bei bestätigter CLL verwendet.
Abb. 3: Atypische Lymphozyten. Links: stark reaktiv veränderte Lymphozyten bei infektiöser Mononukleose (EBV). Mitte: Burkitt-Lymphom, grosse Lymphozyten mit tief basophilem Zytoplasma und grober Vakuolisierung. Rechts: Lymphozyten mit villösen Zytoplasmaausläufern bei splenischem Marginalzonen-Lymphom
Beurteilung der Thrombozyten
Thrombozyten sind kleine, kernlose «zelluläre Elemente», die im nicht aktivierten Zustand eine diskoide Form und einen Durchmesser von ungefähr 1–3 µm haben, das Zytoplasma ist fein azurophil granuliert. Die Anzahl der Thrombozyten und das Vorhandensein von kleinen, grossen und/oder riesigen Thrombozyten (Definition Riesenthrombozyt: grösser als ein Erythrozyt) wird im Blutausstrich kommentiert, ebenso das Vorhandensein von hypogranulären Thrombozyten. Grosse oder Riesenthrombozyten werden bei den (sehr seltenen) angeborenen Thrombozytopenien/-pathien oder aber meist mit assoziierter Thrombozytose bei den myeloproliferativen Neoplasien beobachtet. Bei der Pseudothrombozytopenie (am häufigsten bei Verwendung von EDTA, seltener auch bei Zitrat oder Heparin als Antikoagulans) finden sich im Blutausstrich Thrombozytenaggregate oder seltener die Adhäsion von Thrombozyten an Granulozyten oder Monozyten (Satellismus).
Literatur:
● Bain B: Diagnosis from the blood smear. N Engl J Med 2005; 353: 498-507 ● Baurmann H: Lymphozytenmorphologie im Blutausstrich. J Lab Med 2011; 35: 261-70 ● Chabot-Richards DS et al.: Does morphology matter in 2017? An approach to morphologic clues in non-neoplastic blood and bone marrow disorders. Int J Lab Hem 2017; 39 (Suppl. 1): 23-30 ● Gulati G et al.: Purpose and criteria for blood smear scan, blood smear examination, and blood smear review. Ann Lab Med 2013; 33: 1-7 ● Jones KW: Evaluation of cell morphology and introduction to platelet and white blood cell morphology. In: Harmening D (ed.). Clinical hematology and fundamentals of hemostasis. Philadelphia: F.A. Davis Co., 2009. 93-116 ● Palmer L et al.: ICSH recommendations for the standardization of nomenclature and grading of peripheral blood cell morphological features. Int J Lab Hem 2015; 37: 287-303 ● Swiss MedLab: Workshop «Lymphozytenmorphologie» vom 16.06.2016. www.sulm.ch/PDF/SML/Donnerstag_16-06-2016/16-06-2016_Morphologie-WS_SwissMedLab2016.pdf ● Zini G et al.: A European consensus report on blood cell identification. Br J Haematol 2010; 151: 359-64
Das könnte Sie auch interessieren:
Neue Empfehlungen für die Behandlung von akuten Atemwegsinfektionen im ambulanten Bereich
Die Schweizerische Gesellschaft für Infektiologie (SSI) hat neue Leitlinien zur Behandlung der akuten Atemwegsinfektionen im ambulanten Bereich erarbeitet.1 Noch bevor die Guidelines auf ...
Stürze bei älteren Menschen – potenziell fatal, aber auch vermeidbar
Stürze bei älteren Menschen sind häufig und mit schwerwiegenden Folgen assoziiert, werden aber oft aufgrund von Schamgefühl und kognitiven Einschränkungen von den Betroffenen nicht ...
Physikalische Therapien bei Arthritis – notwendig und sinnvoll?
Die Behandlung entzündlich-rheumatischer Gelenkerkrankungen hat sich in den letzten zwei Jahrzehnten durch die Einführung innovativer Medikamente – etwa TNFα-Inhibitoren und Interleukin- ...