Das erhöhte Kreatinin: wann und wie abklären?
Autor: PD Dr. med. Andreas D. Kistler
Chefarzt Medizinische Klinik
Kantonsspital Frauenfeld
Pfaffenholzstrasse 4
8501 Frauenfeld
E-Mail: andreas.kistler@stgag.ch
Das Kreatinin gehört wohl zu den am häufigsten bestimmten Laborwerten im Blut. Entsprechend oft wird ein erhöhter Kreatininwert festgestellt – und es stellen sich dann verschiedene Fragen: Liegt eine relevante Nierenerkrankung mit prognostischer und therapeutischer Relevanz vor oder kann der Wert noch toleriert werden? Reicht eine Verlaufskontrolle oder bedarf es zeitnah weiterer Abklärungen? Im letzteren Fall: Welche Untersuchungen sind zielführend und wann ist eine fachärztliche nephrologische Abklärung angezeigt?
Keypoints
-
Aus dem Serumkreatinin sollte immer die GFR abgeschätzt werden, dabei müssen aber die Limitationen der Schätzformel berücksichtigt werden.
-
Beachten Sie das Alter der Patient*innen: Im höheren Alter ist eine gewisse Abnahme der Nierenfunktion normal und die prognostische Relevanz einer Nierenfunktionseinschränkung geringer.
-
Die Urinuntersuchung (im Minimum Streifentest, ggf. zusätzlich Albumin-Kreatinin- und Protein-Kreatinin-Quotient) gehört zur Erstabklärung einer Niereninsuffizienz.
-
Es soll immer nach einer Ursache (Ätiologie und anatomisch-pathologisches Muster) der Niereninsuffizienz gesucht werden. Meist reichen dazu eine gute Anamnese, die Urinuntersuchung und eine Sonografie der Nieren.
Was die Beantwortung dieser Fragen nicht einfacher macht, ist die Tatsache, dass Patient*innen bezüglich des hohen Kreatininwerts in der Regel asymptomatisch sind, also keinen Leidensdruck verspüren. Entsprechend wichtig ist es, sich zunächst des Zieles einer weiteren Abklärung bewusst zu sein – und dies entsprechend auch den Patient*innen zu erklären. Ein erhöhter Kreatininwert weist meistens auf eine eingeschränkte Nierenfunktion hin. Eine solche ist einerseits mit einem deutlich erhöhten Risiko für eine terminale Niereninsuffizienz (Dialysepflichtigkeit) vergesellschaftet, andererseits aber auch mit einer erhöhten kardiovaskulären Morbidität, einer erhöhten Gesamtmortalität sowie verschiedenen Folgeerkrankungen (u.a. Knochenstoffwechsel, Anämie). Eine frühzeitige korrekte Diagnosestellung ist bei vielen Nierenerkrankungen wichtig, um mittels spezifischer Therapie die Progression aufzuhalten und den o.g. Komplikationen vorzubeugen. Andererseits besteht für häufige Nierenerkrankungen (z.B. hypertensive Nephropathie) leider über «unspezifische» progressionsmindernde Massnahmen (z.B. ACE-Hemmer) hinaus leider keine spezifische Therapieoption. Und schliesslich muss ein leicht erhöhter Kreatininwert nicht zwingend auf eine relevante Nierenerkrankung hinweisen. Eine gute Triage kann dementsprechend helfen, auf unnötige Abklärungen zu verzichten. Die im Folgenden ausgeführten Fragen sollen bei dieser Triage helfen und erste Weichenstellungen für die weitere Abklärung erlauben.
Reflektiert das Kreatinin die Nierenfunktion korrekt?
Die Nieren erfüllen etliche Funktionen (exkretorische, endokrine, homöostatische) und entsprechend mannigfaltig sind die Auswirkungen einer Nierenfunktionsstörung. Am besten reflektiert wird die globale Nierenfunktion aber durch die glomeruläre Filtrationsrate (GFR) – also die Menge an Primärharn, die durch glomeruläre Filtration pro Zeiteinheit gebildet wird. Das Serumkreatinin spiegelt als endogener Filtrationsmarker die GFR wider und dient zu deren Schätzung. Heute wird bei der Bestimmung des Serumkreatinins in aller Regel vom Labor auch gleich die geschätzte GFR (eGFR) ermittelt und angegeben, meistens anhand der CKD-EPI-Formel. Diese Formel hat gegenüber der viel älteren Cockcroft-Gault-Formel einige Vorteile: a) Sie ist wesentlich besser validiert; b) sie schätzt direkt die GFR und nicht die Kreatininclearance (Letztere ist etwas höher als die GFR, da Kreatinin nicht nur durch glomeruläre Filtration, sondern zu einem geringeren Anteil auch durch tubuläre Sekretion ausgeschieden wird); c) sie gibt die GFR normiert auf die Körperoberfläche an (in ml/min/1,73m2). Dies hat wiederum zwei Vorteile: Einerseits macht es physiologisch Sinn, die Nierenfunktion auf die Körpergrösse zu beziehen, weil das Risiko für Komplikationen einer Nierenerkrankung korreliert mit der auf die Körperoberfläche normierten GFR. Andererseits kann die normierte GFR ohne Kenntnis des Körpergewichts geschätzt werden (im Gegensatz zur Kreatininclearance nach Cockcroft-Gault, zu deren Berechnung das Gewicht bekannt sein muss). Daher kann die eGFR vom Labor unter Kenntnis von Geschlecht und Alter direkt berechnet werden.
So praktisch GFR-Schätzformeln sind, haben sie aber auch ihre Tücken und Limitationen, die es zu beachten gilt. Einerseits ist ihre Genauigkeit limitiert; selbst die sehr gut validierte CKD-EPI-Schätzformel ist mit einer Ungenauigkeit von circa +/–30% behaftet. Andererseits sind sie nur im Steady-State valide. Bei akutem Nierenversagen mit rasch steigendem Kreatinin wird die GFR überschätzt und bei sich erholender Nierenfunktion mit sinkendem Kreatinin unterschätzt. Und schliesslich gibt es extrarenale Einflüsse auf das Serumkreatinin:
-
Die Muskelmasse: Die Effekte von Geschlecht und Alter auf die Muskelmasse werden von der Formel berücksichtigt – nicht aber andere Einflüsse. So findet sich bei jungen, sportlichen Personen mit muskulösem Körperbau oft ein etwas erhöhtes Kreatinin und die GFR wird unterschätzt. Bei Personen mit Muskelerkrankungen, Kachexie etc. gilt das Umgekehrte. Muss in diesem Fall die GFR ermittelt werden, so kann entweder das Cystatin C als alternativer, nicht von der Muskelmasse abhängiger endogener Filtrationsmarker bestimmt und daraus die GFR geschätzt werden, oder es erfolgt eine 24-h-Urinsammlung zur genauen Bestimmung der Kreatininclearance.
-
Exogene Zufuhr von Kreatin in Form von Muskelaufbaupräparaten oder durch exzessiven Fleischkonsum
-
Gewisse Medikamente (Trimethoprim, Cimetidin, Dolutegravir) hemmen die tubuläre Sekretion von Kreatinin und können zu einem GFR-unabhängigen Kreatininanstieg um bis zu circa 20% führen.
Entspricht die Nierenfunktionder Altersnorm?
Bei gesunden jungen Erwachsenen beträgt die GFR in der Regel >90ml/min/1,73m2. Ab einem Alter von 35–40 Jahren nimmt die GFR aber pro Jahr durchschnittlich um knapp 1ml/min/1,73m2 ab. Wie kürzlich gezeigt werden konnte, findet sich diese Abnahme auch bei gesunden Personen (Abb.1).1 Die GFR-Abnahme mit zunehmendem Alter reflektiert also nicht bloss eine höhere Prävalenz von Nierenerkrankungen im Alter, sondern wohl einen Alterungsprozess der Nieren. Während bei jüngeren Personen bereits eine GFR <75ml/min/1,73m2 pathologisch und auch mit einer erhöhten Mortalität assoziiert ist, so finden sich bei einem beträchtlichen Teil der über 75-Jährigen GFR-Werte <60ml/min/1,73m2 und erst GFR-Werte <45ml/min/1,73m2 sind in dieser Altersgruppe klar mit einer erhöhten Mortalität assoziiert.2 Hinzu kommt, dass in dieser Altersgruppe die Lebenserwartung oft so gering ist, dass eine chronische Nierenerkrankung in dieser Zeit nicht mehr prognostisch relevant wird.
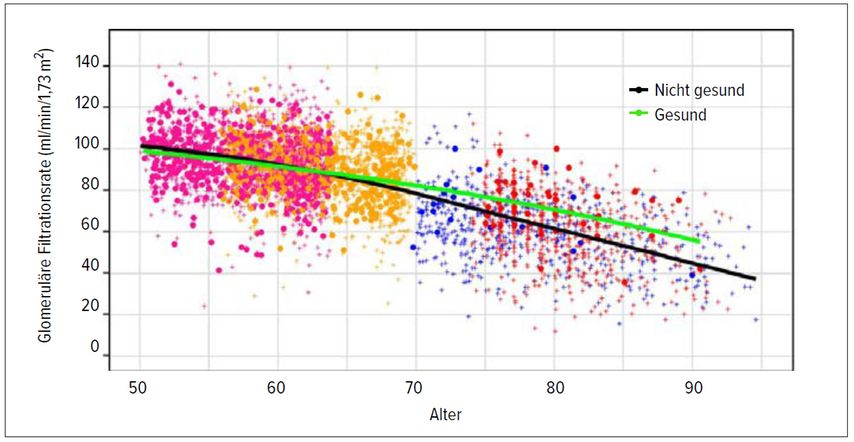
Abb. 1: Gemessene GFR in Abhängigkeit von Alter und Gesundheitszustand. Die verschiedenen Kohorten, in denen die Messungen gemacht wurden, sind farblich gekennzeichnet. Die gefüllten Kreise und die schwarze Linie (Mittelwert) beziehen sich auf Personen mit chronischen (nicht renalen) Erkrankungen, die Kreuze und die grüne Linie auf gesunde Personen (nach Eriksen et al.)1
Ist die Dynamik der Nierenfunktionsabnahme bekannt?
Nebst dem absoluten Wert in Relation zum Alter ist natürlich die Dynamik wichtig. Einerseits steckt hinter einer akuten Niereninsuffizienz eine andere Differenzialdiagnose als hinter einer chronischen. Und andererseits ist eine rasch voranschreitende chronische Niereninsuffizienz ernster zu nehmen als eine über Jahre stabil eingeschränkte Nierenfunktion. Am hilfreichsten sind hier Vorwerte des Serumkreatinins. Sind diese nicht bekannt, kann eine Verlaufskontrolle helfen – natürlich unter der Voraussetzung, dass nicht andere Befunde (siehe unten) zu rascherem Handeln zwingen.
Erschliesst sich aus der Anamneseeine wahrscheinliche Ursache der Niereninsuffizienz?
Eine chronische oder auch eine akute Niereninsuffizienz stellen eigentlich keine Diagnosen dar, sondern beschreiben lediglich deskriptiv den Grad der Nierenfunktionseinschränkung. Entsprechend ist es immer wichtig, sich Gedanken über die Mechanismen zu machen, die zur Nierenfunktionseinschränkung führen. Hierfür bewährt es sich, bei jeder Nierenerkrankung auf drei Ebenen zu denken:
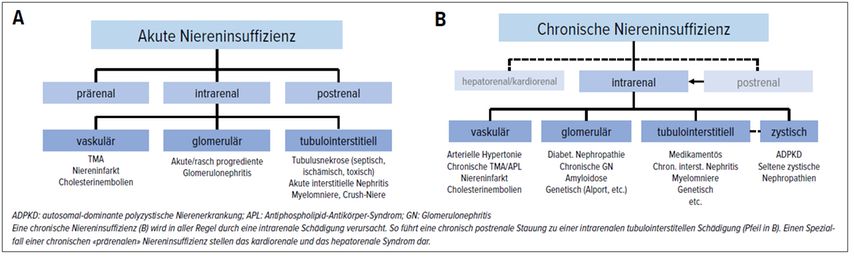
Abb. 2: Anatomisch-pathologische Einteilung der akuten und chronischen Niereninsuffizienz
-
Welche Ursache (Ätiologie/Noxe/Grunderkrankung) liegt der Nierenschädigung zugrunde?
-
Welches anatomisch-pathologische Muster liegt vor (prärenal – renal – postrenal; falls renal: vaskulär – glomerulär – tubulointerstitiell)? (Abb.2)
-
Welches klinische Syndrom liegt vor bzw. welche Symptome, welche klinischen und laborchemischen Befunde? Diese erlauben oft Rückschlüsse auf das anatomisch-pathologische Muster.
Wichtige Hinweise auf die Ätiologie (Punkt 1 oben) lassen sich oft in einer vertieften Anamnese eruieren. Sehr häufige Ursachen einer chronischen Niereninsuffizienz sind Diabetes und Bluthochdruck. Die Familienanamnese kann Hinweise auf genetische Ursachen von Nierenerkrankungen (z.B. Zystennieren) geben. Bei akuter Niereninsuffizienz ist insbesondere die Medikamentenanamnese zentral (nephrotoxische Medikamente wie nicht steroidale Antirheumatika [NSAR]? mögliche Auslöser einer interstitiellen Nephritis wie Antibiotika, NSAR, Protonenpumpen-Inhibitoren?) sowie Hinweise auf Flüssigkeitsverlust oder verminderte Flüssigkeitsaufnahme als Ursache einer prärenalen Niereninsuffizienz. Muskel- und Gelenksbeschwerden und Symptome anderer Organsysteme (z.B. pulmonal, HNO, Augen) können wichtige Hinweise auf eine autoimmune Systemerkrankung liefern.
Was für Urinbefunde liegen vor?
Zu jeder Erstdiagnose einer Niereninsuffizienz gehört eine Urinuntersuchung als unabdingbare Laboruntersuchung. Diese gibt dreierlei wichtige Hinweise:
-
Liegen nebst dem erhöhten Kreatinin/der erniedrigten GFR weitere Hinweise auf eine Nierenerkrankung vor? Wie oben erwähnt, gibt es auch extrarenale Einflüsse auf das Kreatinin, und die Nierenfunktion kann im Alter «physiologisch» eingeschränkt sein. Auffälligkeiten der Urinbefunde liefern aber wichtige Hinweise auf eine relevante Nierenerkrankung.
-
Die Albuminurie stellt einen ganz wichtigen prognostischen Faktor dar. Je höher die Albuminurie, desto höher das Progressionsrisiko der Nierenerkrankung und desto ernster sollte die Nierenerkrankung genommen werden.
-
Die Analyse der Urinbefunde erlaubt oft einen Rückschluss auf das anatomisch-histologische Muster der Nierenschädigung und damit auch auf mögliche Ätiologien (Abb.3). Eine vaskuläre Nierenschädigung (hypertensive Nephropathie) geht in der Regel mit einem normalen Urinbefund bzw. allenfalls einer moderat erhöhten Albuminurie («Mikroalbuminurie») einher. Bei einer interstitiellen Nierenschädigung findet sich oft eine milde Proteinurie, die aber zu <50% aus Albumin besteht (was bei gleichzeitiger Bestimmung des Albumin-Kreatinin- und des Protein-Kreatinin-Quotienten eruiert werden kann). Eine ausgeprägte Erhöhung des Protein-Kreatinin-Quotienten bei normaler oder nur wenig erhöhter Albuminurie weist auf eine mögliche Myelomniere hin (Bence-Jones-Proteinurie). Bei einer interstitiellen Nephritis findet sich nebst einer tubulären Proteinurie oft eine leichte Leukozyturie. Eine glomeruläre Nierenschädigung ist schliesslich charakterisiert durch eine glomeruläre Proteinurie (>50% Albumin) und/oder eine Mikrohämaturie. Passt der Urinbefund zur Anamnese (z.B. blander Urinbefund, jahrelange Hypertonie→ hypertensive Nephropathie; glomeruläre Proteinurie und blandes Urinsediment bei jahrelang bekanntem Diabetes → diabetische Nephropathie), dann sind in der Regel keine weiteren Abklärungen notwendig.
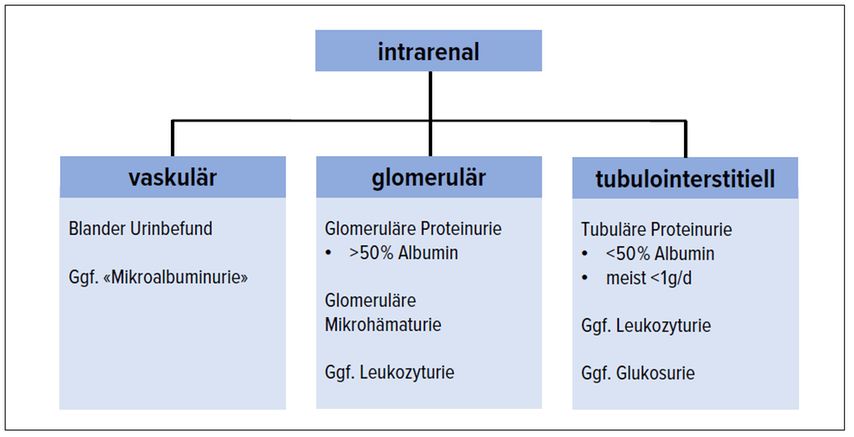
Abb. 3: Typische Urinbefunde bei vaskulären, glomerulären und tubulointerstitiellen Nierenerkrankungen
Als orientierende Untersuchung liefert bereits ein Urinstreifentest wichtige Hinweise. Bei positivem Streifentest auf Blut/Leukozyten sollte ein Urinsediment erfolgen – einerseits um die Mikrohämaturie bzw. Leukozyturie zu bestätigen, und andererseits kann nach dysmorphen Erythrozyten gesucht werden. Bei positivem Streifentest auf Albumin bzw. Protein sollte eine Quantifizierung mittels Albumin-Kreatinin-Quotient und Protein-Kreatinin-Quotient im Spoturin erfolgen. In der Regel empfiehlt es sich aber, bei der Erstabklärung einer Niereninsuffizienz unabhängig vom Resultat des Streifentests eine Bestimmung von Albumin-Kreatinin-Quotient und Protein-Kreatinin-Quotie
nt im Spoturin durchzuführen. Damit kann einerseits eine gering erhöhte Albuminurie erkannt werden (die sich dem Nachweis mittels Streifentest entziehen kann) und andererseits können auch andere Proteine als Albumin nachgewiesen werden (insbesondere Bence-Jones-Proteinurie), und das Verhältnis von Albuminurie zu Gesamt-Proteinurie erlaubt eine Einteilung in glomeruläre vs. tubuläre Proteinurie (siehe oben und Abb. 4).
Wie sehen die Nieren sonografisch aus?
Wie die Urinuntersuchung gehört auch ein Ultraschall der Nieren und der ableitenden Harnwege in der Regel zur Erstabklärung einer neu festgestellten Niereninsuffizienz. Die relevanten Informationen aus der Sonografie sind: 1) Ausschluss einer postrenalen Genese (gestaute Nieren mit/ohne gestaute Ureteren); 2) Nierengrösse und Parenchymbreite (verkleinerte Nieren und/oder ein verschmälertes Parenchym geben Hinweise auf eine fortgeschrittene chronische und in der Regel irreversible Schädigung); 3) Zystennieren oder andere anatomische Auffälligkeiten.
Sind weiterführende Abklärungen angezeigt?
Sofern anhand der o.g. Untersuchungen die wahrscheinliche Ursache der Niereninsuffizienz nicht eruiert werden konnte (z.B. hypertensive Nephropathie; diabetische Nephropathie; postrenale Niereninsuffizienz) und insbesondere wenn die Urinuntersuchungen auf eine glomeruläre Nierenschädigung hinweisen (Proteinurie, auffälliges Urinsediment), sind weiterführende Abklärungen angezeigt. Diese bestehen einerseits aus weiterführenden Labortests hinsichtlich möglicher Ätiologien (Hepatitisserologien, Autoantikörperbestimmungen etc.) und andererseits oft aus einer Nierenbiopsie. Spätestens hier ist eine nephrologische Überweisung indiziert. Sehr oft reichen aber die o.g. Überlegungen und Untersuchungen aus, um zu entscheiden, ob eine relevante Nierenfunktionsstörung vorliegt, und um die wahrscheinliche Ursache derselben zu eruieren (für eine ausführlichere Beschreibung der oben erwähnten Untersuchungen siehe Seeger und Kistler, 20183). Als Gedächtnisstütze diene Ihnen dabei der folgende Merksatz:
Machen Sie der Niereninsuffizienz den Garaus!
GFR adäquat geschätzt?
Altersentsprechende Nierenfunktion?
Rasche Dynamik?
Anamnestische Hinweise auf Ursache?
Urinbefunde?
Sonografie?
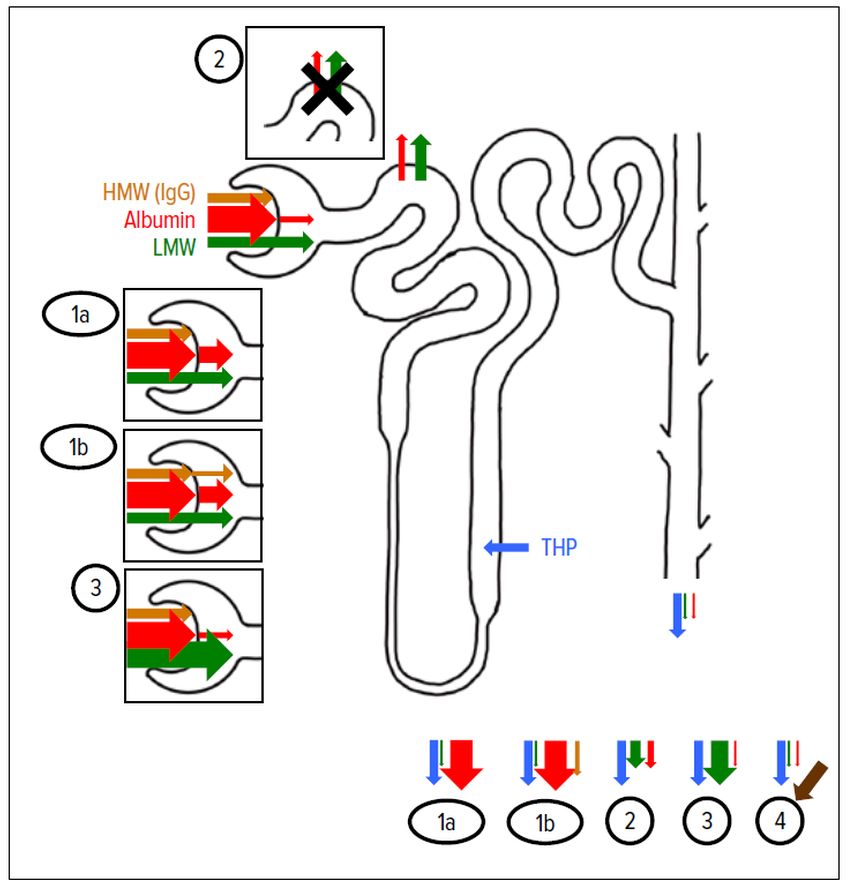
Abb. 4: Schematische Darstellung der physiologischen und verschiedener Formen der pathologischen Proteinurie. Bei Gesunden werden grossmolekulare («high molecular weight», HMW) Proteine (z.B. Immunglobuline) glomerulär gar nicht, Albumin nur zu einem geringen Anteil und niedermolekulare («low molecular weight», LMW) Proteine frei filtriert. Die filtrierten Proteine werden fast vollständig im proximalen Tubulus rückresorbiert. Im Urin erscheinen physiologisch pro Tag bis 10mg Albumin und bis 10mg LMW-Proteine. Den grössten Anteil der physiologischen Proteinurie (bis 150mg/d) macht das Tamm-Horsfall-Protein (THP, auch Uromodulin genannt) aus, welches von den Tubuluszellen im aufsteigenden Schenkel der Henle-Schleife sezerniert wird. Bei glomerulärer Proteinurie wird aufgrund eines undichten glomerulären Filters abnorm viel Albumin (und bei unselektiver glomerulärer Proteinurie im Rahmen einer schweren Schädigung auch vermehrt HMW-Proteine) filtriert. In beiden Fällen besteht die resultierende Proteinurie zu >50% aus Albumin ( 1a und b ; im letzteren Fall lässt sich zusätzlich IgG im Urin nachweisen). Bei tubulärer Schädigung werden das physiologisch filtrierte Albumin und die LMW-Proteine nicht adäquat rückresorbiert und erscheinen daher im Urin (tubuläre Proteinurie, 2 ). Albumin macht dabei <50% aus und eine tubuläre Proteinurie übersteigt selten 1g/d, da normalerweise nicht wesentlich mehr Protein glomerulär filtriert wird. Finden sich im Blut massiv erhöhte Konzentrationen von LMW-Proteinen (z.B. freie Leichtketten bei multiplem Myelom oder Myoglobin bei Rhabdomyolyse), so wird die tubuläre Rückresorptionskapazität überschritten und die niedermolekularen Proteine erscheinen im Urin ( 3 ). Hier findet sich – sofern kein zusätzlicher glomerulärer Schaden vorliegt – nicht vermehrt Albumin im Urin. In einem gewissen Mass führen auch postrenale Pathologien (Infekte, Tumoren) zu einer Proteinurie, die dann vor allem aus HMW-Proteinen besteht ( 4 ). Die Differenzierung der Proteine im Urin – am einfachsten schon in Form der gleichzeitigen Bestimmung des Albumin-Kreatinin- und des Protein-Kreatinin-Quotienten – erlaubt dementsprechend einen Rückschluss auf die vorliegende Pathologie.
Zum Schluss sei noch erwähnt, dass sich die Ausführungen oben auf die Frage beschränken, ob eine relevante Niereninsuffizienz vorliegt, und auf die Suche nach deren Ursache. Bei ausgeprägter Niereninsuffizienz sollte natürlich immer auch nach ihren Folgen gesucht und diese sollten ggf. behandelt werden: Elektrolytstörungen (insbesondere Hyperkaliämie und Hyperphosphatämie), renale Azidose, renale Anämie, sekundärer Hyperparathyreoidismus/renale Osteodystrophie. Diese Komplikationen treten in der Regel frühestens ab einer GFR <45ml/min/1,73m2 auf und sind ab einer GFR <30ml/min/1,73m2 häufig. Auch deren Behandlung rechtfertigt bzw. bedingt in der Regel eine nephrologische Zuweisung.
Literatur:
1 Eriksen BO et al.: GFR in healthy aging: an individual participant data meta-analysis of iohexol clearance in european population-based cohorts. J Am Soc Nephrol 2020; 31: 1602-15 2 Delanaye P et al.: CKD: a call for an age-adapted definition. J Am Soc Nephrol 2019; 30: 1785-805 3 Seeger H, Kistler AD: Nephrologische Diagnostik mit der Toolbox des Hausarztes. Ther Umsch 2018; 75: 335-43
Das könnte Sie auch interessieren:
Roboterassistierte primäre Hüfttotalendoprothese – Fortschritt oder Marketing?
Seit der Einführung des RIO®-Systems im Jahr 2006 (MAKO) und der Übernahme durch die Firma Stryker im Jahr 2017 haben nahezu alle grossen Knieendoprothesenhersteller eigene robotische ...
Algorithmus zur Behandlung der Hüftinstabilität
Die postoperative Instabilität stellt eine der häufigsten Ursachen für Revisionsoperationen nach Hüfttotalendoprothese dar. Patient:innenspezifische Faktoren, implantatbezogene Aspekte ...
Revision der instabilen K-TEP – welche Revisionsstrategien sind erfolgreich?
Instabile Knietotalendoprothesen können an den Behandler unterschiedlichste Anforderungen stellen. Um das Behandlungsziel und die Wege dorthin zu definieren, sollten die Häufigkeit sowie ...