3D-Ultraschall in der Gynäkologie
Autor:
Dr.med. Julian Metzler
Klinik für Gynäkologie
Universitätsspital Zürich
E-Mail: julian.metzler@usz.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die 3D-Sonografie erfreut sich im geburtshilflichen Ultraschall einer breiten und häufigen Anwendung. Auch in der gynäkologischen Sonografie gibt es vielfältige Einsatzmöglichkeiten. In diesem Artikel sollen sowohl die technischen Voraussetzungen, die Funktionsweise als auch die praktische Anwendung erörtert werden, insbesondere soll auf die Diagnostik kongenitaler Uterusanomalien eingegangen werden.
Keypoints
-
Die 3D-Sonografie ist im Bereich der gynäkologischen Sonografie vielseitig anwendbar, weshalb es sich lohnt, sich mit den Grundlagen vertraut zu machen. Die Untersuchung ist schnell und unkompliziert durchführbar.
-
Nach der Volumenakquise ist vor allem das Postprocessing unter Einsatz verschiedener Darstellungsmodi relevant.
-
Die 3D-Sonografie erleichtert insbesondere die Diagnostik uteriner Fehlbildungen. Diese können z.B. nach ESHRE/ESGE beschrieben werden, wobei die Ultraschallkriterien nach CUME 2018 in der Diagnostik von Bedeutung sind.
-
Weitere Anwendungsmöglichkeiten ergeben sich im Bereich der Intrauterinpessare, Myome, bei Adenomyose, Adnexbefunden, Reproduktionsmedizin oder dem Beckenboden.
Grundlagen der 3D-Sonografie
Einführung, technischer Hintergrund
Zweidimensionale Darstellungen gelten in vielen Bereichen der medizinischen Bildgebung als Standard. Grund dafür sind die meist einfacheren technischen Voraussetzungen gegenüber einer dreidimensionalen Darstellung, die Möglichkeit einfacher Messungen etc. Anhand zweidimensionaler Bilder kann bzw. muss sich ein:e Untersucher:in eine dreidimensionale Vorstellung der anatomischen Situation mental visualisieren. Eine dreidimensionale Darstellung bietet zweifellos vielfältige Vorteile, etwa in der Rekonstruktion zusätzlicher Schnittebenen, gerenderter Oberflächen oder in der Befunddemonstration gegenüber der Patientin, wie im Folgenden gezeigt werden soll.
Die in der gynäkologischen Sonografie am häufigsten gewählte Bilddarstellung ist der B(«Brightness«)-Mode, welcher in einem zweidimensionalen Bild Punkte (sog. Pixel) unterschiedlicher Helligkeit darstellt. Die Intensität der Pixelhelligkeit (auf einer Grauskala) hängt dabei von der Amplitude des an dieser Stelle reflektierten Ultraschallsignals ab. Dieses Bild kann mehrfach pro Sekunde erstellt werden (sogenannte «frame rate») und erlaubt so die Visualisierung anatomischer Strukturen in Echtzeit.
Für die 3D-Sonografie werden nun mehrere derartige zweidimensionale Schnittbilder, welche in leicht versetzten Ebenen aufgenommen werden, zu einem 3D-Volumen integriert. Dies kann technisch gesehen auf mehrere Arten erfolgen, etwa durch ein manuelles Schwenken oder eine lineare Translationsbewegung («sweep») der Sonde, oder, wie heute meist üblich, durch spezielle 3D-Schallköpfe. Diese besitzen elektromechanische oder elektronische Komponenten, um in einer möglichst kurzen Zeit ein 3D-Volumen aufzuzeichnen, indem z.B. ein akustisches Array hin- und hergeschwenkt wird, während der Scanner mehrere Einzelbilder aufnimmt. Das resultierende Volumen kann man sich als dreidimensionalen Körper vorstellen, welcher ebenfalls aus Punkten mit unterschiedlicher Helligkeitsinformation (sog. «Voxel») besteht.
Werden mehrere 3D-Volumina hintereinander aufgenommen (und wird so die Dimension «Zeit» hinzugefügt), spricht man von 4D-Ultraschall oder «real-time 3D».
Aufgenommene Volumina können im sogenannten «Postprocessing» bearbeitet werden. Insbesondere können so verschiedene Schnittebenen rekonstruiert bzw. visualisiert werden, welche u.U. nur durch eine Bewegung des Schallkopfes bzw. Änderung des Aufnahmewinkels gar nicht erstellbar gewesen wären.
Die Voraussetzung zur Erstellung dreidimensionaler Ultraschallbilder ist das Vorhandensein eines 3D-fähigen Ultraschallgerätes sowie spezieller 3D-fähiger Sonden, welche in unterschiedlichen Ausführungen (Abdominalsonde, Transvaginalsonde) von verschiedenen Herstellern erhältlich sind.
Volumenakquisition
Anhand des technischen Hintergrunds der Volumenakquisition wird klar, dass es sich bei 3D-Aufnahmen im Grunde nur um «gestapelte» 2D-Bilder handelt. Somit kann eine 3D-Aufnahme eine mangelnde 2D-Bildqualität (z.B. verursacht durch «Patientenfaktoren» wie Adipositas, Darmgase, Oligohydramnion etc.) nicht kompensieren. Umso wichtiger ist es, bereits vor der Volumenakquisition eine möglichst hohe 2D-Bildqualität zu erreichen. Dies geschieht durch die Verwendung von ausreichend Ultraschallgel, adäquaten Sondendruck, korrekte Einstellung der Geräteparameter (Frequenz/Tiefe, «Gain»).
Nach Wechsel in den 3D-Modus kann zunächst der zu scannende Bereich («region of interest») festgelegt werden. Dies geschieht z.B. an GE Voluson®-Geräten in derselben Weise, wie auch das Colordoppler-Fenster positioniert wird. Weitere Einstellmöglichkeiten bestehen z.B. für die 3D-Bildqualität (höhere Qualität = langsamere Erfassung, was zu Bewegungsartefakten führen kann) und den Aufnahmewinkel (=Breite des zu generierenden Volumens). Ist dies festgelegt, kann die Volumenakquisition per Knopfdruck gestartet werden. Während dieser Zeit ist es wichtig, die Sonde möglichst ruhig zu halten. In gewissen Fällen kann es helfen, die Patientin zu bitten, die Luft kurz anzuhalten.
Bilddarstellung, Postprocessing
Gerade für in der 3D-Sonografie weniger erfahrene Untersucher:innen empfiehlt es sich, das erhaltene Volumen nun direkt zu speichern und mögliche Anpassungen/Messungen später in Ruhe vorzunehmen. Untersucher:innen, welche mit dem Postprocessing bzw. den dafür zu kennenden Tastenbelegungen vertraut sind, werden dieses unmittelbar vornehmen. Insgesamt gilt es zu sagen, dass optimale Resultate nur nach einer gewissen Nachbearbeitung zu erhalten sind, welche entweder direkt am Ultraschallgerät oder, mittels spezieller Software, auch am PC durchgeführt werden kann.
Für die Darstellung des akquirierten 3D-Volumens können verschiedene Modi eingestellt werden:
Die «multiplanar reconstruction» (MPR)zeigt neben 3 orthogonalen 2D-Ebenen (sagittal, koronar, transvers) eine vierte rekonstruierte Ebene. Dies ist z.B. hilfreich, um eine Frontalebene des Uterus zu rekonstruieren, welche aufgrund der eingeschränkten Beweglichkeit (Freiheitsgrade) der Transvaginalsonde und der Versio und Flexio des Uterus nicht direkt zu erzielen ist. Um ein optimales Resultat zu erzielen, müssen die 2D-Ansichten gedreht, geneigt und geschwenkt werden (meist Drehknöpfe für die Achsen X, Y, Z), zusätzlich kann die Krümmung der Rekonstruktionsebene (z.B. an die Flexio des Uterus entlang des Endometriumreflexes) angepasst werden.
Ein weiterer Modus, «tomographic ultrasound imaging» (TUI) oder «multi-view», erlaubt die Darstellung mehrerer paralleler Schichten (bzw. multiplanarer Rekonstruktionen) in einem Raster. Dies ermöglicht, zusätzliche Details in bestimmen Bildabschnitten zu erhalten.
«Surface rendering images» (SRI) entstehen durch das sog. Rendern von Oberflächen aus den vorhandenen Rohdaten und erhalten durch diverse Anpassungen (Beleuchtungseffekte etc.) den mehr oder weniger ausgeprägten typischen 3D-Effekt, wie man ihn etwa von der Darstellung des fetalen Gesichtes im geburtshilflichen Ultraschall kennt. Dies ist hilfreich zur Darstellung äusserer oder innerer Konturen von Organen oder Befunden (Hydrosalpingen, Zysten etc.).
Innerhalb dieser Modi kann weiters eingestellt werden, ob echodichte oder -durchlässige Bereiche dargestellt werden. «Maximum intensity projection» und «minimum intensity projection» zeigen den hellsten respektive dunkelsten Voxel entlang des Schallweges, während «average intensity projection» die durchschnittliche Voxelhelligkeit heranzieht, um eine Art «Röntgeneffekt» zu erzielen.
Mittels «inversion mode» kann die Grauskala auch umgedreht werden, z.B. um anechogene Bereiche wie flüssigkeitsgefüllte Strukturen besser darstellen zu können. Mittels «volume contrast imaging» kann ein kontrastreicheres Bild erzeugt werden, indem mehrere nebeneinander liegende Frames zu einer dickeren Schicht kombiniert werden. Für weitere Ein- und Darstellungsmöglichkeiten können das Gerätehandbuch oder Online-Ressourcen der Hersteller konsultiert werden.
Anwendungsmöglichkeiten
Uterine Fehlbildungen
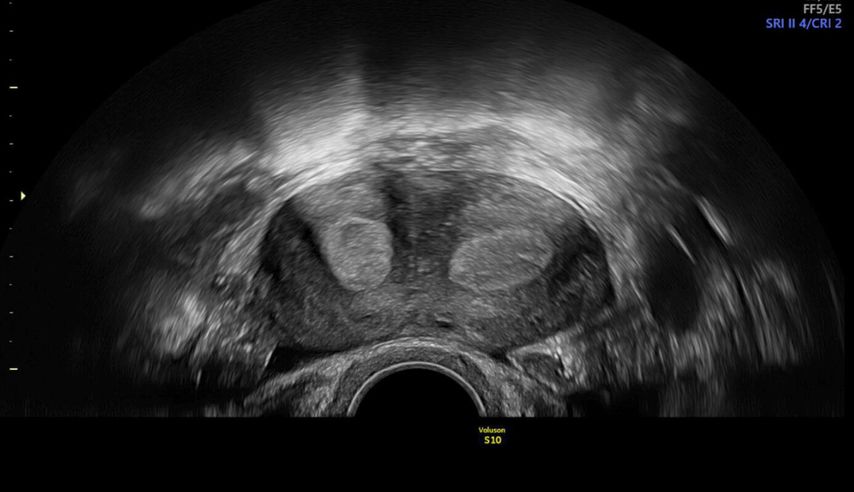
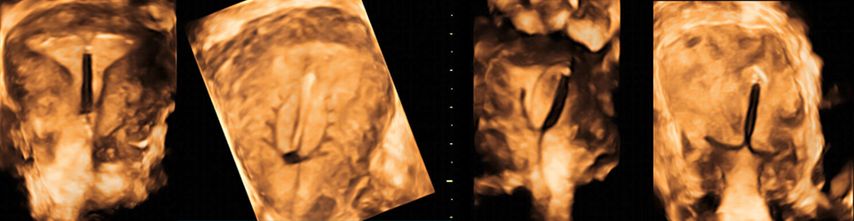
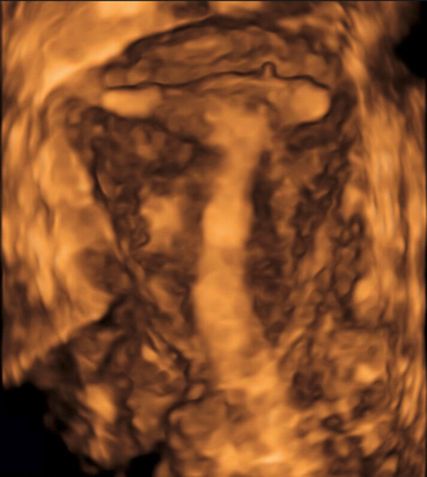
Die Prävalenz angeborener Uterusmalformationen wird mit bis zu 6,7% in der Allgemeinbevölkerung angegeben; bei infertilen Frauen oder solchen mit wiederholten Aborten beträgt sie über 7% bzw. etwa 17%.1 Da die klinische Beurteilbarkeit starken Einschränkungen unterworfen ist, ist die Bildgebung in der Diagnostik zentral. Während die 2D-Sonografie ubiquitär verfügbar ist und zur Abklärung von nichtuterinen Strukturen meist ausreicht, zeigt die 3D-Sonografie eine höhere Sensitivität und Spezifität von 98,3% bzw. 99,4%.2 Während im zweidimensionalen Querschnitt z.B. ein Uterus (sub-)septus von geübten Untersucher:innen am typischen Katzen- oder Eulenaugenphänomen erkannt werden kann (Abb. 1), ermöglicht es die 3D-Sonografie, eine virtuelle koronare Ebene der Gebärmutter zu visualisieren. Sie eignet sich somit optimal zur Diagnostik, aber auch zur Therapieplanung und postoperativen Kontrolle im Rahmen hysteroskopischer Eingriffe wie einer Septuminzision.
Abb. 1: Eulenaugenphänomen bei Uterus (sub-)septus, zweidimensionale Darstellung, Transversalebene
Das MRI zeigt eine vergleichbare Testgenauigkeit, ist jedoch teurer und sollte deshalb nur bei fehlender Möglichkeit zur Durchführung eines 3D-Ultraschalls, bei komplexen Fehlbildungen oder assoziierten Anomalien zum Einsatz kommen. Bei Fehlbildungen ist eine zusätzliche Nierensonografie durchzuführen. Wichtig ist eine genaue Beschreibung der Befunde, was mithilfe verschiedener Klassifikationssysteme erleichtert wird (u.a. AFS,3 Acien,4 VCUAM,5 ESHRE/ESGE,6 ASRM7), wobei am Universitätsspital Zürich üblicherweise die Einteilung nach ESHRE/ESGE verwendet wird.
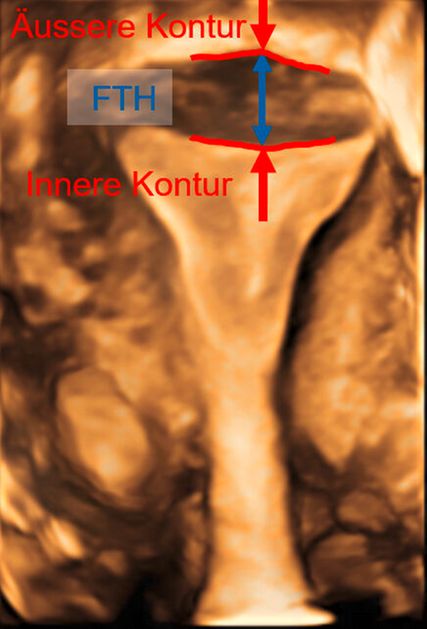
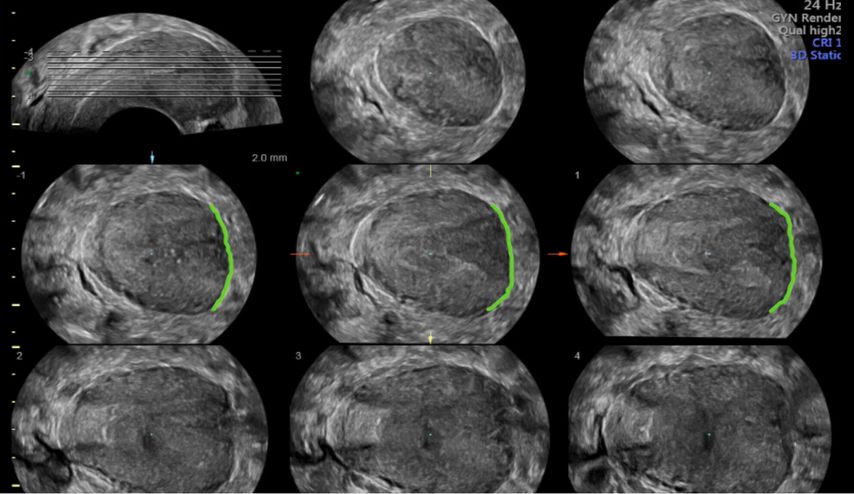
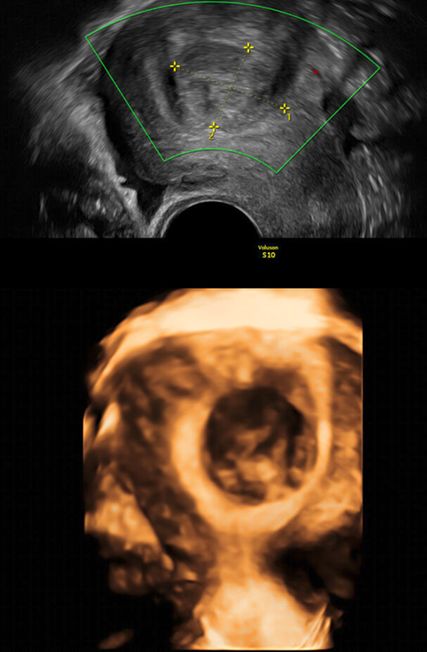
Abb. 2: Multiplanare Rekonstruktion der Koronarebene. Die äussere und innere Funduskontur sind rot eingezeichnet. Die Fundusdicke («fundal thickness», FTH) lässt sich ausmessen
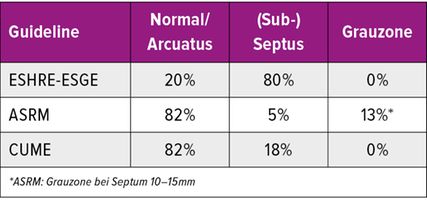
Tab. 1: Häufigkeit normaler Uteri (inkl. Arcuatus) sowie septierter Uteri nach Beurteilung 3D-generierter Koronarebenen durch Experten in Abhängigkeit vom verwendeten Klassifikationssystem (ESHRE/ESGE, ASRM, CUME). Modifiziert nach Ludwin et al.8
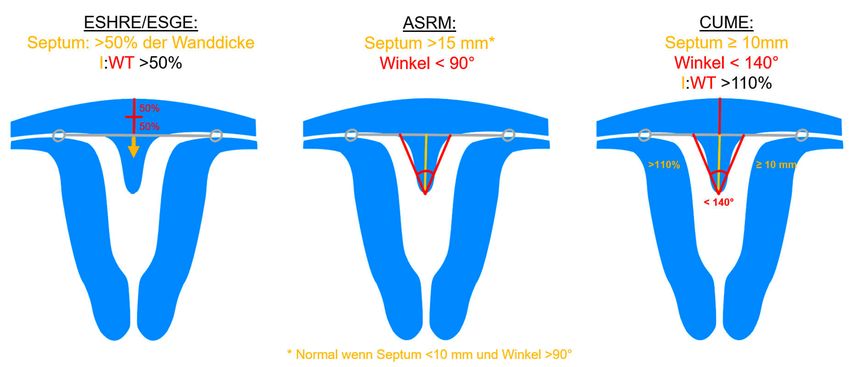
Die Untersuchung wird idealerweise bei hoch aufgebautem Endometrium durchgeführt. Nach Erstellung der Koronarebene kann sowohl die äussere als auch die innere Uteruskontur dargestellt und die Fundusdicke («fundal thickness», FTH) bestimmt werden (Abb. 2). Eine allfällige Septierung ist dabei einfach erkennbar und mittels eines Messkreuzes leicht objektivierbar. Dies lässt sich einfach konstruieren: Zunächst wird eine Hilfslinie zwischen den beiden inneren Tubenostien eingezeichnet (sog. Interostiallinie). Nun kann kranial davon die Fundusdicke (bis zur Serosa) und kaudal davon die Länge des Septums sowie der Winkel der Septumspitze bzw. Carina ausgemessen werden (Abb. 3). Je nach Klassifikationssystem unterscheiden sich hier die Definitionen bzw. Massangaben, welche zur Diagnose einer Fehlbildung nötig sind. Während die ESHRE-ESGE-Guideline relativ «laxe» Kriterien vorschlägt, unter deren Anwendung viele Patientinnen die Diagnose eines Uterus (sub-)septus erhalten würden (bis zu 80%!), landen gemäss ASRM-Klassifikation viele Patientinnen in einer «Grauzone». Hier bewähren sich die CUME-Kriterien, mit deren Hilfe eine Einteilung gelingt, die am ehesten der tatsächlichen Prävalenz entspricht, und dies bei entsprechender Trennschärfe.8 Die vorgeschlagenen Kriterien zur Diagnose eines Uterusseptums sind eine Septumlänge von mindestens 10 mm, ein Winkel von <140° und ein Verhältnis Septum:Fundusdicke von >110% (Abb. 4, Tab. 1).
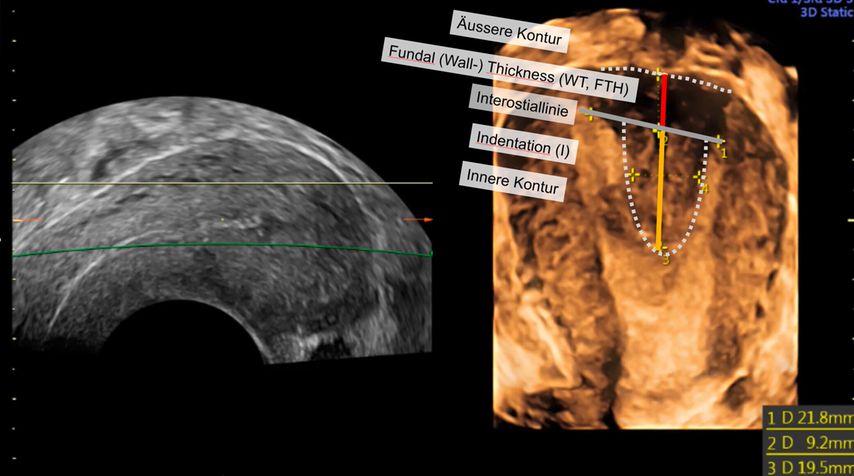
Abb. 3: Ausmessen der Septumlänge. Nach Anlegen der Interostiallinie (grau) zwischen den Tubenostien können die Fundusdicke und das Septum (innere Einkerbung, engl. «indentation») ausgemessen werden. Nicht eingezeichnet ist hier die Messung des Septumwinkels
Abb. 4: Kriterien zur Definition eines Uterus subseptus gemäss verschiedenen Klassifikationssystemen. I: «indentation» (Septum), WT: «wall thickness» (Fundusdicke)
Dieselbe Gruppe publizierte Kriterien zur Diagnose eines T-förmigen Cavums, welches möglicherweise ebenfalls mit nachteiligen reproduktiven Outcomes vergesellschaftet ist.9
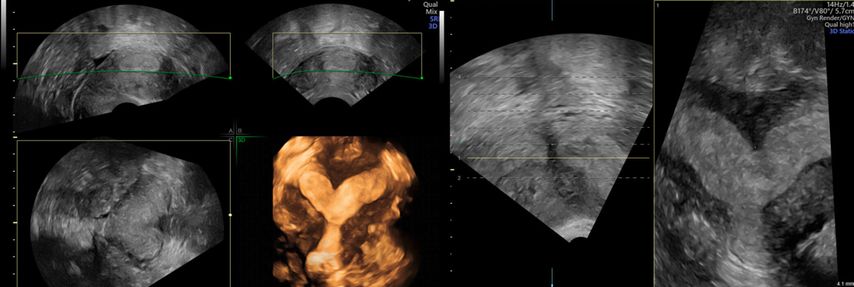
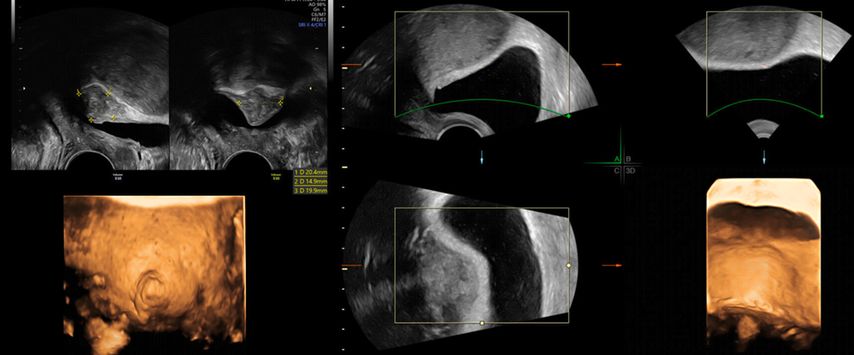
In unklaren Fällen, in denen die äussere Uteruskontur in der MPR nicht eindeutig zu sehen ist und so die Unterscheidung zwischen einem Uterus (sub-)septus und einem Uterus bicornis schwierig ist, hilft TUI bei der Differenzialdiagnose (Abb. 5 und 6).
Abb. 5: «Tomographic ultrasound imaging» (TUI). In mehreren parallelen Ebenen kann die äussere Uteruskontur analysiert werden (konvex vs. konkav)
Abb. 6: Uterus bicornis. Ist die äussere Uteruskontur in der MPR nicht eindeutig zu erkennen, hilft TUI (rechts)
Weitere Anwendungsmöglichkeiten
Die transvaginale 3D-Sonografie kann in zahlreichen weiteren Fragestellungen hilfreich sein.
Bei unklar liegenden Intrauterinpessaren oder «lost threads» ermöglicht sie die Darstellung des Fremdkörpers im Cavum. Fehllagen von Kupfer- und Hormonspiralen (z.B. «upside-down IUD») können so schnell und exakt diagnostiziert und der Patientin demonstriert werden (Abb. 7).
Abb. 7: 3D-sonografische Darstellungen von Intrauterinpessaren. Neben einem korrekt (hoch fundal) liegenden Pessar (links) zeigt das Bild fehlliegende Kupfer- und Hormonspiralen (Korpus, Ärmchen, Faden)
Abb. 8: Adenomyosis uterimit unregelmässiger, ausgefranster subendometrialer Zone und einer subendometrialen «Knospe» fundal
Bei einer Adenomyosis uteri zeigen sich im 2D-Ultraschall häufig die typischen direkten (Zysten, hyperechogene Inseln, echogene subendometriale Linien und Knospen) und indirekten Zeichen (asymmetrische Verdickung, kugeliger Uterus, fächerförmige Schallschatten, transläsionale Vaskularität, irreguläre oder unterbrochene Junktionalzone) gemäss MUSA.10
Insbesondere die Darstellung dieser endometrial-myometranen Übergangszone, welche auch im MRI regelmässig zur Diagnose einer Adenomyose verwendet wird, lässt sich mittels 3D-Sonografie besser darstellen. Am besten gelingt dies in einer Koronarebene mit aktiviertem «volume contrast imaging» (VCI); gelegentlich zeigt sich eine Art «ausgefranstes» Endometrium (Abb. 8).
Bei einem Uterus myomatosus kann die 3D-Sonografie zur Visualisierung der Myome hilfreich sein, insbesondere die Darstellung intracavitärer Anteile vor einer allfälligen hysteroskopischen Resektion (Abb. 9). Selbiges gilt für Endometriumpolypen.
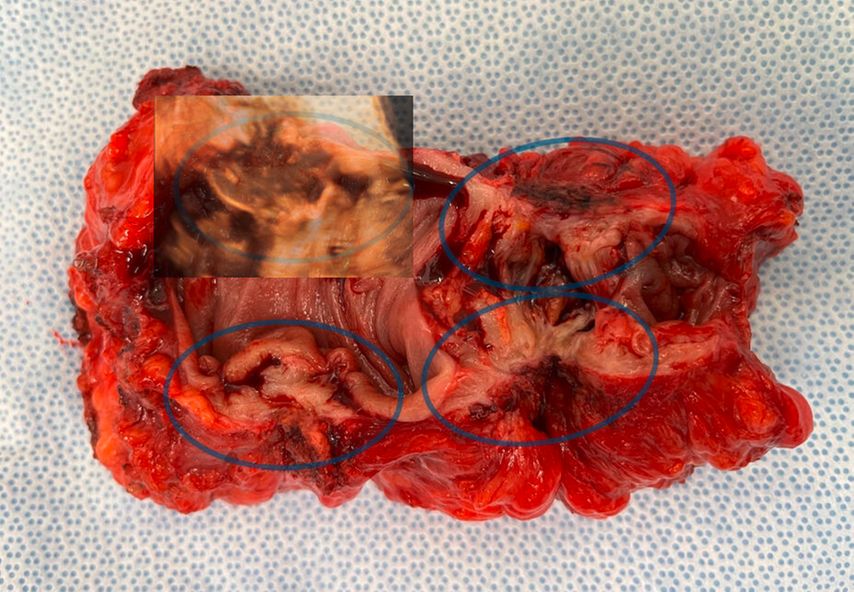
Endometrioseknoten, etwa in der Blase, können anschaulich dreidimensional dargestellt werden im Sinne einer «virtuellen Zystoskopie» (Abb. 10). Auch Visualisierungen von Herden im Rektosigmoid (Abb. 11) stimmen gut mit den intraoperativen Befunden überein, wobei hier die 2D-Sonografie zur genauen Lokalisation und Grössenausmessung sicher im Vordergrund steht.
Abb. 10: Blasenendometriose. Links: zweidimensionale Darstellung und «surface rendering» des Knotens mit zentralem Krater. Rechts: postoperativer Situs mit glattem Urothel im «surface rendering image»
Abb. 11: Darmendometriose. Intraoperative Präparatfotografie mit halbtransparent darüberliegender 3D-sonografischer Darstellung
Dreidimensionale Darstellungen von Adnexbefunden, insbesondere zystischer Art oder von papillären Wucherungen, sind ebenfalls anschaulich, aber für die klassische Diagnostik nach IOTA-Kriterien nicht relevant .11 Gespeicherte 3D-Volumina erlauben aber auch im Nachhinein eine reproduzierbare Einteilung der Befunde gemäss «IOTA simple rules».12
In fertilitätsmedizinischen Untersuchungen ermöglicht die 3D-Sonografie die Erfassung verschiedener Messgrössen wie der Ovarialvolumina, das (teilweise automatisierte) Zählen der Antralfollikel, die Darstellung der Tuben in einer HyCoSy oder der Ovarialdurchblutung mittels 3D-Power-Doppler.13
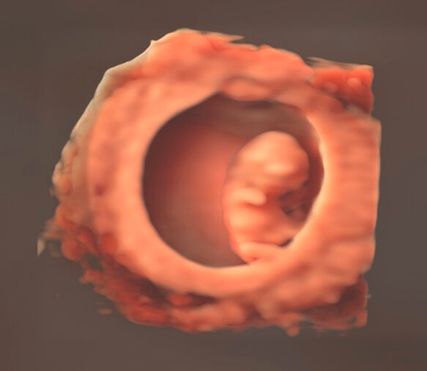
Im Bereich der Perinealsonografie des Beckenbodens ermöglicht das 3D-Verfahren etwa die Visualisierung von Avulsionen des Musculus pubovisceralis. Weitere spannende Einsatzmöglichkeiten bietet das gesamte Spektrum der Frühschwangerschaft, welches je nach Definition ebenfalls der «gynäkologischen» Sonografie zugerechnet werden kann (Abb. 12). Diese Aufzählung erhebt keinen Anspruch auf Vollständigkeit, und wir dürfen auf zukünftige Entwicklungen und Publikationen gespannt sein.
Literatur:
1 Saravelos S et al.: Prevalence and diagnosis of congenital uterine anomalies in women with reproductive failure: a critical appraisal. Hum Reprod Update 2008; 14(5): 415-29 2 Grimbizis GF et al.: The Thessaloniki ESHRE/ESGE consensus on diagnosis of female genital anomalies. Gynecol Surg 2016; 13:1-16 3 The American Fertility Society:The American Fertility Society classifications of adnexal adhesions, distal tubal occlusion, tubal occlusion secondary to tubal ligation, tubal pregnancies, müllerian anomalies and intrauterine adhesions. Fertil Steril 1988; 49(6): 944-55 4 Acién P et al.: Complex malformations of the female genital tract. New types and revision of classification. Hum Reprod 2004; 19(10): 2377-84 5 Oppelt P et al.: The VCUAM (Vagina Cervix Uterus Adnex-associated Malformation) classification: a new classification for genital malformations. Ferti Steril 2005; 85(4): 1493-7 6 Grimbizis GF et al.: The ESHRE/ESGE consensus on the classification of female genital tract congenital anomalies. Hum Reprod 2013; 28(8): 2032-44 7 Pfeifer SM et al.: ASRM müllerian anomalies classification 2021. Fertil Steril 2021; 116(5):1238-52 8 Ludwin A et al.: Congenital Uterine Malformation by Experts (CUME): better criteria for distinguishing between normal/arcuate and septate uterus? Ultrasound Obstet Gynecol 2018; 51(1): 101-9 9 Ludwin A et al.: Congenital Uterine Malformation by Experts (CUME): diagnostic criteria for T-shaped uterus. Ultrasound Obstet Gynecol 2020; 55(6): 815-29 10 Harmsen MJ et al.: Consensus on revised definitions of Morphological Uterus Sonographic Assessment (MUSA) features of adenomyosis: results of modified Delphi procedure. Ultrasound Obstet Gynecol 2022; 60(1): 118-31 11 Timmermann D et al.: Terms, definitions and measurements to describe the sonographic features of adnexal tumors: a consensus opinion from the International Ovarian Tumor Analysis (IOTA) Group. Ultrasound Obstet Gynecol 2000; 16(5): 500-5 12 Guerriero S et al.: Assessing the reproducibility of the IOTA simple ultrasound rules for classifying adnexal masses as benign or malignant using stored 3D volumes. Eur J Obstet Gynecol Reprod Biol 2013; 171(1): 157-60 13 Saleh AM et al.: The role of three-dimensional ultrasound in gynecology. J Womens Health 2019; 1(1): 4
Das könnte Sie auch interessieren:
Welche Risiken sind zu erwarten?
Die präventive Mastektomie wird vor allem bei genetischer Vorbelastung, z.B. bei BRCA1/2-Mutationen, erwogen. Der Eingriff kann das Brustkrebs-Erkrankungsrisiko deutlich reduzieren, aber ...
Operative Therapie und Risikoreduktion bei BRCA-Mutations-Trägerinnen
Familiäre Krebserkrankungen, besonders durch pathogene Genveränderungen bedingt, sind vermehrt in den Fokus der Forschung gerückt. Dies zeigt sich vor allem bei Brustkrebs (BC). Das ...
AI in der Reproduktionsmedizin
Kein Thema bewegt derzeit die Menschen mehr als künstliche Intelligenz (AI – „artificial intelligence“). Wiewohl in der Behandlung des unerfüllten Kinderwunsches in den letzten ...