Therapiefortschritte bei CML
Autor:
Prim. Univ.-Prof. Dr. Andreas Petzer
Abteilungen Interne I für Hämatologie mit Stammzelltransplantation, Hämostaseologie und Medizinische Onkologie am Ordensklinikum Linz
E-Mail: andreas.petzer@ordensklinikum.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
In der Therapie der chronischen myeloischen Leukämie bestätigt der STAMP-Inhibitor Asciminib seine gute Wirksamkeit und Verträglichkeit in verschiedenen Regimes. Außerdem wurden Daten zu einem neuen STAMP-Inhibitor, TGRX-678, sowie zum Einsatz von Ponatinib in der Erstlinie vorgestellt. Erwähnenswert sind auch das exzellente progressionsfreie Überleben und das Gesamtüberleben unter Nilotinib-Monotherapie nach acht Jahren in der TIGER-Studie.
Endauswertung der Phase-I-Studie mit Asciminib
Beim ASH-Meeting wurden die Endauswertungen der Phase-I-Studie mit Asciminib bei Patienten und Patientinnen mit chronischer myeloischer Leukämie (CML) in chronischer Phase (CP) präsentiert. Dabei wurde Asciminib zunächst in unterschiedlichen Dosisstufen eskaliert. In weiterer Folge wurde Asciminib mit 2x40mg täglich (die mittlerweile zugelassene Dosierung bei ≥2 Vortherapien) für alle Teilnehmenden fortgesetzt. Ausgenommen waren Betroffene mit einer T315I-Mutation, da bekannt war, dass diese eine höhere Dosis benötigen. Die mediane Dauer der Applikation betrug 5,9 Jahre, das Maximum waren 8,4 Jahre. Die Teilnehmenden waren stark vorbehandelt: Mehr als 70% von ihnen hatten zuvor ≥3 TyrosinkinaseInhibitoren (TKI) erhalten. Zudem war bei über der Hälfte kein oder nur ein minimales molekulares Ansprechen auf den letzten TKI erzielt worden (BCR-ABL1IS >1%).
Unter diesen stark vorbehandelten Patienten und Patientinnen konnte kumulativ bei jenen, die bei Studieneinschluss keine gute molekulare Remission („major molecular remission“, MMR, MR3) aufwiesen, in zwei Drittel der Fälle (65,1%) eine MMR erzielt werden.
Beeindruckend ist auch die Dauer der Applikation von Asciminib. Während bei zwei vorangegangenen TKI die mediane Applikationsdauer des letztverwendeten TKI bei 1,2 Jahren lag, betrug die Dauer der anschließenden Applikation von Asciminib 5,9 Jahre. Bei ≥4 TKI in der Vorbehandlung betrug die Applikationsdauer des zuletzt verwendeten TKI nur 0,4 Jahre, für das anschließend applizierte Asciminib im Median 5,7 Jahre! Diese Daten zeigen sehr eindrücklich, dass Asciminib offensichtlich nicht nur eine sehr gut wirksame, sondern auch eine gut verträgliche Substanz ist.
Bezüglich der Verträglichkeit ist zu erwähnen, dass sehr wohl auch unter Asciminib in etwa 80% der Fälle Nebenwirkungen ≥Grad 3 beobachtet wurden. Dabei handelte es sich unter anderem um Lipaseerhöhungen (21,7%) ohne typisches klinisches Bild einer Pankreatitis, schwere Thrombozytopenien (13,9%) oder Hypertension (18,3%). Diese können in der Regel durch Dosisreduzierungen und/oder Unterbrechungen bei Lipaseerhöhungen und Thrombozytopenien oder bei Hypertension durch den Einsatz zusätzlicher Therapien kontrolliert bzw. behoben werden. Nur in 13% kam es zu Therapieabbrüchen. Generell traten Nebenwirkungen jeglichen Schweregrades unter Asciminib überwiegend im ersten Jahr der Applikation auf.
Arteriell-okklusive Ereignisse (alle Graduierungen) traten in 12% der Fälle auf, ≥Grad 3 in 6% der Fälle. Dabei ist zu berücksichtigen, dass natürlich auch Behandlungen vor dem Beginn der Therapie mit Asciminib eine Rolle spielen können. Erfreulicherweise führte jedoch kein arteriell-okklusives Ereignis dazu, dass die Therapie mit Asciminib dauerhaft beendet werden musste.
Asciminib in der Erstlinientherapie
Mittlerweile wird Asciminib auch in der Erstlinie getestet. In der ASC4FIRST-Studie wurden CML-Patientinnen und -Patienten in CP ohne vorangegangene TKI-Behandlung randomisiert und erhielten entweder Asciminib 80mg 1x täglich oder eine Medikation nach Wahl des Investigators bezüglich aller für die Erstlinie zugelassenen TKI. Diese Studie ist bereits fertig rekrutiert, allerdings gibt es noch keine Daten.
Anders stellt sich das für die ASCENT-Studie der australasiatischen Studiengruppe ALLG dar. In dieser Studie wurden die Teilnehmenden in der ersten Linie mit Asciminib 40mg 2x täglich behandelt. Das weitere Vorgehen richtete sich nach den molekularen Zielpunkten des Europäischen Leukämienetzwerkes (ELN). Erreichten die Betroffenen ein optimales Ansprechen nach ELN, wurde Asciminib in einer Gesamtdosis von 80mg täglich fortgeführt. Bei suboptimalem Ansprechen bestand die Möglichkeit, Asciminib auf 2x 80mg täglich zu erhöhen. Kam es zu einem Therapieversagen (BCR-ABL1IS >10% nach 3 oder 6 Monaten bzw. BCR-ABL1IS >1% nach 12 oder 18 Monaten), konnte zu Asciminib ein ATP-kompetitiver TKI (Nilotinib, Dasatinib oder Imatinib) hinzugefügt werden. Als primärer Endpunkt wurden das frühe molekulare Ansprechen (BCR-ABL1IS ≤10% nach 3 Monaten) sowie das tiefe molekulare Ansprechen (MMR, MR3; BCR-ABL1IS ≤0,1%) nach 12 Monaten gewählt. 94% der Teilnehmenden erzielten mit Asciminib ein frühes molekulares Ansprechen nach 3 Monaten. Nach 12 Monaten erreichten 78% eine MMR und 32% der Patientinnen und Patienten erzielten nach 12 Monaten eine MR4.5. Damit liegt Asciminib im Bereich von Zweitgenerations(2G)-Tyrosinkinase-Inhibitoren in der ersten Linie. An Nebenwirkungen wurden Hämatotoxizität, vor allem Thrombozytopenie und Neutropenie, beobachtet sowie Erhöhungen der Leberfunktionsproben und Lipaseerhöhungen. Ansonsten waren die häufigsten Nebenwirkungen Fatigue, Übelkeit, Erbrechen, Durchfall, Kopfschmerzen, Gelenkschmerzen und Hautprobleme, wobei alle letztgenannten Nebenwirkungen nur im Bereich von Grad 1 bis 2 lagen. Auch gab es bislang nur ein arteriell-okklusives Ereignis bei einer 73-jährigen Patientin mit präexistierendem Diabetes, Bluthochdruck und hohem Body-Mass-Index.
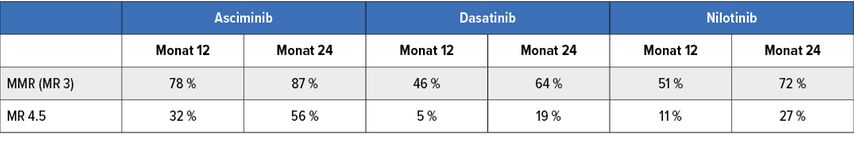
Die ASCENT-Studie berichtet über ein exzellentes kumulatives molekulares Ansprechen nach 12 Monaten von 78% und nach 24 Monaten von 87%. Die MR-4.5-Rate betrug nach 12 Monaten kumulativ 32% bzw. nach 24 Monaten 56%. Wie in der Tabelle dargestellt, liegt das molekulare Ansprechen damit doch deutlich höher als für die 2G-TKI Nilotinib oder Dasatinib in den Zulassungsstudien ENESTnd oder DASISION. Asciminib scheint somit zukünftig eine hochwirksame und gut verträgliche Therapieoption für die Erstlinientherapie darzustellen.
Tab. 1: Vergleich kumulativer Ansprechraten von Asciminib (ASCEND-Studie), Dasatinib (DASISION-Studie) und Nilotinib (ENESTnd-Studie) in der Erstlinientherapie bei CML in CP
Asciminib-„Add-on“ zu ATP-kompetitiven TKI
Aufgrund der Tatsache, dass Asciminib an die Myristoyltasche bindet und nicht wie alle anderen bislang bei der CML zugelassenen TKI an die ATP-Bindungsstelle, eignet sich Asciminib grundsätzlich auch hervorragend als „Add-on“-Therapie bei Versagen einer Therapie mit einem ATP-kompetitiven TKI. Dazu wurden zwei Studien vorgestellt.
In der ASC4MORE-Studie wurden bei suboptimalem Ansprechen (BCR-ABL1IS ≤1% und >0,01%) die folgenden Optionen getestet: entweder Beibehalten von Imatinib 400mg, alternativ dazu Beibehalten von Imatinib 400mg und zusätzliche Gabe von Asciminib 40mg oder 60mg, oder ein Wechsel auf Nilotinib 300mg 2x täglich. Der primäre Endpunkt, das Erreichen einer MR 4.5 zu Woche 48, wurde bereits letztes Jahr beim ASH präsentiert und hat gezeigt, dass Asciminib als „Add-on“ zu Imatinib höhere Raten an MR 4.5 erreicht (19% bzw. 29%) als Imatinib (0%) oder Nilotinib (4,8%).
In der aktuellen Analyse wurde der zweite Endpunkt, die MR-4.5-Rate nach 96 Wochen, berichtet. Dabei zeigt sich, dass Asciminib als „Add-on“ mit 40mg und 60mg MR-4.5-Raten von jeweils 19% erreichte, der Wechsel auf Nilotinib in 9,5% und das Fortführen von Imatinib in 4,8% der Fälle. Die Abbruchrate unter Asciminib-„Add-on“ zu Imatinib war geringer als bei einem Switch auf Nilotinib, jedoch etwas höher im Vergleich zum Fortführen einer Imatinib-Monotherapie. Unklar bleibt zum gegenwärtigen Zeitpunkt allerdings, ob eine Asciminib-Monotherapie in Normaldosierung (80mg täglich) möglicherweise effektiver oder zumindest gleich effektiv, aber nebenwirkungsärmer ist als eine niedrig dosierte Asciminib-„Add-on“-Therapie.
Eine weitere Phase-I-Studie zu diesem Thema wurde ebenfalls beim ASH-Meeting präsentiert. Dabei wurden die ATP-kompetitiven Inhibitoren in ihrer Dosierung entsprechend der Zulassung beibehalten (Nilotinib 300mg 2x täglich, Imatinib 400mg 1x täglich, Dasatinib 100mg 1x täglich). Zu diesen ATP-kompetitiven TKI wurde Asciminib in unterschiedlichen Dosierungen in einer Dosiseskalierungs-phase getestet und anschließend wurde in einer Dosisexpansionskohorte zu Nilotinib Asciminib 40mg 2x täglich, zu Imatinib Asciminib 40mg und 60mg 1x täglich und zu Dasatinib Asciminib 80mg 1x täglich hinzugegeben. Es handelte sich wieder um stark vorbehandelte Patientinnen und Patienten, 19–40% von ihnen hatten bereits ≥4 TKI erhalten. Das molekulare Ansprechen bei Studieneinschluss war ebenfalls gering: 60–70% der Betroffenen hatten BCR-ABL1IS-Werte >1%. Insgesamt zeigte sich ein rasches Therapieansprechen, die Nebenwirkungsraten waren jedoch stärker als unter Asciminib-Monotherapie. Erwähnenswert ist auch, dass ungefähr 50% der Teilnehmenden nach der Studie mit einer Asciminib-Monotherapie weiterbehandelt wurden. Insgesamt lässt sich sagen, dass grundsätzlich Asciminib zu ATP-kompetitiven Inhibitoren hinzugefügt werden kann und dies auch einigermaßen verträglich ist. Offen bleibt jedoch die Frage, ob nicht eine normal dosierte Asciminib-Monotherapie bei einem größeren Teil der Patienten und Patientinnen ausreichend und mit weniger Nebenwirkungen verbunden ist.
Neuer STAMP-Inhibitor TGRX-678
Beim ASH-Meeting wurde auch ein neuer STAMP-Inhibitor vorgestellt: TGRX-678. Dieser soll unter anderem eine verbesserte Permeabilität und eine gesteigerte Bioaktivität haben. Dieser Inhibitor ist gegen >300 Kinasen gerichtet. Die Studie zeigte grundsätzlich ein gutes Ansprechen nicht nur in CP, sondern auch in akzelerierter Phase und inkludierte Patienten und Patientinnen mit T315I-Mutationen sowie bereits mit Asciminib vorbehandelte Personen.
Ponatinibinduktion gefolgt von Imatiniberhaltung in der ersten Linie (TIPI-Trial)
Die französische Arbeitsgruppe präsentierte interessante Daten zur Verwendung von Ponatinib in der Erstlinie. Bekanntermaßen war Ponatinib in der Erstlinie vorerst gescheitert, zumal im EPIC-Trial hohe Raten an kardiovaskulären Nebenwirkungen unter Ponatinib 45mg/d beobachtet wurden und die Studie vorzeitig beendet werden musste. In den von Lipton ausgearbeiteten Daten aus der EPIC-Studie zeigte sich jedoch, dass bei zehn auswertbaren Teilnehmenden 60% nach zwölf Monaten eine MR 4.5 erzielten (im Gegensatz dazu bei Imatinib 0%).
Deshalb wurde der TIPI-Trial mit dem Ziel initiiert, Ponatinib in reduzierter Dosierung von 30mg/d über maximal sechs Monate zu applizieren und im Anschluss auf Imatinib 400mg/d zu wechseln. Primärer Endpunkt war das Erreichen einer MR 4.5 nach 36 Monaten.
Es zeigte sich ein hervorragendes Ansprechen mit einer Rate an frühen molekularen Remissionen (BCR-ABL1IS <10%) nach drei Monaten von 97%, einer Rate an kompletten zytogenetischen Remissionen nach drei Monaten von 70,5% und einer MMR-Rate von 57% nach sechs Monaten.
Die kardiovaskuläre Toxizität war jedoch mit 6,5% ähnlich hoch wie in der EPIC-Studie (7%). Die schweren kardiovaskulären Toxizitäten konnten von 7% (EPIC-Studie) auf 3,5% reduziert werden. Insgesamt ist die kardiovaskuläre Toxizität trotz reduzierter Ponatinib-Dosis und Applikationsdauer bei exzellentem Ansprechen anscheinend nach wie vor kritisch.
TIGER-Studie: exzellentes Gesamtüberleben mit Nilotinib
Die TIGER-Studie verglich bei neu diagnostizierten Personen mit CML in CP den 2G-TKI Nilotinib mit Nilotinib plus pegyliertem Interferon-α. Bei Erreichen einer MMR erfolgte im experimentellen Arm ein Wechsel auf eine Erhaltungstherapie mit alleinigem pegyliertem Interferon-α. Im Standardarm wurde Nilotinib beibehalten. Insgesamt zeigte sich kein signifikanter Unterschied zwischen den beiden Armen. Erwähnenswert ist diese Studie jedoch aufgrund des exzellenten progressionsfreien Überlebens (93%) und Gesamtüberlebens (95%), welches mit Nilotinib-Monotherapie nach acht Jahren erreicht wurde. Zukünftige Endpunkte von Studien mit 2G- oder 3G-TKI sollten sich deshalb nicht mehr an der Verlängerung des Gesamtüberlebens messen, sondern die bestmögliche Tolerabilität evaluieren, mit der letzten Endes eine behandlungsfreie Remission erzielt werden kann.
Literatur:
beim Verfasser
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...