Highlights zu neurodegenerativen Erkrankungen vom EAN-Kongress
Bericht: Dipl.-Ing. Dr. Manuel Spalt-Zoidl
Prof. Dr. Elena Moro, Präsidentin der European Academy of Neurology (EAN), eröffnete den elften Kongress der Vereinigung in Helsinki. Führende Expert:innen verschiedener Fachrichtungen der Neurologie präsentierten Daten und Fakten zu innovativen pharmakologischen Behandlungen und neuen Biomarkern für die Therapie neurodegenerativer Erkrankungen.
Belastung und Kosten durch neurologische Erkrankungen in Europa
Schätzungen zufolge sind etwa 449,2 Millionen Menschen in Europa von neurologischen Erkrankungen betroffen, begann Prof. Dr. Maurizio Leone, Italien, seine Ausführungen. Diese führen zu 1,8 Millionen Todesfällen pro Jahr. Interessanterweise sind nur sechs Erkrankungen für 95% der Belastung verantwortlich. Diese sind Spannungskopfschmerzen, Migräne, diabetische Neuropathie, Schlaganfälle, Alzheimer- und andere Demenzerkrankungen sowie traumatische Verletzungen am Gehirn. Die Prävalenz der Erkrankung korrespondiert nicht immer mit der Belastung durch die Erkrankung. So sind Spannungskopfschmerzen auf Rang eins der Prävalenz, aber nur auf Rang elf der „disability-adjusted life years“ (DALYs), einer Einschätzung der Belastung für Patient:innen, zu finden. Umgekehrt treten maligne Erkrankungen des Nervensystems mit einem Prävalenz-Rang von 17 seltener auf, sind jedoch mit Rang fünf der DALYs wesentlich belastender für die Betroffenen und deren Angehörige. Besonders spannend ist – laut Leone – die Veränderung der Prävalenz zwischen 1990 und 2021. So sind Infektionskrankheiten wie Meningitis, Tollwut und Tetanus stark rückläufig, während die Prävalenzen neurodegenerativer Erkrankungen angestiegen sind.1
Mateo Montes Martinez, Deutschland, wertete die direkten und indirekten Kosten durch neurologische Erkrankungen in 47 europäischen Ländern aus. Die geschätzten Gesamtkosten belaufen sich auf 1,23 Billionen Euro im Jahr, wobei in Italien, Deutschland, dem Vereinigten Königreich, Spanien und Frankreich 70% dieser Kosten anfallen. Der überwiegende Teil wird durch Kopfschmerzerkrankungen, gefolgt von Demenzerkrankungen verursacht.2
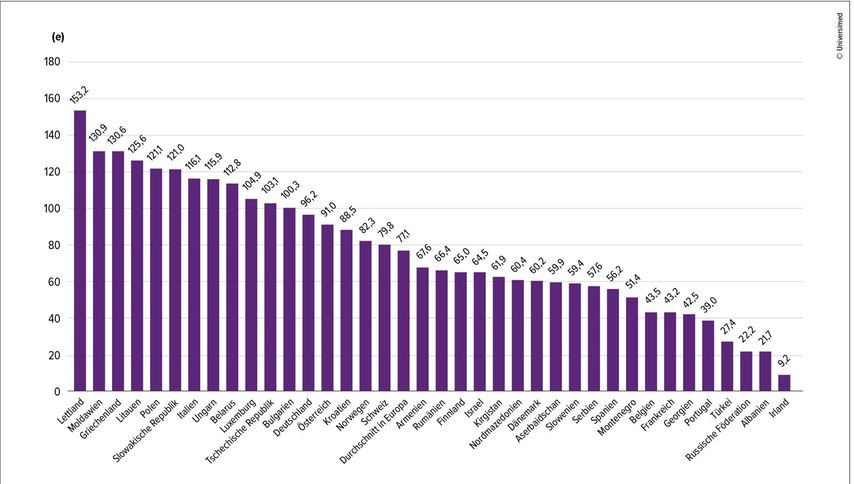
Für Prof. Dr. Claudio Bassetti, Schweiz, ist klar, dass allgemeine Neurolog:innen eine Schlüsselrolle in der Bewältigung der wachsenden Belastung und der steigenden Kosten einnehmen. Allerdings ist die vorhandene Arbeitskraft in vielen Regionen der Welt nicht ausreichend. So kommen in der Schweiz nur 79,8 Neurolog:innen auf 1000000 Einwohner; in Irland sind es sogar nur 9,2 (Abb. 1).3
Abb. 1: Anzahl allgemeiner Neurolog:innen pro 1000000 Einwohner in Europa (modifiziert nach Bassetti CLA et al.)3
Highlights bei pharmakologischen Behandlungen
Die Behandlung von Demenzerkrankungen
Monoklonale Antikörper, die gegen Amyloid gerichtet sind, sind aufgrund rezenter Zulassungen in Europa in den Mittelpunkt der Aufmerksamkeit gerückt, berichtete Dr. Matilde Bruno, Italien. Die Arzneimittel wurden bei Patient:innen in einer frühen Phase der Alzheimerkrankheit (AD) oder der leichten kognitiven Störung (MCI) untersucht. Obwohl klinische Studien ein statistisch signifikantes Wirksamkeitsprofil zeigten, ist deren Einsatz in der klinischen Praxis mit großen Herausforderungen verbunden. Die wesentlichste ist hier das Auftreten von „amyloid-related imaging abnormalities“ (ARIA), einer teilweise schwerwiegenden Nebenwirkung, die zum Tod der Patient:innen führen kann. Um diese rechtzeitig zu erkennen und zu behandeln, ist ein regelmäßiges Monitoring mittels Magnetresonanztomografie (MRT) zwingend erforderlich. Die Bildgebung muss ein Jahr vor dem Start der pharmakologischen Behandlung, vor der fünften, siebten und vierzehnten Infusion sowie immer, wenn ARIA-Symptome auftreten, durchgeführt werden. Voraussetzungen für einen wirksamen und sicheren Einsatz der Arzneimittel umfassen die diagnostische Expertise der Behandlungszentren und Zugänge zu Amyloid-Positronenemissionstomografie und MRT-Scans. Außerdem sollte die Kapazität für regelmäßige Infusionen und die Behandlung etwaiger infusionsbedingter Reaktionen gewährleistet sein, betonte Bruno.4
Die Behandlung von Kopfschmerzerkrankungen
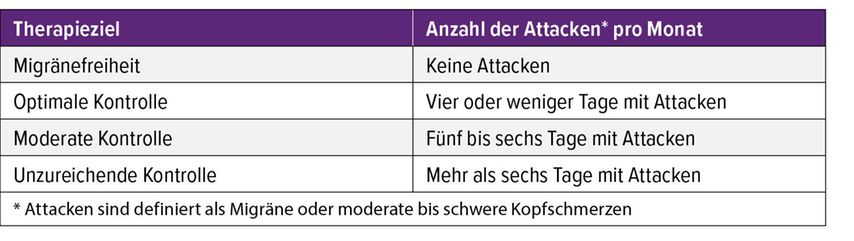
Monoklonale Antikörper, die gegen das „calcitonin gene-related peptide“ gerichtet sind (anti-CGRP-mAbs), sind dagegen als wirksame und verträgliche Behandlungsoption der Migräneprophylaxe etabliert. Die Wirksamkeit dieser Arzneimittel wird in klinischen Studien unter anderem anhand der Ansprechrate ermittelt. Dieser Endpunkt beschreibt jenen Anteil an Patient:innen, die mindestens eine 50-prozentige Reduktion ihrer Migränekopfschmerztage pro Monat erreichen. Um den Behandlungsstandard in der klinischen Praxis zu verbessern, schlägt die International Headache Society allerdings alternative Behandlungsziele vor (Tab. 1).5
Tab. 1: Therapieziele für Anti-CGRP-mAbs für die Migräneprophylaxe im Praxisalltag (nach Sacco S et al.)5
Dr. Edoardo Caronna, Barcelona, untersuchte anhand einer prospektiven multizentrischen Studie den Anteil der Patient:innen, deren Ansprechen im Praxisalltag diesen Zielen entsprach. Nach sechs Behandlungsmonaten mit Anti-CGRP-mAbs berichteten 6,9% von Migränefreiheit, 32,0% hatten eine optimale, 15,5% eine moderate und 45,6% eine unzureichende Kontrolle der Migräne. Besonders spannend ist, so Caronna, dass 27,1% der Patient:innen mit unzureichender Kontrolle ihrer Migräne die traditionelle 50-prozentige Ansprechrate laut Studienkriterien erreicht hätten.6
Neben Anti-CGRP-mAbs könnten auch Glucagon-like-Peptide-1-Rezeptor-Agonisten (GLP-1-RA) eine wirksame Behandlung der Migräne darstellen. Anhand einer Studie evaluierten Dr. Simone Braca, Italien, und Kolleg:innen die Wirkung von GLP-1-RA bei 31 Patient:innen mit Migräne und Adipositas. Im Vergleich zur vorangegangenen Behandlung reduzierte die Zugabe des Arzneimittels die durchschnittlichen Migränekopfschmerztage um 9,1 (95% CI: 5,41–12,84). Eine statistisch signifikante Gewichtsreduktion konnte in dieser Studie jedoch nicht beobachtet werden. Die positive Wirkung von GLP-1-RA scheint somit nicht durch eine Gewichtsreduktion, sondern durch andere Mechanismen bedingt zu sein.7
Die Behandlung der Parkinson-krankheit
Die Parkinsonkrankheit (PD) ist die zweithäufigste neurodegenerative Erkrankung weltweit. Schätzungen zufolge wird sich die Anzahl der Betroffenen bis 2050 mehr als verdoppeln und 25,2 Millionen Fälle umfassen. Für die Diagnose der PD sind nach wie vor Bradykinesie sowie Muskelsteifheit oder ein Ruhetremor von 4–6 Hz ausschlaggebend. Eine pharmakologische Behandlung wird laut Leitlinien erst empfohlen, wenn motorische Symptome beginnen, die Lebensqualität zu beeinflussen.8
Um die Empfehlungen der pharmakologischen Erstlinientherapie zu überarbeiten, verglichen Dr. Katarzyna Smilowska, Polen, und Kolleg:innen die Wirksamkeit von Levodopa, Dopamin-Agonisten, Monoaminoxidase-B-Inhibitoren (MAO-B-Inhibitoren), Amantadin und Kombinationen dieser Therapien zur Behandlung der frühen PD. Die eingereichten Vorschläge für die Empfehlungen umfassen, bei Menschen mit früher PD orale Formulierungen von Levodopa zu verabreichen. Alternativ können Dopamin-Agonisten oder MAO-B-Inhibitoren in Erwägung gezogen werden, wobei Levodopa bevorzugt werden sollte. Eine Kombinationstherapie sollte zu Beginn nicht verabreicht werden. Amantadin kann weder empfohlen noch nicht empfohlen werden.9
Die Behandlung der Myasthenia gravis
Durch die Zulassungen von Komplementinhibitoren des C5 und des neonatalen Fc-Rezeptors (FcRn) kam es in den letzten Jahren zu beeindruckenden Fortschritten bei der Behandlung der generalisierten Myasthenia gravis (gMG), berichtete Dr. Menekse Oeztuerk, Deutschland.10 Anhand einer retrospektiven Kohortenstudie untersuchten Oeztuerk und Kolleg:innen bei 153 Patient:innen, ob der Zeitpunkt, zu dem diese Arzneimittel zur Standardbehandlung addiert werden, einen Einfluss auf ihre Wirksamkeit hat. Die Patient:innen wurden je nach Zeitpunkt des Zusatztherapiebeginns stratifiziert. Patient:innen, welche innerhalb von 24 Monaten die Zusatztherapie erhielten (n=36), zeigten frühere und stärkere Reduktionen beim MG Activities of Daily Living Score (MG-ADL-Score) gegenüber Patient:innen, bei denen erst nach 24 Monaten ein C5- oder FcRn-Inhibitor zugegeben wurde (n=117; maximale Reduktion –5,0 ± 3,4 Punkte vs. –3,4 ± 3,9 Punkte; p=0,04).11
Highlights bei Biomarkern neurodegenerativer Erkrankungen
Aufgrund der Irreversibilität von neurodegenerativen Erkrankungen sollte eine pharmakologische Behandlung so früh wie möglich, optimalerweise schon vor dem Beginn der ersten Symptome eingeleitet werden können, sind sich die Expert:innen einig. Um dies zu erreichen, sind Biomarker mit einer hohen Sensitivität und Spezifität zwingend erforderlich.
Biomarker bei Demenzerkrankungen
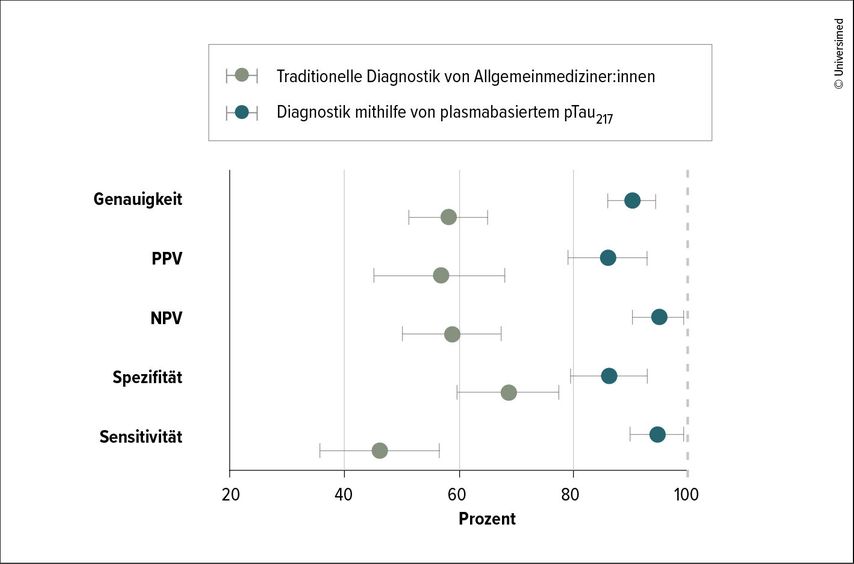
Die AD verläuft entlang einer Kaskade, in der Aggregate von Amyloid beta (Aβ) und Neurofibrillenbündel des Tau-Proteins zu Entzündungsreaktionen, synaptischer Degeneration und letztendlich zu progressiven kognitiven und funktionellen Defiziten führen.12 Pathophysiologische Biomarker können über Bildgebung und Liquoranalysen nachgewiesen werden. Diese Werkzeuge stehen in der Regel aber nur spezialisierten Zentren zur Verfügung, erläuterte Prof. Dr. Michael Schöll, Schweden.13, 14 Plasmabasierte Biomarker haben das Potenzial, die Diagnose bereits in der Praxis von Allgemeinmediziner:innen mit hoher Genauigkeit zu etablieren. Kommerziell stehen hierfür Tests zur Verfügung, um das Verhältnis zwischen Aβ42 zu Aβ40 oder phosphorylierter Tau-Spezies, wie pTau217 und pTau181, nachzuweisen .15 Gegenwärtig ist pTau217 mit einer Fläche unter der Kurve (AUC) von bis zu 0,93 (95% CI: 0,90–0,97) der vielversprechendste plasmabasierte Biomarker.16 So konnte dieser in einer Studie bei 1213 Patient:innen die Diagnosegenauigkeit von Allgemeinmediziner:innen von 61% (95% CI: 53–69) auf 90% (95% CI: 88–91) steigern (Abb.2).17
Abb. 2: Genauigkeit, positiver prädiktiver Wert (PPV), negativer prädiktiver Wert (NPV), Spezifität und Sensitivität bei traditioneller Diagnostik (grau) und Diagnostik mithilfe von plasmabasiertem pTau217 (blau) durch Allgemeinmedizinier:innen (modifiziert nach Palmqvist S et al.)17
Ähnlich wie bei der AD findet man auch bei der häufigsten Form der frontotemporalen Demenz (FTD) pathologische Ablagerungen im Gehirn von Betroffenen. In diesem Fall handelt es sich um TDP-43. Um dieses nachzuweisen, wurden spezielle Verfahren, sogenannte „seed amplification assays“ (SAA) entwickelt. Hier wird die monomere Form des Zielmoleküls mit einer kleinen Menge Liquor, Plasma oder sogar Tränenflüssigkeit von Betroffenen gemischt. Über mehrere Inkubationszyklen kommt es, wenn pathologische Spezies in der Körperflüssigkeit der Betroffenen vorhanden sind, zu einer zunehmenden Fehlfaltung und Aggregation der monomeren Moleküle, welche wiederum über Fluoreszenzspektroskopie quantifiziert werden können. Für den Nachweis von TDP-43 wurden SAA entwickelt, welche bei Patient:innen mit FTD eine Sensitivität von 94% und eine Spezifität von 85% erreichen, zeigte Dr. Paola Caroppo, Italien.18
Um zu überprüfen, ob TDP-43-SAA eine FTD auch Jahre vor den ersten Symptomen erfassen können, führten Caroppo und Kolleg:innen eine Studie bei 14 präsymptomatischen Patient:innen mit familiärer FTD und 14 gesunden Teilnehmer:innen durch. Der TDP-43-SAA detektierte FTD in sechs von 14 Fällen korrekt und lieferte ein falsch positives Ergebnis. Dies entspricht einer Sensitivität von 67% und einer Spezifität von 93%.19
Biomarker bei α-Synukleinopathien
Im Bereich der α-Synukleinopathien, welche unter anderem die PD, Multisystematrophien (MSA) und Demenz mit Lewy-Körperchen (DLB) umfassen, hat sich α-Synuklein als potenzieller Biomarker herauskristallisiert, berichtete Prof. Dr. Wassilios Meissner, Frankreich.20 Auch für den Nachweis von α-Synuklein wurden spezielle SAA entwickelt. Diese erreichen heute eine Sensitivität für den Nachweis von PD von 94%.21
Biomarker beim Guillain-Barré-Syndrom
Anders als bei den häufigsten Demenzformen und Synukleinopathien gibt es für das Guillain-Barré-Syndrom (GBS) noch keine etablierten Biomarker. Dr. Roger Collet Vidiella, Spanien, und Kolleg:innen verglichen die Proteome von 20 GBS-Patient:innen mit jenen von 15 gesunden Proband:innen, um potenzielle Biomarker zu identifizieren. Mithilfe der SomaScan-7k-Plattform wurden über 6000 Proteinspiegel bei Baseline und nach 12 Monaten sowie bei den gesunden Proband:innen erhoben.
Die Arbeitsgruppe identifizierte insgesamt 196 Proteine, deren Spiegel sich innerhalb von 12 Monaten signifikant veränderte oder signifikant von gesunden Proband:innen abwich. Obwohl noch keine eindeutigen Ergebnisse vorliegen, stach für Collet Vidiella das Serum-Amyloid A1 (SAA1) als potenzieller Biomarker für das GBS hervor. Dieser müsse, so der Vortragende, allerdings in weiteren Studien evaluiert werden.22
Fazit
Neurologische Erkrankungen stellen in Europa eine enorme gesundheitliche und ökonomische Belastung dar. Moderne Arzneimittel, wie monoklonale Antikörper und Komplementinhibitoren, aber auch etablierte Moleküle wie Levodopa und MAO-B-Inhibitoren, bieten vielversprechende Ansätze zur Behandlung verschiedener Krankheitsbilder. Für die Expert:innen rückt die frühzeitige Diagnose mittels sensitiver und spezifischer Biomarker zunehmend in den Vordergrund. SAA und blutbasierte Biomarker nehmen hier eine Schlüsselrolle ein.
Quelle:
11th Congress of the European Academy of Neurology, 21.–24. Juni 2025, Helsinki
Literatur:
1 GBD 2021 Nervous System Disorders Collaborators: Global, regional, and national burden of disorders affecting the nervous system, 1990–2021: a systematic analysis for the Global Burden of Disease Study 2021. Lancet Neurol 2024; 23(4): 344-81 2 Martinez MM et al.: COIN-EU: The cost of neurological disorders in Europe. EAN 2025, Abstract #SPS12_2 3 Bassetti CLA et al.: General neurology: current challenges and future implications. Eur J Neurol 2024; 31(6): e16237 4 Cummings J et al.: Lecanemab: appropriate use recommendations. J Prev Alzheimers Dis 2023; 10(3): 362-77 5 Sacco S et al.: Setting higher standards for migraine prevention: a position statement of the International Headache Society. Cephalalgia 2025; 45(2): 3331024251320608 6 Caronna E et al.: Redefining migraine prevention: early treatment with anti-CGRP monoclonal antibodies enhances response in the real world. J Neurol Neurosurg Psychiatry 2024; 95(10): 927-37 7 Braca S et al.: Effectiveness and tolerability of liraglutide as add-on treatment in patients with obesity and high-frequency or chronic migraine: a prospective pilot study. Headache 2025; epub ahead of print 8 Postuma RB et al.: MDS clinical diagnostic criteria for Parkinson’s disease. Mov Disord 2015; 30(12): 1591-601 9 Smilowska K et al.: EAN-MDS-ES guideline on Parkinson’s disease – part II: Pharmacological management of motor symptoms – section 1: First-line treatment for initial monotherapy in early Parkinson’s disease. EAN 2025, Abstract #SPS04_2 10 Binks SNM et al.: Myasthenia gravis in 2025: five new things and four hopes for the future. J Neurol 2025; 272(3): 226 11 Oeztuerk M et al.: Early versus delayed add-on therapy in generalized myasthenia gravis: A multicentre real-world cohort study. Präsentiert am EAN 2025; 21.–24. Juni, Helsinki 12 Blennow K: Phenotyping Alzheimer’s disease with blood tests. Science 2021; 373(6555): 626-8 13 Swedish registry for cognitive/dementia disorders https://www.ucr.uu.se/svedem; zuletzt abgerufen am 01.07.2025 14 Leuzy A et al.: In vivo detection of Alzheimer’s disease. Yale J Biol Med 2018; 91(3): 291-300 15 Schöll M et al.: Cutting through the noise: a narrative review of Alzheimer’s disease plasma biomarkers for routine clinical use. J Prev Alzheimers Dis 2025; 12(4): 100056 16 Ashton NJ et al.: Diagnostic accuracy of a plasma phosphorylated tau 217 immunoassay for Alzheimer disease pathology. JAMA Neurol 2024; 81(3): 255-63 17 Palmqvist S et al.: Blood biomarkers to detect Alzheimer disease in primary care and secondary care. JAMA 2024; 332(15): 1245-57 18 Scialò C et al.: TDP-43 real-time quaking induced conversion reaction optimization and detection of seeding activity in CSF of amyotrophic lateral sclerosis and frontotemporal dementia patients. Brain Commun 2020; 2(2): fcaa142 19 Caroppo P et al.: Detection of misfolded TDP-43 in CSF of genetic FTD and FTD/ALS patients at both presymptomatic and symptomatic stages. EAN 2025, Abstract #LBN_05 20 Lashuel HA et al.: The many faces of α-synuclein: from structure and toxicity to therapeutic target. Nat Rev Neurosci 2013; 14(1): 38-48 21 Rossi M et al.: Ultrasensitive RT-QuIC assay with high sensitivity and specificity for Lewy body-associated synucleinopathies. Acta Neuropathol 2020; 140(1): 49-62 22 Collet Vidiella et al.: Proteomic profiling of Guillain-Barré syndrome using aptamers: identifying and validating potential biomarkers. EAN 2025; Abstract #OPR-027
Das könnte Sie auch interessieren:
Alzheimer: laufende klinische Studien, State of the Art der Biomarkerdiagnostik und gemischte Pathologien
Die Forschung an neuen Therapien für die Alzheimerkrankheit (AD) erfährt ein nie dagewesenes Momentum. Auf der internationalen Alzheimer- und Parkinsonkonferenz AD/PD in Wien gab es ...
Nahrungsergänzungsmittel bei ME/CFS: neue Hoffnung oder falsche Versprechen?
Chronische Erschöpfung, die nicht vergeht, Schmerzen, Konzentrationsprobleme, ein Leben in Zeitlupe. Myalgische Enzephalomyelitis/Chronisches Fatigue-Syndrom (ME/CFS) betrifft weltweit ...
Schlafbezogene Bewegungsstörungen: Was ist bekannt, was ist neu?
Schlafbezogene Bewegungsstörungen sind eine heterogene Krankheitsgruppe. Viele Krankheitsbilder treten nur selten auf. Einige wie die periodischen Beinbewegungen im Schlaf („periodic ...