Erfolge für neoadjuvante Immuntherapie bei frühem Mammakarzinom
Bericht: Dr. Ines Schmale
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Mit dem San Antonio Breast Cancer Symposium (SABCS) schließt alljährlich das wissenschaftliche Jahr zum Brustkrebs. Wichtige beim Kongress präsentierte Studienergebnisse bestätigen für das frühe Mammakarzinom einen positiven Einfluss der neoadjuvanten Checkpoint-Inhibitor-Therapie, wohingegen die adjuvante Behandlung wenig Nutzen erbrachte. Auch die adjuvante Bestrahlung der Lymphknoten kann selektierten Patient:innen erspart werden.
Biomarkeranalyse bestätigt PD-L1- und sTIL-Status
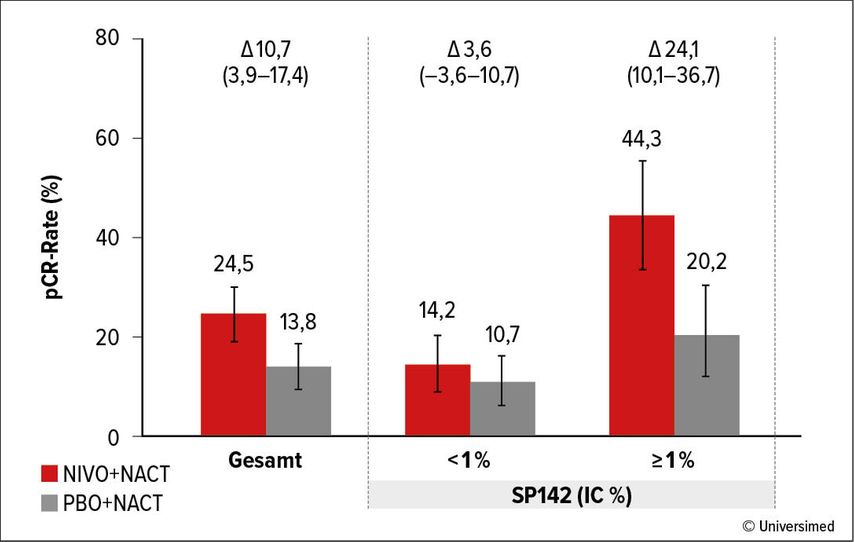
Die Phase-III-Studie CheckMate 7FL untersuchte placebokontrolliert die zusätzliche Gabe von Nivolumab zu einer neoadjuvanten Chemotherapie (4 Zyklen Paclitaxel + 4 Zyklen Anthrazyklin plus Cyclophosphamid) gefolgt von einer postoperativen endokrinen Therapie.1 Eingeschlossen waren Patient:innen mit hormonrezeptorpositivem und HER2-negativem (HR+/HER2–) Brustkrebs mit hohem Rezidivrisiko. Die Studie erreichte ihren primären Endpunkt und zeigte eine höhere Rate an pathologischen Komplettremissionen (pCR) durch die zusätzliche Immuntherapie (24,5% versus 13,8%; p=0,0021). Bei PD-L1-positiven Tumoren (IHC-Assay SP142 ≥1%) betrug die pCR-Rate 44,3% mit versus 20,2% ohne Nivolumab (Abb. 1). Eine geringe residuale Tumorlast (RCB 0–1) wurde mit einer Häufigkeit von 30,7% versus 21,3% häufiger im experimentellen Studienarm beobachtet. Beim SABCS wurden nun die Ergebnisse einer explorativen Biomarkeranalyse präsentiert. Im Ergebnis wurde eine verbesserte klinische Effektivität bei neoadjuvanter Nivolumab-Gabe beobachtet, wenn eine höhere PD-L1-Expression, ein höherer Anteil stromaler Tumor-infiltrierender Lymphozyten (sTIL) und eine niedrigere Expression des Hormonrezeptors vorlagen. Der Ki67-Index war nicht mit einem höheren Nutzen unter Nivolumab assoziiert. Im Vergleich der Aussagekraft der Biomarker zeigte sich eine gute Übereinstimmung der PD-L1-IHC-Assays SP142 und 28–8, aber eine weniger gute Übereinstimmung der PD-L1-Assays mit dem sTIL-Spiegel.
Abb. 1: Pathologische Komplettremissionen (pCR) abhängig von PD-L1-Status, gemessen mittels IHC-Assay SP142 (IC%). Modifiziert nach Loi S et al. 20231
Parallele Gabe von Nivolumab plus Chemotherapie
Nivolumab plus neoadjuvante Chemotherapie (Carboplatin plus Paclitaxel) wurde auch in der Phase-II-Studie BCT1902/IBCSG 61–20 Neo-N untersucht, hier beim tripelnegativen Brustkrebs im Stadium I/II.2 Da frühere Studien mit neoadjuvanten Immuntherapien auf bessere Therapieerfolge mit einer zeitlich versetzten initialen Gabe hinwiesen, wurde der versetzte Therapiestart von Immun- und Chemotherapie mit der gleichzeitigen Gabe verglichen. Behandelt wurden 108 Patient:innen, von denen sich etwa 54% im prämenopausalen Stadium befanden. Bei einem Drittel der Studienteilnehmerinnen war die TIL-Rate ≥30% und nahezu die Hälfte zeigte eine PD-L1-Expression ≥1%. Bei zwei Dritteln der Patient:innen lag ein Tumorstadium II vor. Eine pCR erreichten insgesamt 53% der Patient:innen, unabhängig vom zeitlich versetzten oder gemeinsamen Therapiestart. 49% der Betroffenen im Stadium I und 55% im Stadium II sprachen mit einer pCR auf die Therapie an. Mit einer PD-L1-Expression ≥1% wurde eine pCR bei 71%, mit einer Expression <1% bei 33% der Patient:innen beobachtet. Bei hohem TIL-Anteil betrug die pCR-Rate 67%, bei niedriger TIL 46%. Es wurden keine neuen Sicherheitssignale gesehen, die Therapie wurde insgesamt gut vertragen. Mit einer pCR-Rate >50% stützen die Ergebnisse eine neoadjuvante Therapie mit Nivolumab über die Dauer von 12 Wochen plus Chemotherapie für die Behandlung von tripelnegativem Brustkrebs im Stadium I/II, so das Fazit der Autor:innen.
Nutzen der Immuntherapie fürSubgruppen
Die neoadjuvante Therapie mit Pembrolizumab plus Chemotherapie gefolgt von adjuvantem Pembrolizumab plus endokriner Therapie bei HR+/HER2– Brustkrebs mit Hochrisiko wurde in der randomisierten, placebokontrollierten Phase-III-Studie KEYNOTE-756 geprüft.3 Es konnte gezeigt werden, dass die zusätzliche Gabe von Pembrolizumab die pCR-Rate unabhängig von der PD-L1-Expression signifikant erhöhen konnte. Beim SABCS wurden nun die pCR-Raten mit Bezug auf ausgewählte Subgruppen präsentiert. Im Ergebnis profitierten alle Subgruppen von Pembrolizumab. Die pCR-Rate war mit 57,6% versus 33,3% am höchsten bei Patient:innen mit positivem PD-L1-Status (CPS ≥1) und niedriger Östrogenrezeptorexpression (<10%). Mit einer PD-L1-Expression CPS ≥1 und einer Östrogenrezeptorexpression ≥10% lag die pCR-Rate bei 27,6% versus 18,4%. Patient:innen mit niedriger PD-L1-Expression (CPS <1) profitierten nur in 4,6% stärker von der zusätzlichen Pembrolizumab-Gabe (7,2% vs. 2,7%). Insgesamt zeigte sich mit steigender PD-L1-Expression ein höherer Nutzen der Pembrolizumab-Gabe. Patient:innen mit positivem Lymphknotenstatus profitierten stärker von Pembrolizumab (25,2% vs. 15,8%) als Patient:innen ohne Lymphknotenbefall (16,9% vs. 13,1%). Wurde die Chemotherapie wie geplant gegeben (10–12 Dosen Paclitaxel, 4 Dosen Doxorubicin/Cyclophosphamid oder Epirubicin/Cyclophosphamid), erreichten 26,2% der Patient:innen im Pembrolizumab-Arm versus 16,9% im Placebo-Arm eine pCR, bei unvollständiger Chemotherapie waren es 13,2% versus 6,4%. Mehr Patient:innen im Pembrolizumab-Arm wiesen nach der Operation eine RCB 0–1 auf (35,0% vs. 23,6%). Es wurden keine neuen Sicherheitssignale beobachtet.
Adjuvante Immuntherapie ohneZusatznutzen
Kein Nutzen wurde für die zusätzliche Gabe von Atezolizumab zu einer adjuvanten Chemotherapie (12 Wochen Paclitaxel + 4 Dosen Doxorubicin/Cyclophosphamid oder Epirubicin/Cyclophosphamid) bei tripelnegativem Brustkrebs beobachtet.4 Die Ergebnisse der Phase-III-Studie ALEXANDRA/IMpassion030 bestätigen insbesondere, dass der adjuvante Einsatz einer Immuntherapie mit Checkpointinhibitoren wahrscheinlich nicht den richtigen Zeitpunkt innerhalb der Therapiesequenz trifft. In die Studie wurden 2199 Patient:innen mit tripelnegativem Brustkrebs im Stadium II–III eingeschlossen, von denen mehr als die Hälfte positive Lymphknoten aufwiesen. Bei nahezu der Hälfte der Patient:innen (48%) war eine brusterhaltende Operation durchgeführt worden, 52% der Patient:innen wurde einer Mastektomie unterzogen. 29% der Patient:innen hatten einen negativen PD-L1-Status. Es traten bei 11,5% versus 10,2% der Patient:innen Ereignisse bezüglich des primären Endpunkts (Freiheit von invasiver Krankheit; iDFS) auf (HR: 1,12; 95% CI: 0,87–1,45; p=0,37). Innerhalb der PD-L1-positiven Population wurde bei 9,8% versus 9,3% der Patient:innen ein iDFS-Ereignis beobachtet (HR: 1,03; 95% CI: 0,75–1,42). Das Gesamtüberleben (OS) war mit Ereignissen bei 5,5% versus 4,5% der Patient:innen im Atezolizumab- versus Placebo-Arm vergleichbar (HR: 1,20; 95% CI: 0,82–1,75). Die Ergebnisse zur Sicherheit entsprachen den bekannten Daten und es wurde keine Beeinträchtigung der Chemotherapiegabe durch Atezolizumab beobachtet.
Adjuvante Therapie mit CDK4/6-Inhibitor
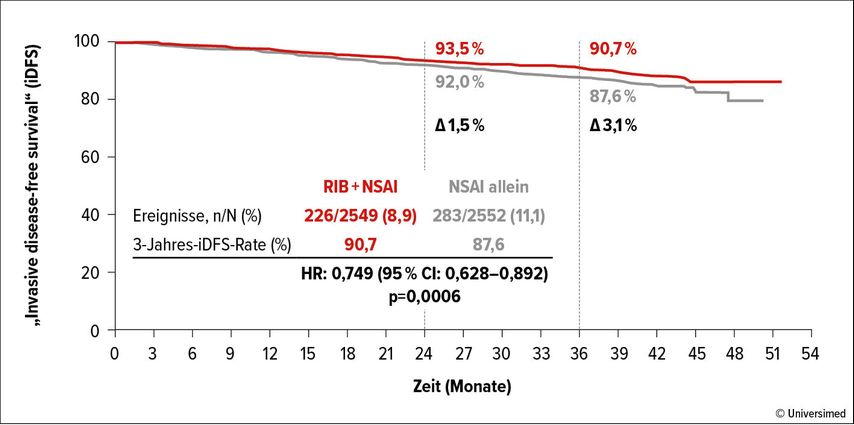
Die Erstlinientherapie mit einem CDK4/6-Inhibitor plus Aromataseinhibitor (AI) ist ein Therapiestandard für die HR+/HER2– Erkrankung. In der Phase-III-Studie NATALEE wurde die Kombination von Ribociclib plus Letrozol oder Anastrozol für die adjuvante Therapie untersucht.5 Eingeschlossen wurden Patient:innen mit frühem Brustkrebs im Stadium IIA, IIB oder III. Eine vorangegangene endokrine Therapie von bis zu 12 Monaten war, ebenso wie eine (neo)adjuvante Chemotherapie, erlaubt. Der primäre Endpunkt war das iDFS laut STEEP-Kriterien. Es wurden 5101 Patient:innen in die Studie eingeschlossen, von denen 2549 randomisiert 3 Jahre Ribociclib plus ≥5 Jahre AI erhielten und 2552 Patient:innen für ≥5 Jahre mit AI behandelt wurden. Zum Zeitpunkt der Auswertung mit einer medianen Nachbeobachtungszeit von 33,3 Monaten wurden 75,1% versus 68,5% der Patient:innen weiterhin mit AI behandelt. Ribociclib setzten 78,3% der Patient:innen ab, 42,8% aufgrund der Vollendung der 3 Therapiejahre und 19,5% aufgrund von Nebenwirkungen. Die NATALEE-Studie bestätigte in der finalen iDFS-Analyse mit einer 3-Jahres-Rate von 90,7% versus 87,6% einen signifikanten Unterschied mit Vorteil für die Ribociclib-Gabe (HR: 0,749; 95% CI: 0,625–0,892; p=0,0006; Abb. 2). Ein vergleichbarer Nutzen der Ribociclib-Gabe wurde für alle relevanten Subgruppen gesehen. Die OS-Daten konnten mit einer medianen Nachbeobachtungszeit von 35,9 Monaten und <4% Ereignissen in beiden Studienarmen bisher keinen Unterschied zwischen den Studienmedikationen nachweisen (HR: 0,892; 95% CI: 0,661–1,203). Das Sicherheitsprofil entsprach dem früherer Auswertungen, mit hepatischen Nebenwirkungen als häufigstem Grund für den Abbruch der Therapie mit Ribociclib.
Abb. 2: Finale Auswertung der Freiheit von invasiver Erkrankung (iDFS) im NATALEE-Trial. Modifiziert nach Hortobagyi G et al. 20235
Angepasste adjuvante Radiatio
Auch die adjuvante regionale Lymphknotenbestrahlung ist mit einem klinischen Nutzen bei Patient:innen mit positiven axillären Lymphknoten assoziiert. Um den Effekt der Radiatio auf das Rezidivrisiko bei Patient:innen mit Lymphknoten-positiver vor sowie Lymphknoten-negativer Erkrankung (ypN0) nach einer neoadjuvanten Therapie zu untersuchen, wurde die Phase-III-Studie NRG Oncology/NSABP B-51/RTOG 1304 initiiert und Ergebnisse mit einer medianen Nachbeobachtungszeit von 59,5 Monaten wurden beim SABCS präsentiert.6 Eingeschlossen waren 1641 Patient:innen mit Brustkrebs im Stadium T1–3 N1 M0, die über ≥8 Wochen eine neoadjuvante Chemotherapie erhalten hatten sowie im Fall einer HER2+ Erkrankung eine HER2-gerichtete Therapie. In der randomisierten Studie erhielten Patient:innen stratifiziert nach Art der Operation (Mastektomie oder Lumpektomie), Hormonrezeptorstatus, HER2-Status, adjuvanter Chemotherapie und pCR-Status entweder die regionale Lymphknotenbestrahlung oder nicht. Bei brustkonservierender Resektion wurde in beiden Studienarmen die Brust, bei Mastektomie nur im Studienarm mit Lymphknotenbestrahlung die Brustwand bestrahlt. Primärer Endpunkt war die Zeit von der Randomisierung bis zum invasiven lokalen, regionalen oder fernen Krankheitsrückfall oder krankheitsbedingten Tod (IBCRFI). Sekundäre Endpunkte waren der lokoregionale Rückfall ohne Fernmetastasierung innerhalb von 2 Monaten (LRRFI), das fernmetastasenfreie Intervall (DRFI), DFS, OS und die Sicherheit. Die Patient:innen waren median 52 Jahre alt, hatten in 21% bzw. 23% der Fälle eine tripelnegative Erkrankung und wurden in 58% der Fälle brusterhaltend operiert. 78–79% der Patient:innen wiesen nach der neoadjuvanten Therapie eine pCR auf. Im Ergebnis wurde kein signifikanter Unterschied zwischen den Studienendpunkten bezüglich des primären oder der sekundären Wirksamkeitsendpunkte gesehen. Das Sicherheitsprofil war wie erwartet günstiger im Studienarm ohne Bestrahlung. Bei Patient:innen mit frühem, lymphknotenpositivem Brustkrebs im Stadium ypN0 nach neoadjuvanter Chemotherapie könnte die adjuvante Radiatio der axillären Lymphknoten entsprechend dem Downstaging angepasst werden, resümierten die Autor:innen.
Quelle:
46th Annual San Antonio Breast Cancer Symposium (SABCS), San Antonio, 5.–9. Dezember 2023
Literatur:
1 Loi S et al.: Biomarker results in high-risk estrogen receptor positive, human epidermal growth factor receptor 2 negative primary breast cancer following neoadjuvant chemotherapy ± nivolumab: an exploratory analysis of CheckMate 7FL. SABCS 2023; Abstr. #GS01-01 2 Loi S et al.: Randomized phase II study of neoadjuvant nivolumab (N) 2 week lead-in followed by 12 weeks of concurrent N+carboplatin plus paclitaxel (CbP) vs concurrent N+CbP in triple negative breast cancer. BCT1902/IBCSG 61-20 Neo-N). SABCS 2023; Abstr. #LB01-03 3 Cardoso F et al.: Phase 3 study of neoadjuvant pembrolizumab or placebo plus chemotherapy, followed by adjuvant pembrolizumab or placebo plus endocrine therapy for early-stage high-risk ER+/HER2- breast cancer: KEYNOTE-756. SABCS 2023; Abstr. #GS01-02 4 Ignatiadis M et al.: Adding atezolizumab to adjuvant chemotherapy for stage II and III triple-negative breast cancer is unlikely to improve efficacy: interim analysis of the ALEXANDRA/IMpassion03 phase 3 trial. SABCS 2023; Abstr. #GS01-03 5 Hortobagyi G et al.: Ribociclib + nonsteroidal aromatase inhibitor as adjuvant treatment in patients with HR+/HER2- early breast cancer: final invasive disease-free survival analysis from the NATALEE trial. SABCS 2023; Abstr. #GS03-03 6 Mamounas E et al.: Loco-regional irradiation in patients with biopsy-proven axillary node involvement at presentation who become pathologically node-negative after neoadjuvant chemotherapy: primary outcomes of NRG oncology/NSABP B-51/RTOG 1304. SABCS 2023; Abstr. #GS02-07
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...