
Sjögren: vom Syndrom zur behandelbaren Erkrankung
Bericht:
Mag.pharm. Irene Senn, PhD
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Lange galt das Sjögren-Syndrom als schwer behandelbare Erkrankung mit wenigen Therapieoptionen. Neue Erkenntnisse zur Pathophysiologie, eine bessere Stratifizierung der Patienten und mehrere neue Therapieoptionen in der Pipeline könnten dies in Zukunft ändern, wie aktuelle Daten zeigen.
Neu ist zunächst, dass wir nicht mehr vom Sjögren-Syndrom, sondern von der Sjögren-Erkrankung sprechen“, eröffnete Assoc. Prof. Dr. Martin H. Stradner von der Medizinischen Universität Graz seinen Vortrag im Rahmen der ÖGR-Jahrestagung in Wien. Diese neue Terminologie betont die systemische Natur der Erkrankung und ihre einheitliche Pathogenese. Auch die Unterscheidung zwischen einer primären und sekundären Sjögren-Erkrankung wird zunehmend kritisch hinterfragt. „Wir würden niemals von einem ‚sekundären Lupus‘ sprechen, wenn es eine Überlappung zu einer anderen Erkrankung gibt“, machte Stradner deutlich.
Aktuelle Therapielandschaft und Evidenz
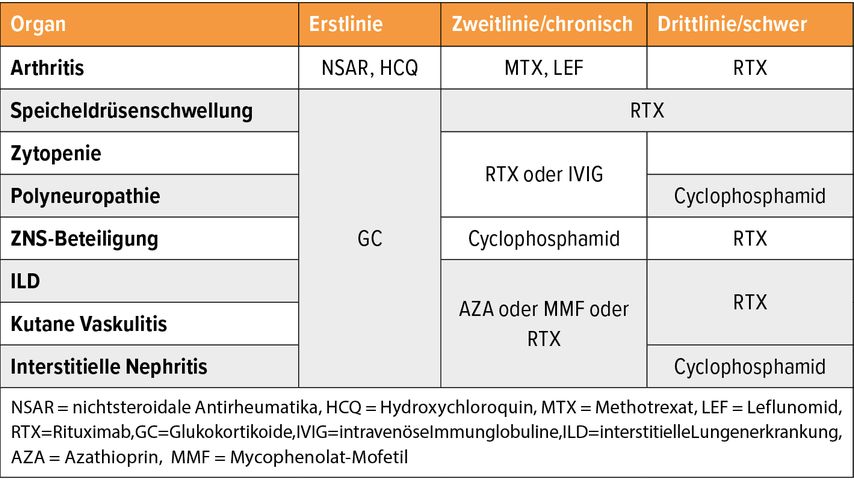
Die derzeitigen Therapieempfehlungen orientieren sich an extraglandulären Manifestationen und basieren überwiegend auf dem Einsatz von Glukokortikoiden und verschiedenen Immunsuppressiva (Tab. 1). „Allerdings ist keines dieser Medikamente für die Sjögren-Erkrankung zugelassen, wir befinden uns hier im Off-Label-Bereich“, betonte Stradner. Es existieren nicht einmal Phase-III-Studien, die die Wirksamkeit dieser Medikamente bei der Sjögren-Erkrankung belegen. Die Empfehlungen stützen sich daher auf eine sehr begrenzte Evidenzbasis.
Tab. 1: Therapie der extraglandulären Manifestationen der Sjögren-Erkrankung (adaptiert nach Ramos-Casals et al.)6
Heterogenität als therapeutische Herausforderung
Die bislang unbefriedigende Therapiesituation hat mehrere Ursachen. Ein wesentlicher Faktor könnte die ausgeprägte Heterogenität der Erkrankung sein. Wissenschaftler aus Newcastle (UK) haben mittels Cluster-Analyse verschiedene Subgruppen der Sjögren-Erkrankung identifiziert, die sich nicht nur in ihrer Symptomatik, sondern auch in ihren molekularen Profilen unterscheiden.1
Die Analyse klassifizierte Patienten anhand ihrer Hauptsymptome (Schmerz, Fatigue, Trockenheit, Angst und Depression) in vier verschiedene Cluster: eine Gruppe mit generell geringer Symptombelastung, eine mit hoher Symptombelastung sowie je eine Gruppe, die von Trockenheit und Fatigue bzw. von Schmerz und Fatigue dominiert wurde. Bemerkenswert dabei war, dass diese klinische Einteilung mit spezifischen biologischen Signaturen korrelierte.2 „Jener Cluster, dessen Symptomatik von Trockenheit und Fatigue dominiert wird, weist die höchste Aktivierung von B-Zellen auf“, erläuterte Stradner. Diese Patientengruppe zeigt erhöhte Spiegel von B-Zell-assoziierten Proteinen wie CXCL13 und weist zudem die höchste Prävalenz von B-Zell-Lymphomen auf. Im Gegensatz dazu fanden sich bei Patienten mit hoher Symptombelastung oder dominierender Schmerz-Fatigue-Symptomatik vorwiegend Hinweise auf einen veränderten Stoffwechsel und mitochondriale Schäden. Diese Stratifizierung könnte zudem auch therapeutische Relevanz besitzen: Eine retrospektive Analyse der TRACTISS-Studie deutete darauf hin, dass insbesondere Patienten aus dem Trockenheit-Fatigue-Cluster von einer B-Zell-gerichteten Therapie mit Rituximab profitieren.1
Zu späte Diagnose?
Ein weiteres bedeutsames Problem stellt der späte Therapiebeginn dar. Eine retrospektive Untersuchung aus der Arbeitsgruppe von Stradner mit 134 Patienten zeigte, dass zwischen den ersten Symptomen und der Diagnosestellung durchschnittlich 11,6 Jahre vergehen.3 Dabei ist zu beachten, dass diese Symptome bereits Ausdruck von Schäden sind, die über Jahre hinweg an den Drüsen stattgefunden haben, bevor die ersten Sicca-Symptome überhaupt auftreten. Viele Patienten werden folglich erst in späten Stadien behandelt, wenn bereits irreversible Schäden eingetreten sind.
Falsche Endpunkte?
Die gegenwärtig für klinische Studien zur Sjögren-Erkrankung verwendeten Endpunkte (ESSDAI, ESSPRI) werden zunehmend kritisch hinterfragt und hier gab es kürzlich interessante Entwicklungen. Mit dem CRESS von Hendrika Bootsma und dem STAR des Necessity-Konsortiums wurden zwei neue zusammengesetzte Endpunkte entwickelt. Diese basieren auf der Analyse früherer Studien und kombinieren verschiedene Parameter wie ESSPRI, ESSDAI, Drüsenfunktionen sowie biologische Marker wie IgG und Komplement.
Eine aktuelle Studie analysierte die TRACTISS-Studiendaten erneut unter Verwendung der STAR-Kriterien.4 Dabei zeigte sich, dass RTX-Responder initial höhere Zytokinwerte (Interferone, TNF) aufwiesen, die nach der Behandlung sanken, während bei Non-Respondern initial niedrige Ausgangswerte vorlagen und keine Veränderungen auftraten. Ein weiterer bemerkenswerter Befund dieser Studie war die Entdeckung geschlechtsspezifischer Unterschiede: Bei Frauen in der Placebogruppe zeigte sich eine progressive Zunahme der T- und B-Zell-Infiltration in den Speicheldrüsen, was den natürlichen Krankheitsverlauf der Sjögren-Erkrankung widerspiegelt. Bei Männern wurde hingegen sogar eine Abnahme beobachtet. Diese Erkenntnisse werfen neue Fragen zur Pathophysiologie der Sjögren-Erkrankung bei Männern auf und unterstreichen die Notwendigkeit weiterer geschlechtsspezifischer Forschung.
Neue Therapieansätze in der Pipeline
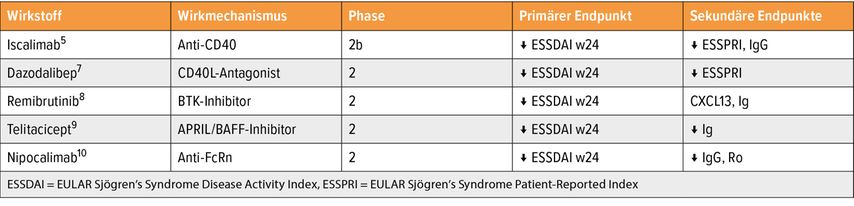
Trotz der genannten Herausforderungen gibt es ermutigende Entwicklungen. Allein 2024 wurden fünf erfolgreiche Phase-II-Studien publiziert (Tab. 2).
Die meisten neuen Substanzen zielen auf B-Zellen oder die B-Zell-T-Zell-Interaktion ab. Besonders vielversprechend erscheint der Anti-CD40-Antikörper Iscalimab.5 In einer Phase-IIb-Studie erreichten Patienten unter Iscalimab nicht nur eine signifikante Reduktion des ESSDAI-Scores, sondern zeigten auch deutliche Verbesserungen bei Fatigue und Trockenheit – Symptome, die in früheren Studien kaum beeinflusst werden konnten. „Diese Ergebnisse sind besonders ermutigend“, resümierte Stradner. „Sie zeigen, dass Trockenheit und Erschöpfung – zwei der Hauptprobleme für die Patienten – tatsächlich reversibel sein könnten.“
Quelle:
Jahrestagung der Österreichischen Gesellschaft für Rheumatologie & Rehabilitation (ÖGR), 28. – 30. November 2024, Wien
Literatur:
1 Tarn JR et al.: Symptom-based stratification of patients with primary Sjögren’s syndrome: multi-dimensional characterisation of international observational cohorts and reanalyses of randomised clinical trials. Lancet Rheumatol 2019; 1(2): e85-94 2 Berry JS et al.: Examining the biological pathways underlying clinical heterogeneity in Sjogren’s syndrome: proteomic and network analysis. Ann Rheum Dis 2024; 83(1): 88-95 3 Lackner A et al.: Patients’ recollection about the onset of Sjögren’s disease - a mixed methods study on the patients’ perspective. Arthritis Res Ther 2024; 26(1): 169 4 Pontarini E et al.: Serum and tissue biomarkers associated with composite of relevant endpoints for Sjögren’s syndrome (CRESS) and Sjögren’s tool for assessing response (STAR) to B cell-targeted therapy in the trial of anti-B cell therapy in patients with primary Sjögren’s syndrome (TRACTISS). Arthritis Rheumatol 2024; 76(5): 763-76 5 Fisher BA et al.: Safety and efficacy of subcutaneous iscalimab (CFZ533) in two distinct populations of patients with Sjögren’s disease (TWINSS): week 24 results of a randomised, double-blind, placebo-controlled, phase 2b dose-ranging study. Lancet 2024; 404(10452): 540-53 6 Ramos-Casals M et al.: EULAR recommendations for the management of Sjögren’s syndrome with topical and systemic therapies. Ann Rheum Dis 2020; 79(1): 3-18 7 St Clair EW et al.: CD40 ligand antagonist dazodalibep in Sjögren’s disease: a randomized, double-blinded, placebo-controlled, phase 2 trial. Nat Med 2024; 30(6): 1583-92 8 Dörner T et al.: Efficacy and safety of remibrutinib, a selective potent oral BTK inhibitor, in Sjögren’s syndrome: results from a randomised, double-blind, placebo-controlled phase 2 trial. Ann Rheum Dis 2024; 83(3): 360-71 9 Xu D et al.: Efficacy and safety of telitacicept in primary Sjögren’s syndrome: a randomized, double-blind, placebo-controlled, phase 2 trial. Rheumatology (Oxford) 2024; 63(3): 698-705 10 Gottenberg J et al.: Efficacy and safety of nipocalimab, an anti-FcRn monoclonal antibody, in primary Sjögren’s disease: results from a phase 2, multicentre, randomized, placebo-controlled, double-blind study (DAHLIAS). ACR Convergence 2024; Abstract Nr. 2527; verfügbar unter https://acrabstracts.org/abstract/efficacy-and-safety-of-nipocalimab-an-anti-fcrn-monoclonal-antibody-in-primary-sjogrens-disease-results-from-a-phase-2-multicenter-randomized-placebo-controlled-double-blind-study-dah/ (zuletzt aufgerufen am 13.3.2025)
Das könnte Sie auch interessieren:
Krebsscreening bei Myositis
Idiopathische inflammatorische Myopathien (IIM) sind mit einem erhöhten Krebsrisiko assoziiert, insbesondere in den ersten Jahren nach der Diagnose. Eine neue Leitlinie der International ...
Arthrose – Mythen und Fakten
Die Arthrose ist mit einer Lebenszeitprävalenz von über 50% die häufigste chronische Gelenkerkrankung weltweit. Die Krankheit ist eindeutig mit höherem Alter und BMI assoziiert, ...
Von der Pankreasläsion zur systemischen Histiozytose
Die Erdheim-Chester-Erkrankung (ECD) ist eine seltene Form der Nicht-Langerhans-Zell-Histiozytose, die durch eine pathologische Infiltration von Zellen des mononukleären ...

.jpg)