
Rheumatische Nebenwirkungen bei Checkpoint-Inhibitor-Therapie
Bericht:
Mag. Irene Senn, PhD
Geprüft von:
PD Dr. Jan Leipe,
Sektionsleiter Rheumatologie und Klinische Immunologie, Universitätsklinikum Mannheim
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Immun-Checkpoint-Inhibitoren aktivieren gezielt eine Immunreaktion gegen Tumorzellen, sie können aber auch ein breites Spektrum an autoimmunen Nebenwirkungen verursachen. Bei ca. 5–20% der Patient:innen werden rheumatische immunvermittelte Nebenwirkungen beobachtet. Diese ähneln den klassischen rheumatologischen Entitäten, zeigen jedoch oft ein atypisches Bild. Für Rheumatolog:innen wird es zunehmend wichtig, um die Besonderheiten dieser klinischen Erscheinungsformen und deren Management Bescheid zu wissen.
Immun-Checkpoint-Inhibitoren (ICI) haben die Prognose von zahlreichen malignen Erkrankungen wie malignen Melanomen, nicht kleinzelligen Lungenkarzinomen und Nierenzellkarzinomen maßgeblich verbessert, wie PD Dr. Jan Leipe, Sektionsleiter Rheumatologie und klinische Immunologie am Universitätsklinikum Mannheim, bei seiner Präsentation im Rahmen der Montags-Seminarreihe von „Rheuma Schweiz“ betonte. Die Zahl der Substanzen und der Indikationen nimmt stetig zu, und mittlerweile werden auch in fortgeschrittenen und therapierefraktären Tumorstadien hohe Remissionsraten erreicht. Der zunehmende Einsatz von ICI bringt aber auch neue Herausforderungen mit sich.
Autoimmune Nebenwirkungen von Checkpoint-Inhibitoren
Mit der steigenden Anwendung der neuen onkologischen Immuntherapien werden auch die zugehörigen Nebenwirkungen häufiger, wobei sich das Nebenwirkungsprofil der Immuntherapien deutlich von jenem klassischer Chemotherapien unterscheidet. Sehr häufig kommt es unter ICI-Therapien zu überschießenden Immunreaktionen gegen gesundes Gewebe im Sinne von autoimmunen Reaktionen.
Das gesamte Spektrum an immunvermittelten Nebenwirkungen wird unter der Bezeichnung „immune-related adverse events“ (irAEs) zusammengefasst. Sie können entweder unter ICI-Therapie erstmals auftreten (anti-CTLA-4 bei 70–90% der Patient:innen, anti-PD1 bzw. anti-PDL1 bei 70% der Patienten) bzw. kann es bei einer vorbestehenden chronisch entzündlichen Erkrankung zu einem Schub bzw. zu einer Erhöhung der Krankheitsaktivität kommen. Die Daten aus dem MalheuR-Projekt (Register für Patient:innen mit malignen und entzündlich-rheumatischen Erkrankungen) zeigen, dass die de novo auftretenden irAEs den größten Anteil ausmachen, während Schübe bei vorbestehenden rheumatischen Erkrankungen vergleichsweise selten sind.1 „Möglicherweise gibt es hier aber einen gewissen Bias, da bei Patienten mit Autoimmunerkrankungen bzw. rheumatischen Erkrankungen immer noch eine gewisse Zurückhaltung besteht, eine Immuntherapie überhaupt zu beginnen“, gab Leipe zu bedenken.
irAEs können alle Organsysteme betreffen, häufig die Haut, endokrine Drüsen und den Gastrointestinaltrakt. Zudem sind mittlerweile eine ganze Reihe von rheumatologischen Erscheinungsbildern beschrieben. Meist treten irAEs innerhalb der ersten 6 bis 8 Wochen nach Therapiebeginn auf, mitunter aber auch erst nach einigen Monaten. Zum Teil wurden sogar Spätmanifestationen nach Absetzen der Immuntherapie beobachtet.
Klinische Erscheinungsbilder und Diagnostik rheumatischer irAEs
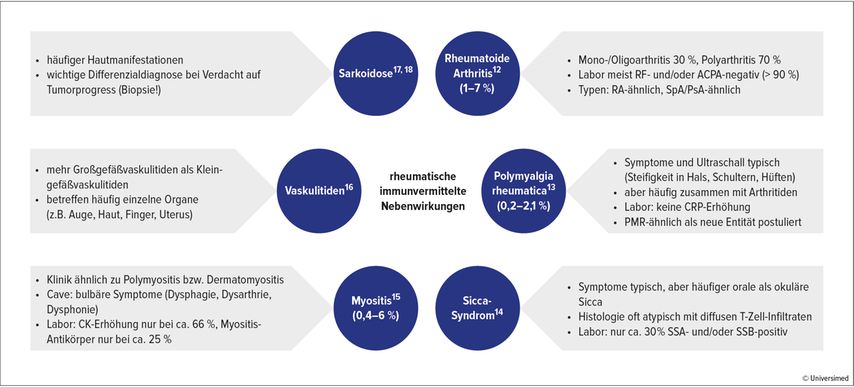
Rheumatische irAEs sind relativ häufig und betreffen etwa 5–20% der Patient:innen. Sie können das gesamte Spektrum an Erkrankungen des rheumatischen Formenkreises nachahmen (Abb. 1). „Es gibt zwar gewisse Ähnlichkeiten zu den bekannten klassischen rheumatologischen und muskuloskelettalen Erkrankungen, oft zeigt sich aber ein inkomplettes oder atypisches Bild. In unserem Register erfüllen tatsächlich nur 16% der Patienten die Klassifikationskriterien für die klassischen Entitäten“, berichtete Leipe. Auffällig ist beispielsweise, dass diese Patient:innen meist keine erhöhten Entzündungsmarker und keine Autoantikörper aufweisen. Man spricht daher häufig von RA-ähnlich, PsA-ähnlich etc. – teilweise wurden die Symptomenkomplexe bereits als eigenständige klinische Entitäten definiert.
Abb. 1: Häufige rheumatische irAEs und wichtige Unterschiede zu den phänotypisch ähnlichen „klassischen“ entzündlich-rheumatischen Erkrankungen
Im Wesentlichen wird bei muskuloskelettalen Symptomen unter ICI-Therapie das gleiche diagnostische Vorgehen wie bei den klassischen entzündlich-rheumatischen Entitäten empfohlen, also der Nachweis der Entzündung mittels Histologie, Klinik, Labortests sowie Bildgebung und/oder Biopsie.3 Zu bedenken ist allerdings die häufig atypische Präsentation dieser rheumatischen irAEs. Zudem müssen auch die onkologischen Befunde berücksichtigt werden, da diese einen Hinweis auf Metastasen bzw. Paraneoplasien als potenzielle Differenzialdiagnosen geben können.
Auslösung von Schüben beivorbestehenden Autoimmunerkrankungen
„Bei einer vorbestehenden entzündlich-rheumatischen Erkrankung sehen wir häufig eine Aktivitätszunahme, etwa die Hälfte der Patienten entwickelt unter der Immuntherapie einen Schub. Bei Arthritiden sind es etwa 50%, bei den Kollagenosen und Vaskulitiden hingegen nur rund 30%“, präsentierte Leipe die aktuellen Zahlen. Möglicherweise sei dieser Unterschied aber auch nur der Tatsache geschuldet, dass die Zunahme der Krankheitsaktivität bei Arthritiden auffälliger ist.4
Checkpoint-Inhibitoren
Immuncheckpoints wie PD-1 oder CTLA-4 sind Oberflächenmoleküle auf T-Zellen und agieren als wichtige Kontrollpunkte im Immunsystem. Unter physiologischen Bedingungen verhindert die Bindung eines Liganden an diese Checkpoints eine überschießende Immunreaktion.
Tumorzellen bemächtigen sich jedoch „missbräuchlich“ ebenfalls dieses Mechanismus und entziehen sich so den Angriffen des Immunsystems.
Die therapeutisch eingesetzten Checkpoint-Inhibitoren heben die tumorzellinduzierte Inhibierung der T-Lymphozyten auf: Die malignen Zellen werden als entartet erkannt und eliminiert. Etablierte Checkpoint-Inhibitoren richten sich u. a. gegen CTLA-4, PD-1 und PD-L1.2
Die Flares sind in der Regel mit Glukokortikoid(GC)-Stoßtherapie gut beherrschbar. „Trotzdem wird bei etwa der Hälfte der Patienten die ICI-Therapie in der Folge unterbrochen“, berichtete Leipe aus der Praxis. „Und das ist natürlich problematisch.“ Leipe betonte, dass eine vorbestehende Autoimmunerkrankung keine Kontraindikation für eine ICI-Therapie darstellt. Günstig sei es aber, die GC-Therapie vor Beginn der Tumortherapie unter 10mg Prednisolonäquivalent zu bringen.
Management von rheumatischen irAEs
Das Management von rheumatischen irAEs erfordert eine enge interdisziplinäre Zusammenarbeit von Rheumatolog:innen und Onkolog:innen. Die wichtigste Aufgabe des Rheumatologen in diesem Setting sei es, die Symptome auf ein akzeptables Niveau zu reduzieren und damit die Fortführung der ICI-Therapie zu ermöglichen, sagt Leipe. Denn die ICI-Therapie ist für die Betroffenen oft die einzige verbliebene Therapieoption. Ein Therapieabbruch hat daher in vielen Fällen weitreichende Konsequenzen. „Vorrangige Ziele sind die Schmerzreduktion und die Wiederherstellung der Funktionalität im Alltag – und nicht die komplette Remission. Dieses defensive therapeutische Vorgehen ist ein wichtiger Unterschied zur gewohnten offensiven Treat-to-Target-Strategie“, betonte Leipe.
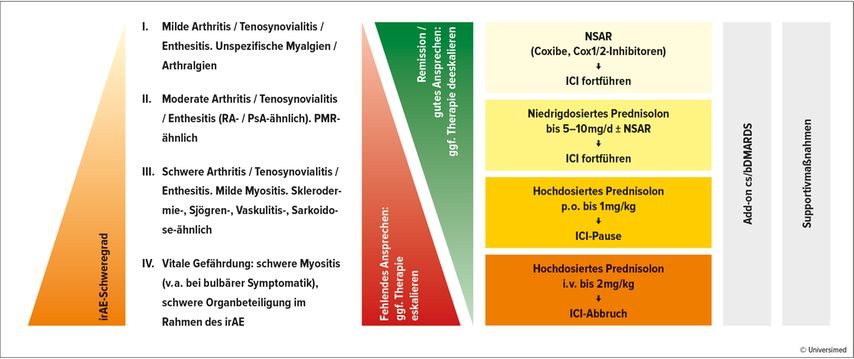
Die Therapie orientiert sich am Schweregrad der rheumatischen Nebenwirkung (Abb. 2). Bei leichten bis moderaten irAEs reichen oftmals nichtsteroidale Antirheumatika (NSAR) oder niedrigdosierte GC aus. Bei schweren Reaktionen wird kurzfristig auch mit hochdosierten Steroiden therapiert. „Bei der Gabe von Glukokortikoiden ist immer das Tapering wichtig: Innerhalb von 6 bis 8 Wochen sollte die Dosis zumindest unter 10mg Prednisolonäquivalent reduziert und nach Möglichkeit ausgeschlichen werden“, erläuterte Leipe die aktuellen Empfehlungen.20
Abb. 2: Schweregrad-adaptiertes Stufenschema zur Therapie von rheumatischen irAEs (nach Benesova et al. 2020)5
Müssen GC gespart werden oder lassen sich die Symptome damit nicht ausreichend kontrollieren, so können konventionelle synthetische „disease modifying antirheumatic drugs“ (csDMARDs) eingesetzt werden. Die meisten Erfahrungen bestehen mit Methotrexat (MTX), aber auch für Sulfasalazin und Hydroxychloroquin gibt es einige Wirksamkeitsbelege. Bei hoher Krankheitslast und Nichtansprechen auf csDMARDs ist eine Therapie mit biologischen DMARDs (bDMARDs) in Erwägung zu ziehen – bei Arthritiden bevorzugt mit TNF- oder IL-6R-Inhibitoren.5
Wann muss die Tumortherapie unterbrochen werden?
Mit Ausnahme einiger schwerwiegender Manifestationen sind irAEs in der Regel gut kontrollierbar. Ein Abbruch der ICI-Therapie ist nur in seltenen Fällen erforderlich. Leipe: „Obligat ist ein sofortiger Behandlungsstopp unter den rheumatologischen irAEs vor allem bei einer schweren Myositis. Insbesondere bulbäre Symptome, wie Schluck-, Sprech- oder Atemstörungen, sind mit einer hohen Letalität verbunden und absolute Red Flags. Hier muss die ICI-Therapie sofort abgesetzt und eine aggressive immunsuppressive Therapie eingeleitet werden.“
Beeinflussung der Anti-Tumor-Antwort durch Rheumatherapie
Die immunsupprimierende Wirkung der rheumatologischen Therapie ist dem T-Zell-aktivierenden Wirkungsmechanismus der ICI-Therapie entgegengesetzt. Dementsprechend gibt es Befürchtungen, dass sich die Behandlung mit immunmodulatorischen Substanzen nachteilig auf das Tumoransprechen auswirken könne.
Die bisher vorhandenen Daten können diese Bedenken zumindest teilweise entkräften. So ergab eine retrospektive Analyse von 298 Melanompatient:innen unter Therapie mit dem ICI Ipilimumab, dass weder eine systemische Therapie mit GC noch mit TNF-Inhibitoren das Gesamtüberleben bzw. die Zeit bis zum Therapieversagen beeinflusste.6 Andererseits zeigte eine Post-hoc-Analyse aus randomisierten kontrollierten und Kohortenstudien, dass hohe GC-Dosen bei Patient:innen mit Bronchialkarzinom mit einem schlechteren Therapieansprechen assoziiert waren. Eine kritische Grenze liegt offenbar bei 10mg Prednisolonäquivalent. Oberhalb dieser Dosis fand man ein schlechteres Überleben.7 In einer anderen retrospektiven Studie erwies sich eine frühe GC-Gabe – also innerhalb von 2Monaten nach Beginn der ICI-Therapie – als ungünstig und führte zu einem geringeren Überleben.8
Für TNF-Inhibitoren sind die bisher verfügbaren Ergebnisse widersprüchlich. Retrospektive Analysen ließen kein Signal bezüglich Tumorprogress erkennen und lassen vermuten, dass eine kurzfristige Anwendung unproblematisch ist.9,10 Im Gegensatz dazu stehen die Daten aus dem holländischen Melanom-Register. Hier beobachtete man ein reduziertes Überleben bei Patient:innen mit schweren irAEs, wenn sie mit TNF-Inhibitoren bzw. mit TNF-Inhibitoren plus GC behandelt wurden.11 Rezent publizierte Daten bestätigten diese Vermutung: Eine retrospektive Analyse von 147 Melanompatient:innen untersuchte die Effekte von TNF-Inhibitoren, IL-6-Rezeptor-Antagonisten und MTX. Die Arthritis ließ sich mit bDMARDs im Vergleich zu MTX deutlich effizienter kontrollieren, war aber unter TNF-Inhibitoren mit einer signifikant kürzeren Zeit bis zum Tumorprogress verbunden.12 Für MTX gibt es bislang keine Hinweise auf eine Interferenz mit dem Tumoransprechen.
Eine abschließende Bewertung zur Interferenz von rheumatologischen Therapien mit der onkologischen Immuntherapie ist damit zum derzeitigen Zeitpunkt nicht möglich.
Quelle:
PD Dr. Jan Leipe: „Rheumatische Erkrankungen und Checkpoint-Inhibitor-Therapie“, Webinar, Rheuma Schweiz, 22. Mai 2023
Literatur:
1 Benesova K et al.: DGHO Jahrestagung, Berlin 2019; V320 2 Colombo MP et al.: Nat Rev Cancer 2007; 7(11): 880-7 3 Kostine M et al.: Ann Rheum Dis 2021; 80(1): 36-48 4 Klavdianou K et al.: Mediterr J Rheumatol 2021; 32(3): 218-26 5 Benesova K et al.: Z Rheumatol 2020; 79(6): 545-53 6 Horvat TZ et al.: J Clin Oncol 2015; 33(28): 3193-8 7 Arbour KC et al.: J Clin Oncol 2018; 36(28): 2872-8 8 Maslov DV et al.: J Immunother Cancer 2021; 9(7): e002261 9 Lesage C et al.: J Immunother 2019; 42(5): 175-9 10 Wang Y et al.: J Immunother Cancer 2018; 6(1): 37 11 Verheijden RJ et al.: Clin Cancer Res 2020; 26(9): 2268-74 12 Bass AR et al.: Ann Rheum Dis 2023; 82(7): 920-6 13Angelopoulou F et al.: Rheumatol Int 2021; 41(1): 33-42 14 Gauci ML et al.: Semin Arthritis Rheum 2017; 47(2): 281-7 15 Warner BM et al.: Oncologist 2019; 24(9): 1259-69 16 Kostine M et al.: Rheumatology (Oxford) 2019; 58(Suppl 7): vii68-74 17 Comont T et al.: J Immunother Cancer 2018; 6(1): 120 18 Zhang M et al.: Clin Nucl Med 2017; 42(9): 728-9 19 Lomax AJ et al.: Int J Rheum Dis 2017; 20(9): 1277-85 20 Schneider BJ et al.: Clin Oncol 2018; 36(17): 1714-68
Das könnte Sie auch interessieren:
Krebsscreening bei Myositis
Idiopathische inflammatorische Myopathien (IIM) sind mit einem erhöhten Krebsrisiko assoziiert, insbesondere in den ersten Jahren nach der Diagnose. Eine neue Leitlinie der International ...
Arthrose – Mythen und Fakten
Die Arthrose ist mit einer Lebenszeitprävalenz von über 50% die häufigste chronische Gelenkerkrankung weltweit. Die Krankheit ist eindeutig mit höherem Alter und BMI assoziiert, ...
Von der Pankreasläsion zur systemischen Histiozytose
Die Erdheim-Chester-Erkrankung (ECD) ist eine seltene Form der Nicht-Langerhans-Zell-Histiozytose, die durch eine pathologische Infiltration von Zellen des mononukleären ...

.jpg)