Behandlungspfad bei azetabulären Defekten in der Revisionsendoprothetik
Autoren:
Dr. Sebastian Simon1, 2
Priv.-Doz. Dr. Jochen Hofstätter1, 2
1 Michael-Ogon-Labor für orthopädische Forschung, Orthopädisches Spital Speising, Wien
2 II. Orthopädische Abteilung, Orthopädisches Spital Speising, Wien
Korrespondenz:
E-Mail: researchlab@oss.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Revisionseingriffe aufgrund azetabulärer Knochendefekte nach Hüfttotalendoprothesen stellen eine große Herausforderung dar. Einestrukturierte Diagnostik und Einteilung sowie ein Behandlungsalgorithmus können helfen, die präoperative Planung zu optimieren und dadurch ein besseres operatives Ergebnis zu erzielen.
Keypoints
-
Ein strukturierter Behandlungsalgorithmus verbessert die Planung und Umsetzung komplexer Pfannenrekonstruktionen.
-
Die Paprosky-Klassifikation ist eine pragmatische Klassifikation zur Einteilung des Knochenverlusts, sie leitet die Therapieentscheidung.
-
Hemisphärische Pfannen und modulare Augmente bieten breite Möglichkeiten zur Stabilisierung bei segmentalen und kavitären Defekten.
-
Cup-Cage- bzw. Cup-Augment-Cage-Konstrukte oder „Customized“-Implantate ermöglichen auch bei sehr ausgeprägten Defekten eine biomechanisch stabile Versorgung.
Trotz des Erfolgs der primären Hüfttotalendoprothetik (HTEP) kann eine Revision erforderlich sein, um verschiedene Versagensmechanismen, wie aseptische Lockerung, Infektionen und Instabilität, zu behandeln.1
Leider spiegeln die Ergebnisse der Revisionen oft nicht die Erfolge der primären HTEP wider. Komplikationen treten häufiger auf und die Revisionsraten sind deutlich höher. Ein häufiges Problem bei Revisionen ist der Knochenverlust um das Acetabulum, wobei Patient:innen mit größerem Knochenverlust schlechtere Ergebnisse erzielen (vor allem im Hinblick auf Osteolyse und Infektionen).2 Ein solcher Knochenverlust bedeutet eine schlechtere knöcherne Überdachung der Pfanne, was zu einem schlechteren Einwachsen der Pfanne und damit zu einer höheren Rate an Pfannenlockerungen führt.
Knochenverlust kann auch die Primärstabilität einer HTEP beeinträchtigen. Bei der primären HTEP wird die Ringspannung eines intakten Pfannenrandes genutzt, um einem Pressfit-Implantat Stabilität zu verleihen (der Pressfit ist die primäre Quelle der Implantatstabilität bis zum Einwachsen nach etwa 6 Wochen). Standard-Titanpfannendesigns erfordern eine Mikrobewegung <50μm und etwa 50% Kontakt zwischen Implantat und vitalem Knochen für ein erfolgreiches Einwachsen.3
Defekte können als „segmental“ oder „kavitär“ beschrieben werden. „Segmental“ bezieht sich auf Defekte des Hüftpfannenrandes, die die Stabilität beeinträchtigen, da nur ein intakter Rand den Ringspannungen standhalten kann, die eine Presspassung der Pfanne stabilisieren. „Kavitär“ bezieht sich auf einen volumetrischen Knochenverlust, bei dem der Rand intakt bleibt. Beides verringert jedoch die Abdeckung des Implantats.4 Für die Diagnostik und Bewertung knöcherner Defekte gibt es verschiedene apparative Möglichkeiten:
-
AP-Beckenröntgen: Röntgenaufnahmen werden verwendet, um die Art und den Ort des Knochenverlustes zu bestimmen. Dazu wird auf eine Lyse am Ischium und an der „Teardrop“ geachtet und festgestellt, ob das Hüftzentrum nach oben, medial oder lateral gewandert ist.
-
Judet-Aufnahmen: „Obturator oblique view“ zeigt den vorderen Pfeiler und die hintere Aceta-bulumwand (OAK: „Obturator oblique shows anterior column“); „iliac oblique view“ zeigt die hintere Säule und die vordere Acetabulumwand.
-
CT-Aufnahme des Beckens: weitere Charakterisierung des Knochenverlusts
Interpretation der Röntgenaufnahmen
Superiore Migration des Hüftzentrums
Sie deutet auf einen Knochenverlust am oberen Pfannenrand hin. Bei einer superioren Migration unterscheidet man eine superiore und mediale (was auf einen stärkeren Knochenverlust des vorderen Pfeilers als des hinteren Pfeilers hinweist) oder eine superioreund laterale Migration (was auf einen stärkeren Verlust des hinteren Pfeilers als des vorderen Pfeilers hinweist).
Mediale Migration (Protrusio) des Hüftzentrums
Das ist ein Defekt in der Vorderwand, der auf dem Röntgenbild als Durchschneiden der ilioischialen Linie (Kohler-Linie) erkennbar ist.
Lyse
Die Osteolyse des Ischiums weist auf eine Beteiligung des hinteren Pfeilers/der Hinterwand des Acetabulums hin. Die Osteolyse der „Teardrop“ deutet auf einen inferioren Knochenverlust hin. Ein Bruch der Linea ilioischiadica deutet auf einen Knochenverlust am vorderen Pfeiler hin.
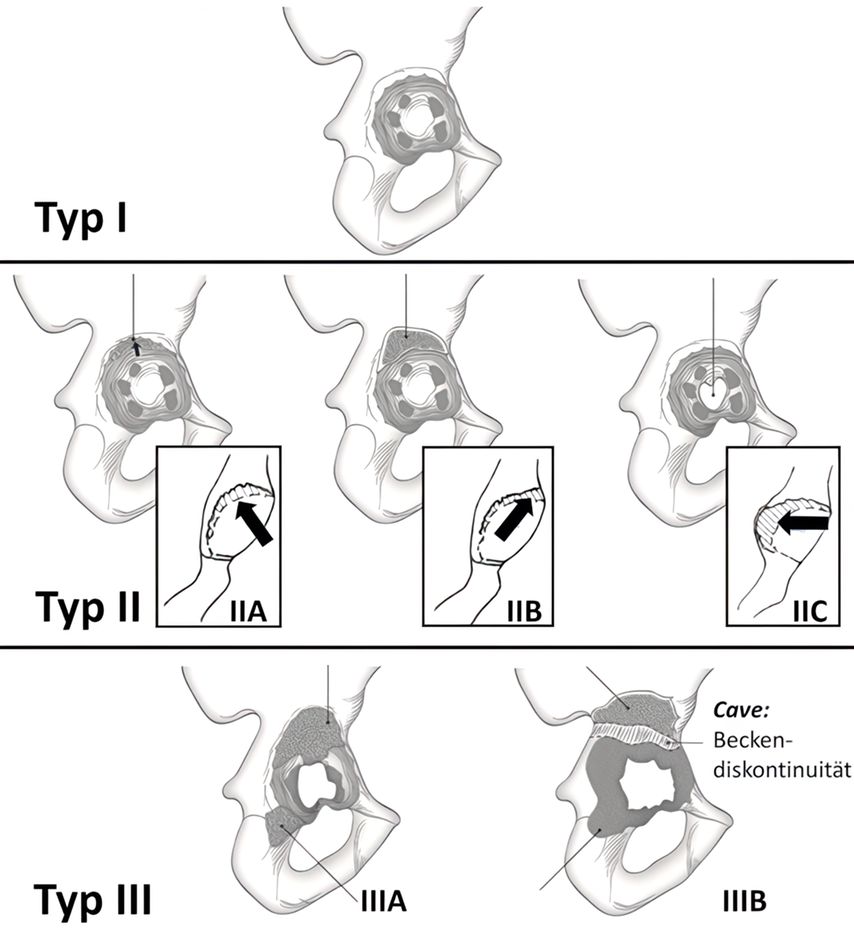
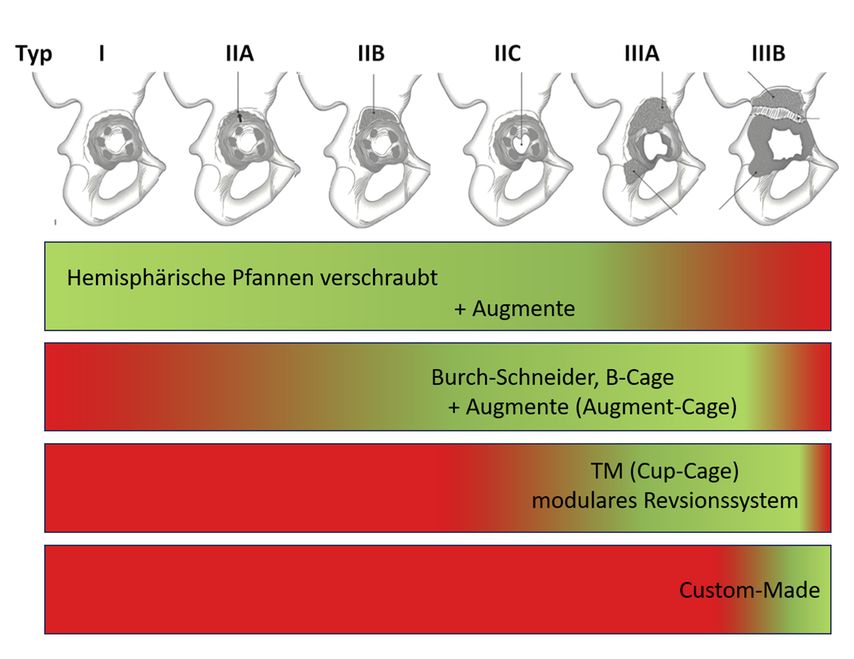
Zur Einteilung und weiteren Charakterisierung dieser knöchernen Beckendefekte wird vor allem die Paprosky-Klassifikation verwendet, die Defekte vom Typ I bis III beschreibt, was wiederum die Behandlung bestimmt5 (Abb. 1, 2).
-
Typ-I-Defekte: intakter Pfannenrand, der ausreichende Stabilität bietet
-
Typ-II-Defekte A–C: Der Pfannenrand ist stabil, aber nur teilweise unterstützend, d.h., er kann einen gewissen segmentalen Defekt aufweisen, ohne die Gesamtstabilität zu beeinträchtigen. Entscheidend ist, dass die Migration <3cm ist.
-
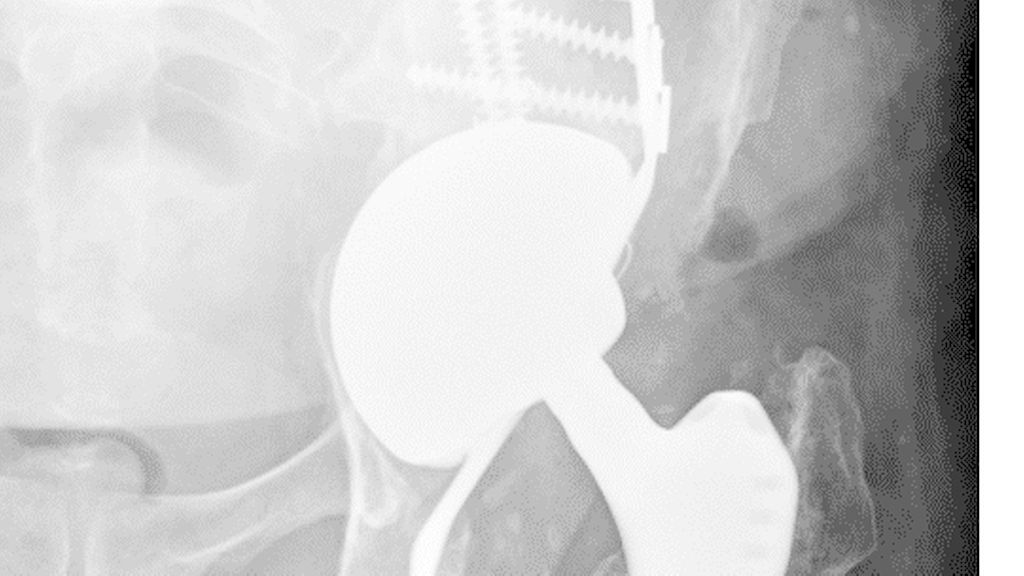
Typ-III-Defekte: schwerwiegender Knochenverlust ohne unterstützenden Pfannenrand mit einer Migration >3cm. Bei Typ-IIIA-Defekten (hinterer Pfeiler/Acetabulumwand): Acetabulum ist „nach oben und außen“ verschoben (Abb. 3). Bei Typ-IIIB-Defekten (vorderer Pfeiler/Acetabulumwand) ist das Acetabulum „nach oben und innen“ verschoben, häufig verbunden mit einer Becken-Diskontinuität. Hier öffnet sich die Pfanne weiter, ohne eine stabile Fixierung zu erreichen (Abb. 4, 5).
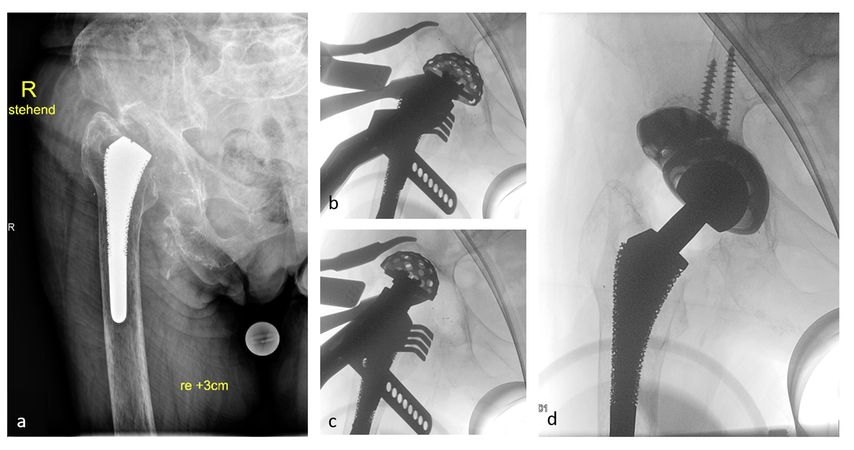
Abb. 3: 87-jährige Patientin mit IIIA-Defekt, negative Infektzeichen, a.p. Röntgen (a), „Reamen“ und Messen der Defektzone zentral (b) und superior (c), Endergebnis (d)
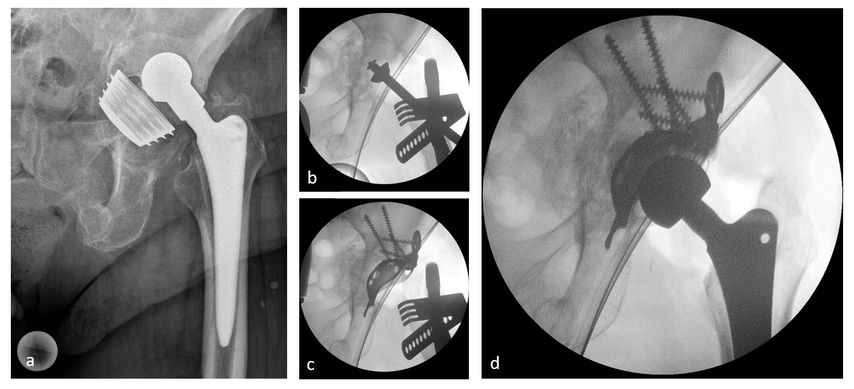
Abb. 4: 79-jährige Patientin mit IIIB-Defekt, negative Infektzeichen, a.p. Röntgen (a), Entfernen der lockeren Schraubpfanne, „Reamen“ gefolgt von einem „impaction bone grafting“ (b), Implantation einer Stützschale (c), Endergebnis (d)
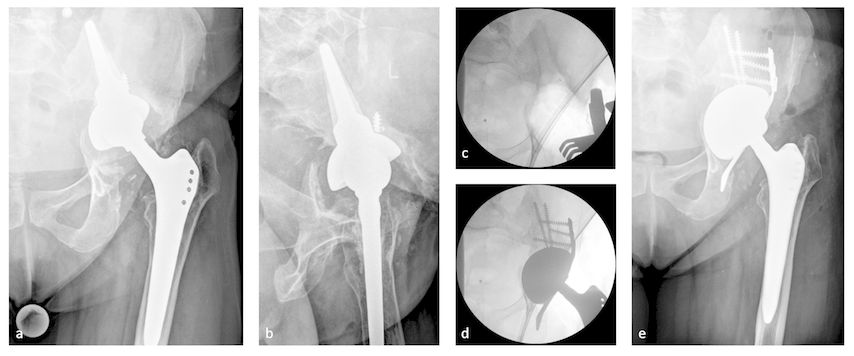
Abb. 5: 57-jährige Patientin mit Beckendiskontinuität und gelockerter Sockelpfanne, negative Infektzeichen, a.p. Röntgen (a),axiales Röntgen (b), Entfernen der Sockelpfanne und Implantation eines „trabecular metal acetabular revision system“ (TMARS), Cup-Cage + „distraction technique“ (c+d), Endergebnis (e)
Therapie
Während verschiedene chirurgische Techniken zur Behandlung von schwerem azetabulärem Knochenverlust beschrieben wurden, wurden diese meist isoliert und nicht standardisiert betrachtet. Ein Algorithmus könnte einen schrittweisen Lösungsweg bieten und komplexe Verfahren vereinfachen.6 Die geplante OP sollte neben Parametern wie Knochendefekten, Knochenqualität, Heilungspotenzial und Instabilität auch das Alter des Patienten, den Gesundheitszustand, die tolerierbare OP-Dauer und die Dringlichkeit berücksichtigen.
Neben dem Knochenverlust stellt die Instabilität eine große Herausforderung bei der Revisions-HTEP dar, die teilweise durch die Wahl der Implantate bewältigt werden kann. Weiters besteht eine direkte Korrelation zwischen Lockerung/Implantatversagen und Defekten am hinteren Pfeiler bzw. höheren Paprosky-Typen (>60% Typ IIIB).7,8
Revisionspfannen
Augmente/poröse Metalle
Neue poröse Metalle, wie z.B. trabekuläres Metall, wurden für die Revisionsversorgung entwickelt, bei der die anfängliche Stabilität und das Einwachsen des Knochens eine Herausforderung darstellen. Diese Technologie erhöht die Reibung zwischen dem Implantat und dem Knochen, wodurch die anfängliche Stabilität trotz des geringeren Knochenkontakts erhöht wird, und begünstigt ein umfangreiches und schnelles Einwachsen des Knochens.9
Augmentationen an einer Pfanne sind erforderlich, wenn der Pfannenrand nicht intakt ist. Diese stehen in mehreren Konfigurationen zur Verfügung, z.B. die „flying buttress“ für eine bessere Platzierung oder ein „Dome“-Augmentat für Randdefekte und auch das „Footing“-Augmentat für mediale Defekte.10–12
Hemisphärische Pfannen
Wenn die volle Stabilität der Pfanne erreicht werden kann, ist eine hemisphärische Pfanne mit einer eventuellen Verschraubung ausreichend, weiters können bei größeren Defekten Augmente intraoperativ angepasst werden.6
Bei Typ-IIIA-Defekten kann ein intrakavitäres Augment eingesetzt werden, gefolgt von einer hemisphärischen Pfanne. Wichtig ist, dass das Augment und die Pfanne mit Zement verbunden sind, der Zement soll das Implantat-Knochen-Interface so wenig wie möglich beeinträchtigen. Das Augment stellt die Form des Acetabulums wieder her (Typ-IIIA-Defekt zu Typ-II-Defekt) und bietet strukturelle Unterstützung für die Pfanne.
Bei Typ-IIIB-Defekten und einem stabilen vorderen Pfeiler können ebenfalls hemisphärische Pfannen mit Augmenten verwendet werden. Dabei wird der mediale Defekt mit einem Augment überbrückt (IIIB→IIIA) und so die Köhler-Linie rekonstruiert, die den vorderen und hinteren Pfeiler verbindet. Ein zweites Augment füllt den superioren Knochenverlust auf und stellt den Pfannenrand wieder her (IIIA→II).
Bei Grad-IIIB-Defekten und einem instabilen vorderen Pfeiler kann ein Augment keine ausreichende Stabilität bringen, um die Pfanne von unten zu stützen. Hier sollten andere Verfahren wie das Cup-Cage-Verfahren verwendet werden.
Triflange-Pfanne
Diese kann verwendet werden, wenn der Rand nicht intakt ist. In einigen Fällen von Beckendiskontinuität kann eine maßgefertigte Triflange-Pfanne verwendet werden, die anhand von CT-Aufnahmen des Beckens modelliert wird.
Das Implantat enthält Verriegelungsschrauben am Ischium (inferior) und am Ilium (superior) zur anfänglichen Fixierung, und seine individuelle Form ermöglicht einen ausreichenden Knochenkontakt für eine langfristige stabile Fixierung.
Jumbo-Pfanne
Bei großen kavitären Defekten (eingeschlossene Läsionen mit <50% Knochenkontakt) wird eine Jumbo-Pfanne verwendet (Außendurchmesser: Männer >66mm; Frauen >62mm). Die Jumbo-Pfanne ist mit hochporösem Metall (d.h. Tantal oder trabekuläres Metall) beschichtet und bietet eine bessere Fixierung durch verbesserte Biokompatibilität für das Einwachsen. Dieses hochporöse Metall hat außerdem einen hohen Reibungskoeffizienten und eine hohe Elastizität, was zu einer besseren Anfangsfixierung führt.13,14
Sockelpfannen
Die Indikation der Sockelpfanne liegt bei der Diskontinuität, wenn eine Verankerung nur mehr im Ilium möglich ist. Die Sockelpfanne zeigt eine hohe Komplikations- und Revisionsrate. Die Indikation besteht heutzutage hauptsächlich in der Tumorendoprothetik nach Hemipelvektomien.
Antiprotrusio-Cage
Cages wurden in der Vergangenheit als das „Arbeitspferd“ für Beckendiskontinuität und zur Behandlung großer eingeschlossener Läsionen verwendet. Der Cage überspannt einen großen Knochendefekt, und die Stabilität wird durch die proximale Verschraubung mit dem Ilium (superior) und den Eingriff am Ischium (inferior) erreicht. Anschließend wird ein Poly-Liner in den Cage zementiert. Da Cages nie eine biologische Fixierung erreichen, besteht das Risiko eines Ermüdungsversagens,15 wobei die Versagensrate nach 5 Jahren bei etwa 20–30% liegt. Der Cage versagt meistens durch Abduktionsauszug.
Cup-Cage
Das Konzept bietet eine Möglichkeit, die Vorteile von Jumbo-Pfannen und Cages zu kombinieren.16 Bei der Cup-Cage-Technik wird eine Pfanne in den Defekt eingesetzt und mit mehreren Löchern durch die Pfanne im Acetabulum fixiert. Anschließend wird ein Cage (wie oben beschrieben) auf die Pfanne aufgesetzt und mit Schrauben im Ilium und einem geschlitzten Flansch im Ischium fixiert. Der Cage stabilisiert die Hüftpfanne zusätzlich, um Mikrobewegungen zu minimieren und das Einwachsen zu fördern. Anschließend wird ein Poly-Liner in den Cage zementiert.17 Der Vorteil dieser Technik besteht darin, dass sie eine hervorragende Sofortfixierung (über den Cage) und gleichzeitig eine langfristige biologische Fixierung (über die Jumbo-Pfanne) ermöglicht. Für die Cup-Cage-Technik werden gute Ergebnisse berichtet.18 Sie kann auch bei Defekten des Typs IIIA und IIIB (mit und ohne Beckendiskontinuität) eingesetzt werden.19
Customized-Implantate
Die Notwendigkeit muss frühzeitig erkannt werden, da die Produktionsdauer miteinberechnet werden muss. Unter Berücksichtigung der bereits besprochenen Techniken ist die Verwendung eines „Customized“-Implantats sinnvoll (<5% in Typ-III-Defekten):6,20–22
-
bei Mega-Defekten – ein Begriff, der massiven Knochenverlust beschreibt, bei dem der a.p. Durchmesser des verbleibenden Acetabulums 80mm überschreitet (da es hier keine Pfannengrößen von der Stange gibt),
-
bei komplexer Beckendiskontinuität – insbesondere bei supraazetabulären Diskontinuitäten, bei denen das Niveau der Diskontinuität über dem Niveau der nativen Hüftpfanne liegt,
-
bei großem Knochenverlust in einem kleinen Becken, in dem ein Cup-Cage nicht möglich ist, was eine Mindestgröße der Hüftpfanne von 56/58mm erfordert, um die Rekonstruktion technisch durchführen zu können.
Ein strukturierter Algorithmus ist wichtig bei der Planung komplexer Pfannenrekonstruktionen, um solche Fälle vorhersehbarer und reproduzierbarer zu versorgen. Der Artikel zeigt die Möglichkeiten von handelsüblichen Implantaten und deren Limitationen.
Literatur:
1 Learmonth ID et al.: Lancet 2007; 370(9597): 1508-19 2 Jain S et al.: HIP Int 2014; 24(2): 109-22 3 Pilliar RM et al.: Clin Orthop Relat Res 1986; (208): 108-13 4 D’Antonio JA et al.: Clin Orthop Relat Res 1989; (243): 126-37 5 Paprosky WG et al.: J Arthroplasty 1994; 9(1): 33-44 6 Jones SA et al.: Bone Joint J 2024; 106-B(5 Supple B): 47-53 7 Perka C, Ludwig R: J Arthroplasty 2001; 16(5): 568-74 8 Paprosky WG et al.: J Arthroplasty 2007; 22(4): 111-5 9 Deirmengian GK et al.: J Bone Jt Surg 2011; 93(19): 1842-52 10 Ciriviri J et al.: PRIL 2019; 40(2): 33-9 11 Nehme A et al.: Clin Orthop Relat Res 2004; 429: 201-8 12 Sporer SM: J Bone Jt Surg 2011; 93(14): 1359-64 13 Welldon KJ et al.: J Biomed Mater Res Part A 2008; 84A(3): 691-701 14 Bobyn JD et al.: J Bone Jt Surg 1999; 81(5): 907-14 15 Sembrano JN, Cheng EY: Clin Orthop Relat Res 2008; 466(7): 1657-65 16 Hanssen AD, Lewallen DG: Orthopedics 2005; 28(9): 971-2 17 Sculco PK et al.: J Bone Joint Surg 2017; 99(13): 1104-10 18 Kosashvili Y et al.: J Bone Joint Surg Br 2009; 91-B(7): 870-6 19 Paprosky WG et al.: Clin Orthop Relat Res 2005; 441(NA;): 216-20 20 Winther SS et al.: Bone Jt Open 2022; 3(11): 867-76 21 Tack P et al.: Orthop Traumatol Surg Res 2021; 107(1): 102600 22 Scharff-Baauw M et al.: Acta Orthop 2021; 92(3): 297-303
Das könnte Sie auch interessieren:
Orthopädisches Management des erworbenen Fallfußes
Als komplexes Problem erfordert das Management des Fallfußes einen interdisziplinären Zugang mit individuellen Therapieansätzen, abhängig von der Ursache, Schwere, Lokalisation, von ...
Behandlungspfade bei Fersenbeinfraktur
Die Vielzahl unterschiedlicher Frakturtypen am Fersenbein erfordert spezifische Therapieansätze. Am Unfallkrankenhaus Linz wurde daher auf Grundlage umfangreicher Frakturanalysen eine ...
Behandlung von periprothetischen Gelenkinfektionen einer Hüft- oder Knie-Totalendoprothese
Der Wechsel der mobilen Teile, im Englischen als DAIR (Debridement, Antimicrobial Therapy, and Implant Retention) bezeichnet, stellt eine etablierte Option zur Behandlung ...