ARDS nach Femurschaftfraktur
Autorinnen:
Iris Haider-Maurer, MSc
Ao. Univ.-Prof. Dr. Judith Löffler-Ragg
OA Dr. Alex Pizzini
OÄ Dr. Anna Luger
Universitätsklinik für Innere Medizin IIMedizinische Universität Innsbruck
E-Mail: judith.loeffler@i-med.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das Fettemboliesyndrom (FES) ist eine tückische Erscheinung, die meist durch Knochenfrakturen ausgelöst wird und in schweren Fällen bis zum akuten Lungenversagen führen kann. Eine fundierte Diagnose ist daher von besonderer Bedeutung, wie auch der vorgestellte Patientenfall verdeutlicht.
Gelangen Fetttröpfchen aus unterschiedlichen Ursachen in den Lungenkreislauf, spricht man von der sogenannten Fettembolie (Abb. 1). Wenn es dadurch zu klinischen Manifestationen kommt, handelt es sich um ein Fettemboliesyndrom (FES), das durch die Trias respiratorische Symptome, zerebrale Dysfunktion und hämatologische Auffälligkeiten gekennzeichnet ist. Pulmologische Beschwerden, welche bei einem fulminanten Verlauf zu einer akuten respiratorischen Insuffizienz und einem ARDS („acute respiratory distress syndrome“) führen können, nehmen dabei die dominierende Rolle ein.1, 2 Die Diagnose des FES kann jedoch tückisch sein, denn das Krankheitsbild lässt sich von einem ARDS anderer Genese radiologisch nicht unterscheiden. Erst die passende Patientengeschichte in Kombination mit klinischen Auffälligkeiten sowie das Fehlen eines kardial bedingten Lungenödems sind wegweisend für ein FES.3
Epidemiologie und Risikofaktoren
Die Ursache für ein FES ist vorwiegend eine Fraktur eines langen Röhrenknochens (v.a. Femurschaftfraktur) oder ein orthopädischer Eingriff.2,4 In den meisten Fällen verläuft eine Fettembolie klinisch stumm,5,6 doch gewisse Faktoren scheinen das Risiko für ein FES zu erhöhen. Insgesamt wird die Inzidenz für ein FES nach einem traumatischen Ereignis mit 1–2% beziffert.7 Das Risiko erhöht sich je nach Schweregrad des Traumas, bei einer bilateralen Fraktur beispielsweise liegt die Inzidenz bereits bei 4–8%. Die Versorgung der Femurschaftfraktur mit einem Marknagel scheint allerdings die größte Gefahr für die Entwicklung eines (postoperativen) FES zu sein (bis zu 11%).8 Meistens sind Personen im Alter von 10 bis 40 Jahren betroffen, Männer dabei häufiger als Frauen.2,9 Die Prädisposition des Patienten bzw. der pulmonale Status des Patientensowie die Zeitdauer bis zur Versorgung scheinen ebenfalls eine Rolle hinsichtlich der Entwicklung eines FES zu spielen.10
Pathophysiologie
Grundsätzlich ist die Pathogenese des FES nicht geklärt. Es gibt allerdings zwei Theorien, die diskutiert werden.
Zunächst die mechanische Theorie, welche besagt, dass während eines traumatischen Ereignisses Fett aus dem Knochenmark durch verletzte Venolen in die Blutbahn gelangt.1 Vor allem durch das Einbringen eines Marknagels entsteht ein sehr hoher Druck im Markraum, wodurch Lipide an die Kortikalis gepresst werden.11 Über Gefäße, welche den Knochen versorgen, können kleine Fetttröpfchen in den venösen Kreislauf und in weiterer Folge zum rechten Vorhof sowie in die Lungenkapillaren gelangen.7,12 Sind die Fettemboli so klein, dass sie die Lungenkapillaren passieren, können die Lipidtröpfchen Anschluss an das arterielle System finden und zu zerebralen Schäden führen. Durch ein persistierendes Foramen ovale kann es ebenfalls zu einer arteriellen Fettembolie kommen.13
Neben der mechanischen Theorie gibt es einen biochemischen Prozess, der pathogenetisch für das FES sein soll. Bei der Metabolisierung des zirkulierenden Fetts entstehen toxische Zwischenprodukte, die eine inflammatorische Kaskade in Gang setzen.1 Vor allem freie Fettsäuren, die beim Abbau des Neutralfetts entstehen, schädigen die Lunge.4,14 Es kommt zu Endothelschädigung, einem Ödem und Hämorrhagie, laborchemisch kommt es zum Anstieg des C-reaktiven Proteins (CRP) und Zytokinen, wie beispielsweise Interleukin6.15 Die Tatsache, dass eine FES meistens 24 bis 72 Stunden nach einem initialen Ereignis in Erscheinung tritt, untermauert vor allem die biochemische Theorie. Sie ist ferner eine Erklärung für äußerst seltene, nichttraumatisch bedingte Fettembolien (z.B. im Rahmen einer Pankreatitis).16
Klinik und Diagnose
Klinisch stehen vor allem respiratorische Symptome, wie Hypoxämie, Dyspnoe und Tachypnoe, im Vordergrund. Es kann sich ein ARDS entwickeln, welches in schweren Fällen mechanische Ventilation benötigt.2 Durch die Verlegung der Lungenkapillaren kann es zu pulmonaler Hypertension kommen. Ein Rechtsherzversagen sowie ein kardiogener Schock könnten daraus resultieren.17
Neben respiratorischen Symptomen sind hämatologische Befunde wie petechiale Blutungen, Anämie und Thrombozytopenie kennzeichnend für ein FES. Die sogenannte Purtscher-Retinopathie, bei der es zu Fetteinlagerungen („cotton-wool-sign“) in der Retina kommt, sollte ophtalmoskopisch abgeklärt werden. Im Weiteren kann es zu Lipidurie und Fieber kommen.2,18
Bildgebend zeigt sich in vielen Fällen ein normaler Befund. Im Thorax-Röntgen können diffuse oder fleckige Konsolidierungen zu sehen sein. Genauer beurteilbar sind die pulmonalen Veränderungen jedoch in der Computertomografie (CT). Hier sind das häufigste beschriebene Muster bilaterale scharf begrenzte Milchglasverdichtungen, teils auch im „Crazy paving“-Muster, sowie fleckige Konsolidierungen. Seltener werden zentrilobuläre Noduli, welche hinweisend für ein FES sind, erwähnt.7
Therapie
Prinzipiell ist keine spezifische Therapie für das FES vorhanden. Die Gabe von Cortison und die Antikoagulation mit Heparin werden beschrieben, liefern aber wenig überzeugende Daten. Therapeutisch stehen daher supportive Maßnahmen, wie Flüssigkeitssubstitution, die Gabe von Sauerstoff oder die Zuhilfenahme der mechanischen Ventilation im Vordergrund.3,12
Fallpräsentation
Ein 28-jähriger Mann, welcher aufgrund eines schweren Traumas eine Femurschaftfraktur erlitten hatte und operativ mit einem Marknagel versorgt worden war, zeigte ca. 24 Stunden nach dem Ereignis Zeichen einer Pulmonalembolie. Der Mann entwickelte eine akute respiratorische Insuffizienz mit einer SaO2 unter 80 % sowie retrosternalen Thoraxschmerzen und Dyspnoe. Der PaO2 lag unter Raumluft bei 45 mmHg (Horowitz-Quotient 214 mmHg), der PCO2 bei 34 mmHg. In weiterer Folge wurde mit einer CPAP-Maskenbeatmung (PEEP 10 mbar) begonnen. Zusätzlich stieg die Körpertemperatur auf 39 °C, laborchemisch wurden eine Leukozytose sowie ein CRP-Anstieg ersichtlich. In der Thorax-CT-Untersuchung konnte keine Pulmonalarterienembolie nachgewiesen werden, jedoch zeigten sich kleinfleckige Milchglasverdichtungen und Konsolidierungen vorwiegend in den dorsalen Lungenabschnitten. Die augenärztliche Untersuchung lieferte einen unauffälligen Befund. Eine Infektion durch SARS-CoV-2 wurde durch mehrmalige PCR-Tests sowie einen Antikörper-Assay ebenfalls ausgeschlossen. Der Patient wurde auf die Intensivstation aufgenommen und die Atemtherapie konnte forciert werden. Begleitend wurde eine Antibiose mit Piperacillin gestartet, schmerztherapeutisch wurde Vendal, zur Fiebersenkung Paracetamol verabreicht. In der Verlaufs-Thorax-CT-Untersuchung war die pulmonale Beteiligung deutlich progredient mit ausgedehnten bilateralen Milchglasverdichtungen und Konsolidierungen zu sehen. In Zusammenschau mit der Klinik war dieser Befund passend für ein ARDS (Abb. 2).
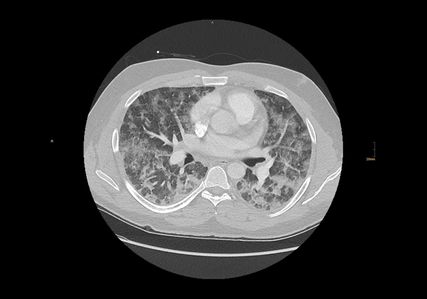
Abb. 2: Die axiale Thorax-Computertomografie wurde im Verlauf angefertigt. Es zeigen sich diffuse bilaterale Milchglasverdichtungen und in den abhängigen Lungenanteilen Konsolidierungen
Klinisch zeigte der Patient vereinzelt Hämoptysen. Die antibiotische Therapie wurde durch die Gabe von Zithromax erweitert. Unter laufender CPAP-Therapie war der Mann kreislaufstabil. Eine weitere Virusserologie (HSV, CMV, EBV, Influenza, Pneumokokken) lieferte einen negativen Befund. Im Labor wurden ein Hb von 8,3 mg/dl sowie ein Absinken der Thrombozyten auf 129 000/µl auffällig.
Fünf Tage nach dem traumatischen Ereignis kam es zu einer erstmaligen Besserung seines klinischen Zustandes, zusätzlich steigerte sich die Oxygenierung. Am folgenden Tag zeigten sich die Entzündungsparameter rückläufig, ebenso waren die Verschattungen im Thoraxröntgen regredient. Eine Woche nach der Versorgung der Fraktur mit einem Marknagel konnte der Mann schließlich auf die unfallchirurgische Abteilung überstellt werden. Am Ende des stationären Aufenthalts wurde eine Lungenfunktionsüberprüfung durchgeführt, bei der eine mittelgradige Diffusionsstörung (DLCO 55 %) ersichtlich wurde, die FEV1 lag knapp unter 80 %. Nach weiteren drei Wochen wurde der Mann an der pneumologischen Ambulanz vorstellig. Dabei konnten normale Lungenvolumina und eine physiologische Diffusionsleistung ermittelt werden. Klinisch wurden keine weiteren Beschwerden beschrieben.
Literatur:
1 Husebye EE et al.: Bone marrow fat in the circulation: clinical entities and pathophysiological mechanisms. Injury 2006; 37(Suppl 4): 8-182 Kirk A et al.: Fat embolism syndrome: experience from an Australian trauma centre. Int J Orthop Trauma Nurs 2020; 36: 100746 3 Ong SCL, Balasingam V: Characteristic imaging findings in pulmonary fat embolism syndrome (FES). BMJ Case Rep 2017; 2017: bcr-2017-223007 4 Adeyinka A, Pierre L: Fat Embolism. Treasure Island (FL): StatPearls Publishing LCC 2020 5 Takahashi S et al.: Intraoperative pulmonary embolism during spinal instrumentation surgery. A prospective study using transoesophageal echocardiography. J Bone Joint Surg Br 2003; 85(1): 90-4 6 Lafont ND et al.: Clinical features and echocardiography of embolism during cemented hip arthroplasty. Can J Anaesth 1997; 44(2): 112-7 7 Newbigin K et al.: Fat embolism syndrome: State-of-the-art review focused on pulmonary imaging findings. Respir Med 2016; 113: 93-100 8 Kontakis GM et al.: Fat embolism: special situations bilateral femoral fractures and pathologic femoral fractures. Injury 2006; 37(Suppl 4): 19-24 9 Stein PD et al.: Fat embolism syndrome. Am J Med Sci 2008; 336(6): 472-7 10 Dunn RH et al.: Fat emboli syndrome and the orthopaedic trauma surgeon: lessons learned and clinical recommendations. Int Orthop 2017; 41(9): 1729-34 11 Wenda K et al.: Pathogenesis and clinical relevance of bone marrow embolism in medullary nailing--demonstrated by intraoperative echocardiography. Injury 1993; 24(Suppl 3): 73-81 12 Mellor A, Soni N: Fat embolism. Anaesthesia 2001; 56(2): 145-54 13 Godoy DA et al.: Cerebral fat embolism: recognition, complications, and prognosis. Neurocrit Care 2018; 29(3): 358-65 14 Kao SJ et al.: Clinical and pathological features of fat embolism with acute respiratory distress syndrome. Clin Sci (Lond) 2007; 113(6): 279-85 15 Yoga R at al: Interleukin-6 as an early marker for fat embolism. J Orthop Surg Res 2009; 4: 18 16 Hulman G: Pathogenesis of non-traumatic fat embolism. Lancet 1988; 1(8599): 1366-7 17 Kosova E et al.: Fat embolism syndrome. Circulation 2015; 131(3): 317-20 18 Gurd AR, Wilson RI: The fat embolism syndrome. J Bone Joint Surg Br 1974; 56b(3): 408-16
Das könnte Sie auch interessieren:
Die Mykobakterien-Challenge – welches TBC-Medikament wirkt wo warum?
Abgesehen von der langen Therapiedauer sieht man sich in der Behandlung der Tuberkulose mit drei großen Herausforderungen konfrontiert: den für dieses Bakterium typischen Eigenschaften, ...
Best of DGP: Kongress-Highlights für die Praxis
Dr. Sabine Lampert, niedergelassene Pneumologin in Erlangen, fasste die Erkenntnisse vom DGP-Kongress 2025 für die tägliche Praxis zusammen. Sie konzentrierte sich bei ihrem „Best of DGP ...