Periphere Nervenstimulation beim komplexen regionalen Schmerzsyndrom
Autoren:
Dr. Isabelle Sawetz
Univ.-Doz. Dr. Werner Girsch
Abteilung für Plastische, Ästhetische und Rekonstruktive Chirurgie
Klinik für Chirurgie
Medizinische Universität Graz
E-Mail: isabelle.sawetz@medunigraz.at
„Schmerzpatienten“ stellen als Patientenkollektiv im klinischen Alltag eine große Herausforderung dar. Viele von ihnen leiden an einem komplexen regionalen Schmerzsyndrom (CRPS). Doch was versteht man darunter und wie kann man es behandeln? – Ein Einblick in die Methode der peripheren Nervenstimulation (PNS).
Keypoints
-
Typischerweise geht dem CRPS ein auslösendes Ereignis voraus, oftmals sind das Frakturen oder Operationen.
-
Meist sind die Extremitäten betroffen, die obere etwa doppelt so häufig wie die untere.
-
Ein multimodaler Therapieansatz ist essenziell für eine erfolgreiche Behandlung.
-
Die PNS bietet eine sinnvolle Behandlungsoption bei CRPS im Spätstadium und bei herkömmlichem Therapieversagen.
Was ist das CRPS?
Das komplexe regionale Schmerzsyndrom (CRPS) ist definitionsgemäß ein chronisches Schmerzsyndrom, bestehend aus einem bunten Symptomkomplex, das in den meisten Fällen nach einem auslösenden Ereignis distal an einer Extremität entsteht. Es zeichnet sich vor allem dadurch aus, dass der Schmerz sowohl in Intensität als auch Dauer verhältnismäßig jeglichen herkömmlichen Verlauf nach ähnlichem Trauma übersteigt.1,2
Der chronische Schmerz ist laut der International Association for the Study of Pain (IASP) definiert als „Schmerz, der über die normale Dauer der Gewebeheilung hinaus persistiert“, welche, bei einer Abwesenheit von anderen Faktoren, „normalerweise mit einer Dauer von 3 Monaten angenommen wird“.3 Beim CRPS wird der Schmerz primär als Erkrankung angesehen, wohingegen er sich bei sekundären Schmerzsyndromen als Symptom einer anderen zugrunde liegenden Erkrankung manifestiert.4
Die Geschichte des CRPS geht bis zum amerikanischen Bürgerkrieg zurück, als in einer Arbeit von Mitchell et al. 1864 erstmals brennende Schmerzen, Hyperästhesien und trophische Hautveränderungen infolge von Schussverletzungen an den Extremitäten als „Kausalgie“ (vom griechischen „kausos“ [Hitze] und „algos“ [Schmerz]) beschrieben wurden.5 Seitdem wurden dem Symptomkomplex die verschiedensten Namen auferlegt, unter anderem neurovaskuläre Reflexdystrophie, Algoneurodystrophie, sympathische Reflexdystrophie oder Kausalgie.1,6
Aktuell wird das CRPS in zwei verschiedene Subgruppen unterteilt, CRPS I und CRPS II. Ersteres, ehemals auch als Morbus Sudeck oder sympathische Reflexdystrophie bezeichnet, entsteht ohne ersichtlichen zugrunde liegenden Nervenschaden.
Das CRPS II hingegen, früher auch als Kausalgie bekannt, zeichnet sich dadurch aus, dass ihm immer eine Läsion peripherer Nerven vorausgeht.6
Ursachen und Verteilungsmuster
Typischerweise geht dem CRPS ein auslösendes Ereignis, meist ein Trauma, voraus.2 Am häufigsten handelt es sich dabei um Frakturen, aber Operationen und andere Verletzungen können ebenfalls eine Rolle spielen.7 In populationsbasierten Studien zeigten sich über 40% der untersuchten CRPS-Fälle als Folge einer Fraktur.8,9 Frauen scheinen 3,4-mal häufiger betroffen zu sein als Männer, mit einem Altersgipfel bei 61–70 Jahren. Ebenfalls zeigt sich, dass die obere Extremität etwa doppelt so oft betroffen ist wie die untere.8
Zwei prospektive Studien aus den Jahren 2012 und 2014 mit großen Kollektiven an Frakturpatienten (n=596; n=1549) untersuchten die Inzidenz eines CRPS in jener Risikogruppe.10,11 Es zeigte sich hier eine Inzidenz von 3,8–7,0% innerhalb von 4 Monaten nach der Fraktur.1
Während also in den meisten Fällen ein Trauma das ein CRPS auslösende Ereignis darstellt, spricht man in 3–11% aller Fälle von einem Auftreten eines CRPS ohne kausalen Zusammenhang.12 Ob ein CRPS jedoch wirklich spontan auftreten kann, wird weiterhin kontrovers diskutiert.
Der multimodale Ansatz
Aufgrund der noch weitgehend unerforschten, komplexen Pathophysiologie des CRPS sowie der multiplen Beschwerden und des individuell unterschiedlichen Verlaufes stellt die Therapie des CRPS eine große Herausforderung dar. Ein standardisiertes Konzept konnte bis dato noch nicht festgelegt werden. Therapeutische Maßnahmen bestehen aus medikamentösen, nichtmedikamentösen, physio- bzw. ergotherapeutischen, psychologischen bzw. psychiatrischen und interventionellen Methoden. Die Behandlung sollte je nach klinischem Erscheinungsbild individuell angepasst werden.13 Experten sind sich jedoch einig, dass eine funktionelle Therapie, sprich Physio- und Ergotherapie, im Fokus stehen soll, auch wenn invasive Methoden zur Behandlung verwendet werden. Ziel ist, begleitend eine Normalisierung der funktionell beeinträchtigten Extremität zu erreichen.14
Die periphere Nervenstimulation
Die genaue Wirkungsweise der direkten peripheren Nervenstimulation (PNS) ist bis heute nicht vollständig geklärt. Einen wichtigen Grundstein für die Elektrotherapie legten Melzack und Wall 1965 mit ihrer „gate-control theory“.15 Diese besagt, dass inhibitorische Neurone im Hinterhorn des Rückenmarks als eine Art „Tor“ fungieren und eine Schmerzweiterleitung verhindern können. Bei Aktivierung myelinisierter Aβ-Nervenfasern (z.B. bei nicht schmerzhafter Berührung) wird über eine Aktivierung inhibitorischer Interneurone die Schmerzfortleitung zum Gehirn blockiert. Sprich: Bei „geschlossenem Tor“ wird kein Schmerz empfunden. Eine Weiterführung dieses „Gate-control“-Konzepts ist die Aktivierung deszendierender schmerzhemmender Systeme durch den elektrischen Reizinput. Dadurch kommt es zu vermehrter Ausschüttung von körpereigenen Opioiden (z.B. Endorphinen) und Neurotransmittern (z.B. Serotonin). Eindrücklich zeigt sich diesbezüglich in einer Studie an Ratten von Woolf 1980, dass der antinozizeptive Effekt der Elektrostimulation durch den Opioidrezeptorantagonisten Naloxon vollständig aufgehoben wird.16
Abb. 1: Das Gesamtsystem der Firma Boston Scientific mit Elektroden, Impulsgeber, Steuergerät und Programmiereinheit. In unserer peripheren Nervenstimulation werden nur 8-polige Elektroden verwendet. Das Bild ist Eigentum der Firma Boston Scientific Ges.m.b.H.
Die Evidenz im Bereich der peripheren Nervenstimulation ist nach wie vor spärlich. In der vierten, überarbeiteten Edition der Therapie-Guidelines von Harden et al. 2013 wurde die PNS als „sinnvolle Option bei Spätstadien des CRPS, bei herkömmlichem Therapieversagen“ beschrieben. Diese Aussage begründeten die Autoren mit Studienergebnissen, die eine Schmerzreduktion von über 50% bei Patienten mit CRPS und implantiertem Neurostimulationssystem zeigten.6
Zur zentralen Nervenstimulation im Rückenmark („spinal cord stimulation“, SCS) gibt es jedoch reichlich Evidenz. SCS hat eine Level-1-Evidenz (stärkste Evidenz) bezüglich der Behandlung von CRPS.17
Das technische System, das bei der PNS zum Einsatz kommt, und auch die Parameter zur Stimulation sind die gleichen, die auch bei der SCS zum Zug kommen.
Die PNS im LKH Graz
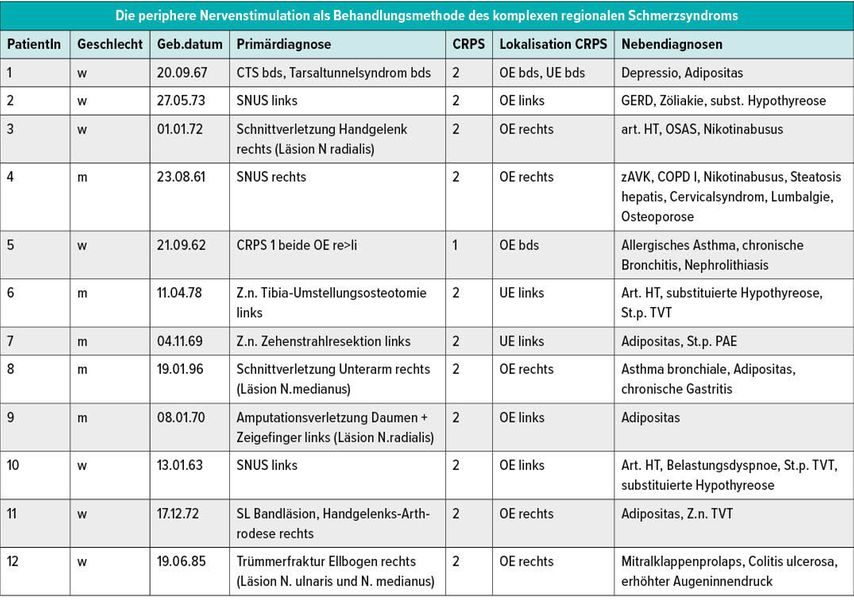
Seit 2019 wurden im LKH Universitätsklinikum Graz 12 Patienten mit CRPS 1 oder 2 zur Implantation eines peripheren Nervenstimulationssystems auserwählt.
Die Indikationsstellung erfolgte hierbei anhand folgender Selektionskriterien:
Diagnose eines CRPS 1 oder 2 nach modifizierten Budapest-Kriterien
Schmerzen von mehr als 6 Monaten (Definition des chronischen Schmerzes)
Schmerzen anhand NRS oder VAS ≥6
Versagen aller konservativen und operativen Therapiekonzepte
Das verwendete System (Boston Scientific Inc., Abb. 1) besteht aus einem implantierbaren Anteil (Elektroden und dem Impulsgeber) und externen Komponenten (einem Steuer- und einem Ladegerät), die über Induktion die Einstellung und Veränderung der Stimulationsparameter sowie das erneute Aufladen des Impulsgebers erlauben. Die Elektroden (Linear™ ST Lead Kit, 8-polig, 30, 50, 70cm) verfügen an ihren Enden über 8 aktive Pole, die frei programmierbar sind.
Entsprechend dem Verteilungsmuster des Schmerzes werden die aktiven Elektrodenpole möglichst parallel und nahe am Epineurium der peripheren Nervenplatziert (Stammnerven wie der N. ischiadicus an der unteren Extremität bzw. in den Trunci oder Faszikel im Bereich des Plexus brachialis an der oberen Extremität, Abb. 2 und 3). Die Elektrodenleitungen selbst werden möglichst nahe, ohne große Gelenke zu überschreiten, in einer subkutanen Tasche positioniert, die zur späteren Aufnahme des Impulsgebers geeignet ist. Hier erfolgt die Konnektierung an eine Verlängerungselektrode, die perkutan ausgeleitet und an einen externen Impulsgeber angeschlossen wird. Mit diesem externen Impulsgeber, der in seiner technischen Ausstattung dem implantierbaren, definitiven Impulsgeber entspricht, kann der Patient in einer Probephase über einige Tage den antinozizeptiven Effekt austesten. Dabei wird ein strenges Schmerzprotokoll nach der numerischen Rating-Skala (NRS) geführt. Kommt es in der Testphase zu einer durchschnittlichen Schmerzreduktion von zumindest 4 Punkten auf der NRS und zeigt sich der Patient subjektiv zufrieden, wird anschließend der definitive Impulsgeber (Precision Montage™ MRI Generator [16-contact]) implantiert. Durch diesen wird eine kontinuierliche Stimulation generiert (im Gegensatz zu einer sogenannten „Burst“-Stimulation im Sinne von Impulspaketen). Die Elektrodenpole können frei als Kathode, Anode oder neutral programmiert werden. Die Auswahl der Elektrodenpolarität dient dabei dazu, den gewünschten Bereich möglichst selektiv zu erfassen. Der Impulsgeber ist hinsichtlich Stromstärke, Impulsbreite und Frequenz innerhalb bestimmter Grenzen frei einstellbar. Ziel der Stimulation ist es, zum Komfort des Patienten ein angenehmes „Kribbeln“ bei gleichzeitiger Schmerzreduktion zu erreichen, ohne dass es dabei zu einer ungewollten Aktivierung der Muskulatur kommt.
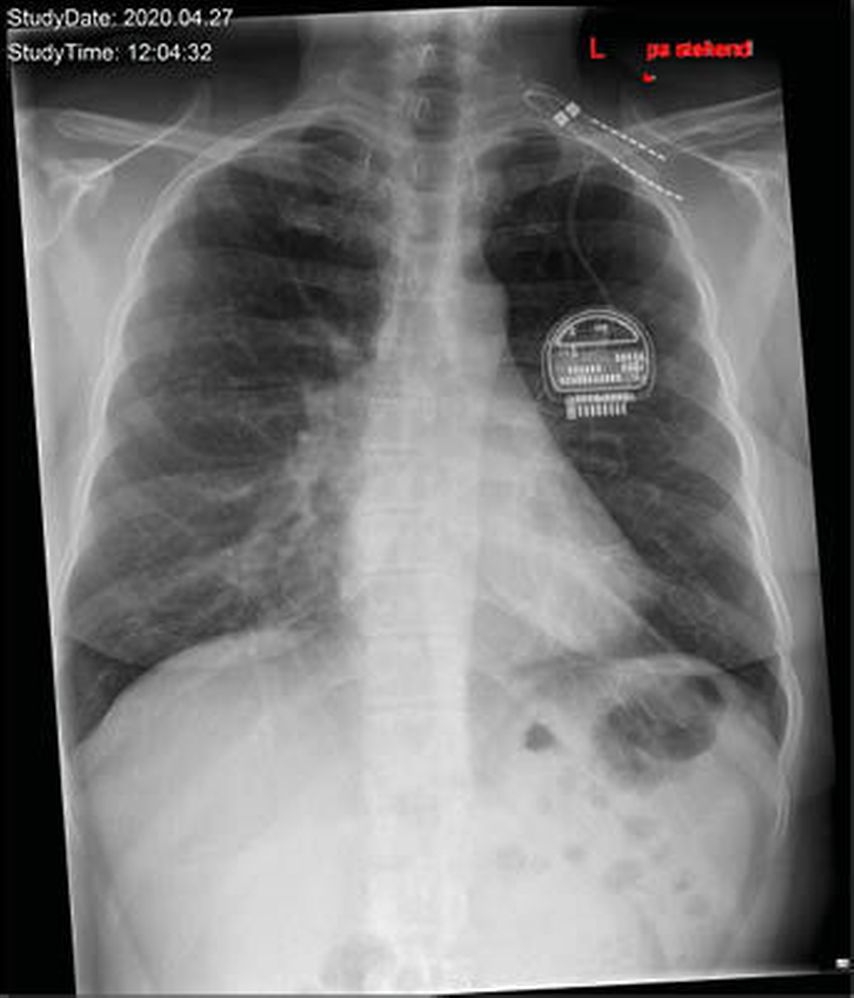
Abb. 2: a.p. Röntgenaufnahme einer Patientin mit implantiertem Neurostimulator und im Bereich des linken Plexus brachialispositionierten Elektroden
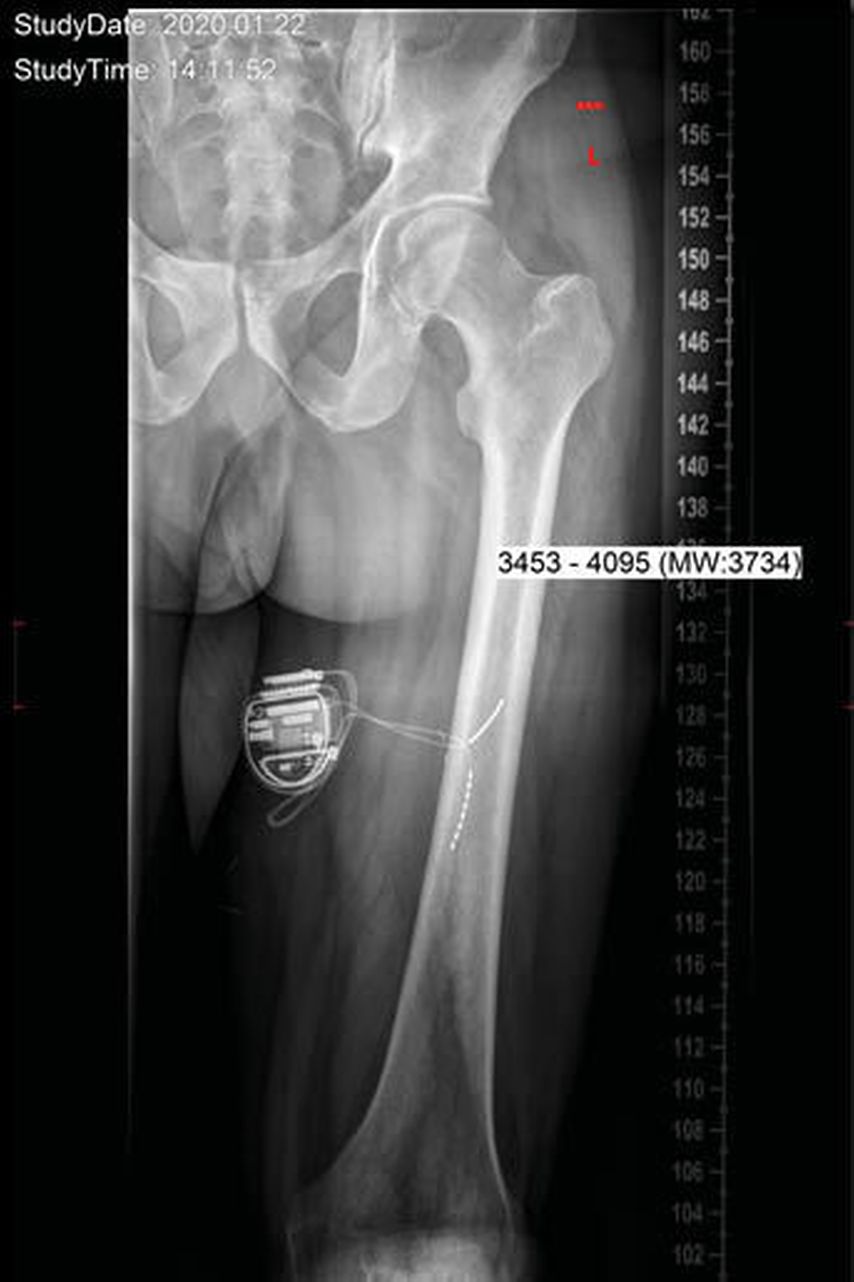
Abb. 3: a.p. Röntgenaufnahme eines Patienten mit implantiertem Neurostimulator und im Bereich des linken N. ischiadicus positionierten Elektroden
Essenziell für den Behandlungserfolg ist die Einbindung des PNS-Systems in ein multimodales Behandlungskonzept (Physio- und Ergotherapie sowie begleitende Psychotherapie und stationäre „Schmerzrehabilitation“). Damit soll neben der psychischen Modulation der Schmerzempfindung auch eine zerebrale Reintegration der durch das CRPS desintegrierten Extremität erfolgen.
Schmerzreduktion beim gesamten Patientenkollektiv
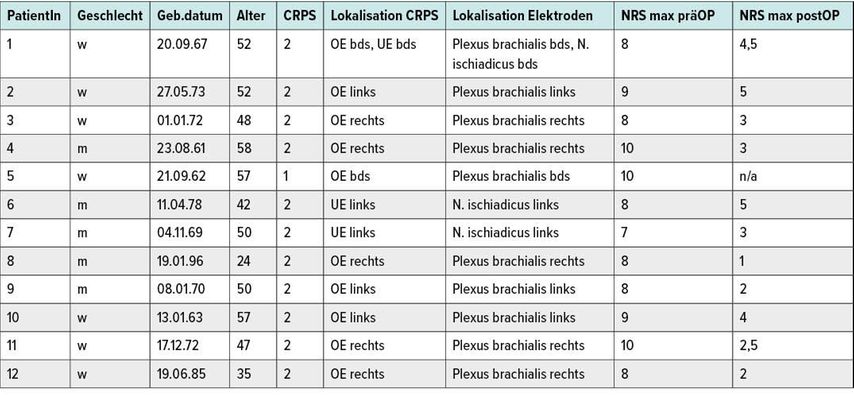
Anhand oben genannter Selektionskriterien ergab sich ein Patientenkollektiv von 12 Patienten, 5 Männer und 7 Frauenim mittleren Alter von 46,3 (24–58) Jahren. Eine Patientin litt an einem CRPS 1, die anderen 11 an einem CRPS 2. Der mittlere Schmerzscore wurde von den CRPS-2-Patienten präoperativ mit durchschnittlich 7,9 (±1,4) auf der zehnteiligen NRS angegeben. 9 Patienten erhielten Elektroden im Bereich der oberen Extremität, 2 Patienten im Bereich der unteren und eine Patientin sowohl an der oberen als auch an der unteren Extremität. Nachdem sich bei allen Patienten in der Testphase eine Schmerzreduktion von zumindest 4 Punkten auf der NRS gezeigt hatte, wurden alle 12 Patienten mit einem definitiven Impulsgenerator versorgt. Die durchschnittliche Schmerzreduktion betrug dabei 4,5 (±2,1) Punkte. Der durchschnittliche postoperative Schmerzscore der Patienten betrug 3,35 (±1,4) Punkte auf der NRS.
Eine Patientenstimme
Ein Interview von Dr. Isabelle Sawetz mit einer glücklichen Patientin, die bei CRPS 2 der rechten oberen Extremitäten Stimulationselektroden an die Faszikel des rechten Plexus brachialis erhalten hat, verdeutlicht die individuellen Benefits der PNS.
Haben Sie von der Nervenstimulation profitiert?
Patientin:Ja, sehr. Es ist das Beste, was mir passiert ist. Ich hatte früher solche Nervenschmerzen, dass ich täglich 12mg Hydromorphon eingenommen habe. Ich habe es nicht mehr ausgehalten. Ich bin damals zu meinem Arzt gegangen und habe gesagt: „Ich halte es nicht mehr aus. Diese Medikamente bringen mich um und die Schmerzen werden nicht besser.“
Sind Sie mit der Nervenstimulation zufrieden?
Patientin: Sehr! Sie hat mir ein neues Lebensgefühl gegeben!
Wie hat sich Ihr Schmerzscore (NRS) im Vergleich vor der Implantation des PNS-Systems mit der Situation danach verhalten?
Patientin: Er ist von präoperativ 8 auf aktuell postoperativ 2–3 gesunken, wenn überhaupt. Es ist ein absoluter Traum. Ich habe meinen Operateur nur noch umarmt und gesagt: „Ich bin ein neuer Mensch!“.
Gibt es – abgesehen von den verminderten Schmerzen – bestimmte Momente im Alltag, in denen Sie eine spezielle Verbesserung bemerken, die Ihre Lebensqualität positiv beeinflusst?“
Patientin: Wetterumschwünge spüre ich sehr stark in der Hand. Da hilft mir der Stimulator extrem gut, da ich die Stromstärke anpassen und bei Bedarf erhöhen kann. Ich bin nicht mehr ausgeliefert, da ich mit meiner Fernbedienung das Gerät selbst einstellen und somit den Schmerz regulieren kann. Es ist ein Traum – für mich Lebensqualität pur.
Wie sieht es von der Funktion der Hand her aus?
Patientin: Bei mir kommen die Handgelenksschmerzen (arthrogen) hinzu. Aber trotzdem kann ich die Hände seit der PNS-Implantation und dem Üben mittels Ergotherapie viel besser einsetzen als davor, gar kein Vergleich.
Würden Sie sich unter gleichen Umständen nochmals mit der Nervenstimulation behandeln lassen?
Patientin: Sofort! So eine Lebensqualität dadurch. Ich kann nur wiederholen: Ich bin ein neuer Mensch. Mir wurde ein neues Leben gegeben.
Tab. 2: Patientendaten mit Lokalisation der Elektroden zur PNS sowie prä- und postoperative Schmerzscores auf einer NRS-Skala von 1–10
Diskussion und Fazit
Für die zentrale Nervenstimulation im Rückenmark zur Behandlung von chronischen Schmerzsyndromen, vor allem im Sinne chronischer Lumboischialgien und therapierefraktärer Rückenschmerzen, gibt es ausreichend Evidenz.17–19 Für die obere Extremität zeigt sich die zentrale Nervenstimulation aufgrund des hohen Risikos und der fatalen Komplikationen (Blutungen im Bereich der HWS, hoher Querschnitt) nicht indikationswürdig. Daher bietet die periphere Nervenstimulation gerade für die obere Extremität ein vielversprechendes, risikoärmeres Anwendungsgebiet.
Die Erfahrung mit der Behandlung unserer Patienten zeigt, dass neuropathische Schmerzen erfolgreich um durchschnittlich etwa 4 Punkte auf der NRS reduziert werden können. Arthrogene Beschwerden hingegen zeigen sich durch die PNS unbeeinflussbar. In diesen Fällen muss auf spezifische operative Verfahren (in unserem konkreten Fall: Handgelenksfusionierung, „single-bone forearm“) zurückgegriffen werden. Anschaulich zeigt sich dies an geführten Schmerzprotokolle, die bei Ruhe (neuropathischer Schmerz) eine deutliche Reduktion zeigen und bei Belastung (arthrogene Schmerzkomponente) doch eine deutliche Zunahme. Die Patienten können den Unterschied meist gut artikulieren, wie sich auch in unserem Fall im Interview zeigt.
Inwiefern die pathophysiologischen Mechanismen des CRPS durch die PNS beeinflusst werden, ist nicht bekannt. Es ist allerdings nicht davon auszugehen, dass die Nervenstimulation einen positiven Effekt auf die neurophysiologischen Veränderungen hat, da es sich um keine kurative Therapie handelt. Wird die Stimulation bei zufriedenen Patienten mit reduziertem Schmerz deaktiviert, treten die ursprünglichen Schmerzen sofort wieder auf, auch wenn die Stimulation schon jahrelang erfolgreich stattgefunden hat.
Abschließend ist wohl nachdrücklich zu erwähnen, dass es sich beim CPRS gemäß WHO-Kriterien um eine psychosomatische Erkrankung handelt, sprich: Sowohl „Psyche“ als auch „Soma“ müssen bei der Behandlung berücksichtigt werden. Die betroffene Extremität muss nach erfolgter zerebraler Desintegration wieder reintegriert werden. Als „Ersatz“ für den nun nicht mehr vorhandenen Schmerz müssen gezielte Reedukationsprogramme mithilfe von Physio- und Ergotherapie, jedoch auch Psychotherapie im Sinne einer Schmerzrehabilitation erfolgen, damit die Wahrnehmung der Extremität normalisiert und somit die Lebensqualität des Patienten verbessert werden kann. Dies macht ersichtlich, weshalb ein multimodaler Therapieansatz so essenziell für den Behandlungserfolg ist.
Literatur:
1 Bruehl S: BMJ 2015; 351: h2730 2 Brunner F: Z Für Rheumatol 2017; 76(4): 335-47 3 No authors listed: Pain 1979; 6(3): 249 4 Treede RD et al.: Pain 2019; 160(1): 19-27 5 Mitchell SW et al.: Clin Orthop 2007; 458: 35-9 6 Harden RN et al.: Pain Med 2013; 14(2): 180-229 7 Żyluk A, Puchalski P: J Hand Surg Eur Vol 2013; 38(6): 599-606 8 de Mos M et al.: Pain 2007; 129(1–2): 12-20 9 Sandroni P et al.: Pain 2003; 103(1–2): 199-207 10 Beerthuizen A et al.: Pain 2012; 153(6): 1187-92 11 Moseley GL et al.: J Pain 2014; 15(1): 16-23 12 Rooij AM et al.: Eur J Pain 2010; 14(5): 510-3 13 Żyluk A, Puchalski P: Neurol Neurochir Pol 2018; 52(3): 326-33 14 Stanton-Hicks MD et al.: Pain Pract 2002; 2(1): 1-16 15 Melzack R, Wall PD: Science 1965; 150(3699): 971-9 16 Woolf CJ et al.: Pain. 1980; 8(2): 237-52 17 Deer TR et al.: Pain Med 2020; 21(7): 1421-32 18 Pollard EM et al.: J Pain Res 2019; 12: 1311-24 19 Grider JS et al.: Pain Physician 2016; 19(1): E33-54
Das könnte Sie auch interessieren:
„Ich habe den schönsten Beruf der Welt“
Mit dem diesjährigen Jahreskongress der Österreichischen Gesellschaft für Plastische, Ästhetische und Rekonstruktive Chirurgie (ÖGPÄRC) in Salzburg hat Prim. Univ.-Doz. Dr. Rupert Koller ...
Gesichtsischämie und vaskuläre Komplikationen nach Filler-Injektion
Vaskuläre Komplikationen nach ästhetischen Filler-Injektionen stellen eine ernsthafte, aber seltene Herausforderung dar. Wir berichten über den Fall einer Patientin mit Gesichtsischämie ...
Patientenerlebnis als strategischer Erfolgsfaktor
Ästhetische Praxen unterscheiden sich nicht nur durch Behandlungen, sondern auch durch das Erlebnis. Wer digitale Präsenz, Ambiente, Konsultation und Nachsorge konsequent gestaltet, ...