Liquid Biopsy: neue Möglichkeiten in der Krebsfrüherkennung und im Therapiemanagement solider Tumore
Autoren:
Dr. Felix Melchior
Dr. Stefan Schuster
Datar Cancer Genetics Europe GmbH
Korrespondierender Autor:
Dr. Felix Melchior
E-Mail: drfelixmelchior@datarpgx.com
Neue Methoden in der Liquid Biopsy (LB) sind deutlich sensitiver im Vergleich zu älteren Verfahren und erlauben den Einsatz im Krebsscreening, in der Diagnostik und im Therapiemanagement. Erste Screeningverfahren basierend auf zirkulierenden Tumorzellen haben bereits von der US-FDA die Breakthrough Device Designation, u.a. für Brustkrebs, erhalten.
Keypoints
-
Eine Vielzahl von Studien belegt die klinische Relevanz der Liquid Biopsy.
-
Blutbasierte Biomarker können zur Früherkennung maligner Tumoren genutzt werden.
-
Interventionelle Studien haben besonders in komplexen Therapiesituationen den Nutzen umfassender Tumoranalysen basierend auf zirkulierenden Biomarkern bewiesen.
-
Bei der Vielzahl an verfügbaren Methoden im Bereich der Liquid Biopsy ist derzeit noch nicht eindeutig, welche sich durchsetzen werden. Klar ist allerdings, dass die Liquid Biopsy bereits jetzt einen wichtigen Beitrag in der Onkologie leisten kann, sowohl im Screening als auch in der personalisierten Therapie.
Krebs zerstört das zelluläre Gleichgewicht im menschlichen Körper mit meist schwerwiegenden Folgen. Mutationen in zentralen Signalwegen, die verantwortlich sind für Apoptose und Proliferation, führen zu unkontrolliertem Zellwachstum und enden schließlich im Versagen des Organs. Aktuell ist eine Histopathologie zur endgültigen diagnostischen Abklärung einer gut- oder bösartigen Veränderung notwendig, welche aber nicht immer möglich ist, z.B. wenn der Tumor nicht zugänglich ist oder die Belastung und das Risiko für den Patienten zu groß sind. Eine Alternative bietet hier die Liquid Biopsy («Flüssigbiopsie»; LB), die auf der einfachen Entnahme von Körperflüssigkeiten, in der Regel Blut, basiert.
Die LB liefert bereits heute in der Onkologie bei der Identifizierung therapeutischer Zielstrukturen und Resistenzmechanismen eine Vielzahl an Informationen mit gleichzeitig minimalem Risiko für den Patienten. Darüber hinaus ist sie insbesondere im Krebsscreening und zum Rezidiv-Monitoring von Krebspatienten geeignet. Der minimal-invasive Charakter ermöglicht wesentliche Verbesserungen in der räumlichen und zeitlichen Erfassung von Biomarkern gegenüber Gewebeproben, die nicht in regelmäßigen Abständen entnommen werden können. Die LB bietet ein aktuelles und umfassendes Abbild des Tumorgeschehens im Körper und ist damit eine ideale Ergänzung zur klassischen Histopathologie oder Bildgebung.
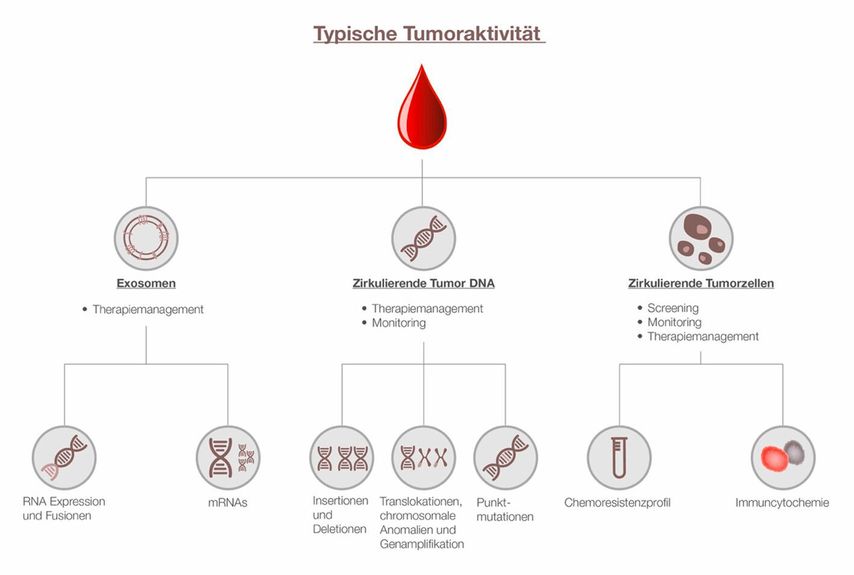
Der klinische Einsatz scheiterte jedoch lange Zeit aufgrund der mangelnden Sensitivität der bisher etablierten Methoden. Konkret lassen sich im Blut des Patienten bei soliden Tumorerkrankungen neben zirkulierenden Tumorzellen (CTCs) und deren Clustern, zirkulierende Tumor-DNA (ctDNA) und extrazelluläre Tumorvesikel (Exosomen) nachweisen (Abbildung 1). Da diese im Blut in nur sehr geringen Mengen vorkommen, benötigte es effiziente Verfahren zur Isolation bzw. hochsensitive Analysen zur Detektion. Die technologischen Fortschritte der letzten 20 Jahre, u.a. «Next Generation Sequencing» (NGS), und die effiziente Isolation zirkulierender Tumorzellen haben dazu beigetragen, diese Analysen für die klinische Diagnostik zugänglich zu machen.
Gegenstand aktueller Forschung ist neben der molekularpathologischen Analyse von Tumoren auch der grundlegende Prozess der Metastasierung. Es existiert eine Reihe von Hypothesen zu den Vorgängen der Metastasierung bei denen CTCs eine zentrale Rolle einzunehmen scheinen. Bereits vor Jahren wurden CTCs als mögliche Marker für das Monitoring maligner Tumorerkrankungen und ihr Potenzial durch funktionelle Analyse im Therapiemanagement beschrieben. Somit kann die LB zukünftig eine ergänzende und effektive Rolle neben bereits existierenden Standardverfahren einnehmen.
Früherkennung maligner Tumore
Ein wichtiger Ansatz bei der Bekämpfung krebsbedingter Sterblichkeit ist die Früherkennung einer auftretenden Tumorerkrankung. Durch regelmäßige Vorsorgeuntersuchungen können Krebszellen bereits in einem kurativen Stadium erkannt werden, bevor sie sich im Körper ausbreiten und mögliche Metastasen schwerwiegende Schäden verursachen können. Darüber hinaus können sich die Behandlungschancen bei frühzeitig diagnostiziertem Krebs in der Regel verbessern. Die Behandlung ist in diesem Stadium weniger belastend und es besteht eine bessere Chance auf eine vollständige Genesung. Das frühe Eingreifen in eine Krebserkrankung bringt auch den Vorteil mit sich, dass der Patient zu diesem Zeitpunkt körperlich weniger geschwächt ist als in einem späten Stadium. All dies kann dazu beitragen, die Sterblichkeitsrate bei bestimmten Krebsarten zu senken. Nicht zu vernachlässigen ist auch die psychologische Komponente, die eine präventive Untersuchung vermittelt. Im Einzelnen kann das Gefühl der Sicherheit und Kontrolle über die eigene Gesundheit zu einer Verbesserung der Lebensqualität beitragen. Aus pharmakoökonomischer Sicht ist die Früherkennung ebenso von Bedeutung, da in der fortgeschrittenen Situation Behandlungskosten in der Regel deutlich höher ausfallen.
Offizielle Krebsscreening-Programme, wie das in Deutschland 2005 eingeführte Mammographie-Screening, haben einen großen Anteil an der allgemeinen Überlebensrate, sie sind in den meisten Ländern aber kein Standard. Laut den Statistiken des Robert-Koch-Instituts sind seit den 2010er Jahren die Teilnahmeraten bei der Mammographie wieder rückläufig und 2019 haben nur ca. 50% der weiblichen Zielgruppe eine solche Vorsorgeuntersuchung in Anspruch genommen. 2019 wurden insgesamt 2,9 Millionen Patientinnen untersucht und davon 121.000 aufgrund eines auffälligen Befundes wiedereinbestellt. 32.500 Patientinnen erhielten eine Biopsie und schlussendlich wurden 16.500 Karzinome präoperativ gesichert. Diese Zahlen zeigen deutlich, dass eine solide Vorsorge Fälle der Krebserkrankung im frühen Stadium aufdecken und somit unabdingbar sind. Aufgrund der rückläufigen Teilnahmeraten kommt es wieder vermehrt zur Diagnose von Brustkrebs in Stadium III und IV. Die Gründe für die gesunkene Akzeptanz scheinen vielfältig zu sein – COVID hat die Situation zusätzlich negativ beeinflusst. Aus diesem Grund sollten weitere alternative Früherkennungsmethoden in Betracht gezogen werden.
Auf Basis der LB sind vor allem zwei Verfahren weit vorangeschritten: die Analyse von CTCs und von ctDNA (zirkulierende Tumor-DNA bzw. zirkulierende freie DNA). Während für ctDNA die Methodik grundsätzlich gut etabliert ist, sieht das Methodenspektrum zur Isolierung und Anreicherung der nur in geringer Konzentration vorkommenden CTCs sehr unterschiedlich aus. Verfahren, die auf den physikalischen Eigenschaften der CTCs basieren, machen sich deren Unterschiede in Größe, Dichte, Deformierbarkeit oder dielektrischen Eigenschaften zu Nutzen. Auch über molekularbiologische Eigenschaften lassen sich CTCs bedingt isolieren. Vor allem antigen-basierte Verfahren, allen voran die Verwendung von mit anti-EpCAM beladenen paramagnetischen Partikeln, finden bis heute vermehrt Anwendung. Jedoch können CTCs mit diesen oftmals erst in der metastasierten Situation nachgewiesen werden, ein Nutzen für das Screening konnte somit nicht geliefert werden.
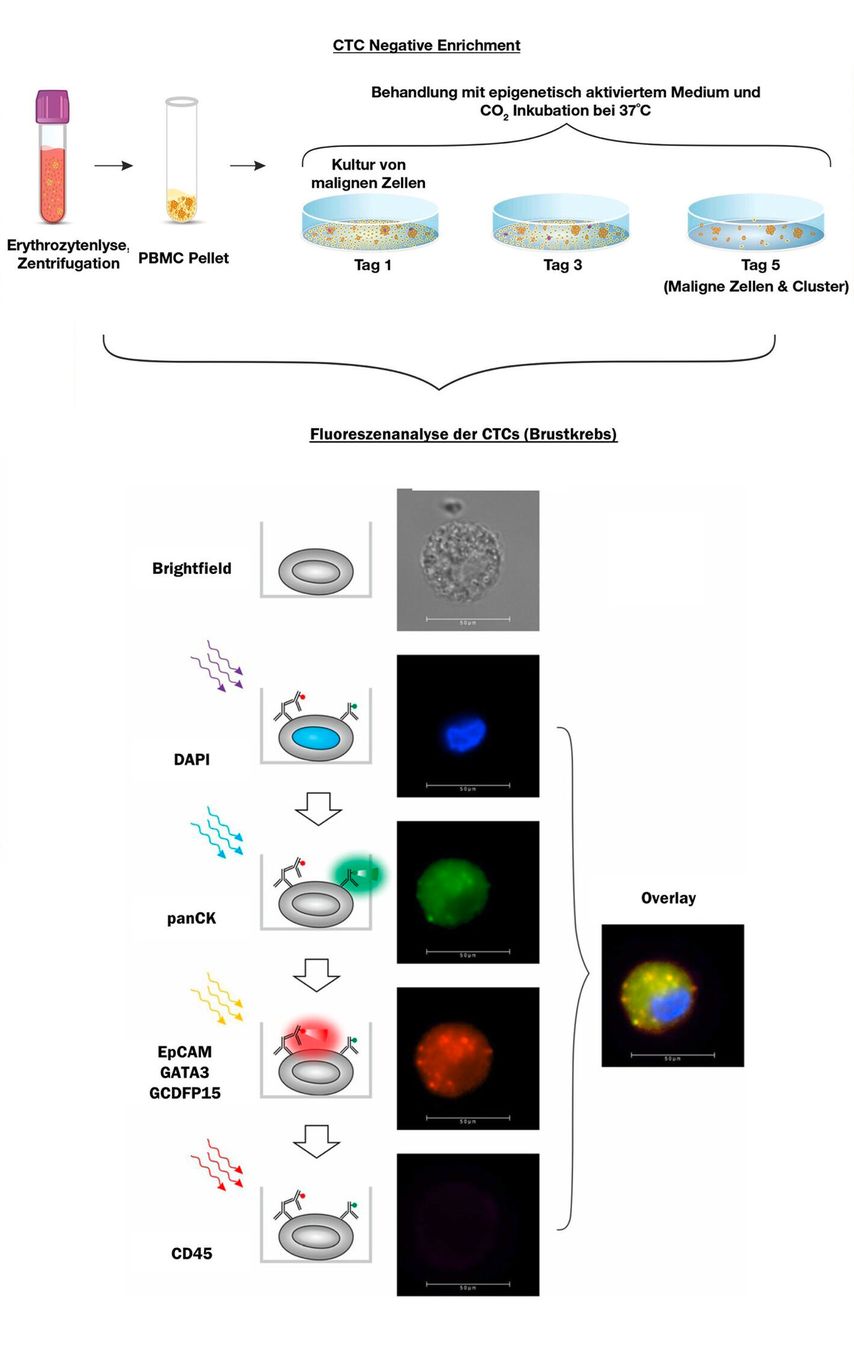
Neuartigere Methoden machen sich hingegen die Apoptoseresistenz der Tumorzellen zu Nutzen. So sind in Tumorzellen, und damit auch in CTCs, apoptoserelevante Signalwege wie TNF, JAK/STAT oder auch NFκβ blockiert. Indem die kernhaltigen Blutzellen (PBMCs) aus der LB in einer Kurzzeitkultur einem Überschuss an apoptoseinduzierenden Wachstumsfaktoren ausgesetzt werden, lässt sich die Apoptoseresistenz der CTCs durch negative Selektion nutzen, was zu einer effizienten Isolation der CTCs gegenüber benigner PBMCs führt (Abbildung 2).1 Es konnte außerdem gezeigt werden, dass mittels dieser Methode CTCs in >90% aller Krebspatienten und in <3,7% einer gesunden und asymptomatischen Population nachgewiesen wurden. Die Datenlage für dieses Verfahren zeigt auch, dass die Identifikation von CTCs einen Sensitivitätsvorteil gegenüber ctDNA-basierten Methoden bei der Entdeckung von Krebs in frühen Stadien aufweist.1,2 Das klinische Potenzial eines CTC-basierten Screenings wurde in mehreren prospektiven und retrospektiven Studien gezeigt. Alkolkar et al. untersuchten über 16.000 Probanden, davon ca. 10.500 Krebspatienten in unterschiedlichen Stadien und ca. 5.500 asymptomatische Individuen. In dieser Studie wurde erstmals gezeigt, dass CTCs ubiquitär und unabhängig vom Stadium in ca. 88% der Krebsfälle identifiziert werden konnten. Speziell für das Mammakarzinom konnte das Verfahren in einer 2022 veröffentlichten prospektiven klinischen Studie bei 141 Verdachtsfällen mit einer Spezifität von 93,1% und einer Sensitivität von 94,6% gutartige (n=29) von malignen (n=112) Veränderungen unterscheiden.3 In dieser und einer weiteren Studie zum Prostatakarzinom wurde gezeigt, dass CTCs in 81% bzw. 75% der untersuchten Fälle die gleichen Mutationen wie das Tumorgewebe tragen. Dies stützt die Hypothese, dass die gefunden CTCs mit hoher Wahrscheinlichkeit aus dem ursprünglichen Tumorgewebe stammen.3,4 Darüber hinaus zeigte sich in einem einjährigen Follow-up, dass die oben genannten gesunden (d.h. asymptomatischen und im Screening unauffälligen), jedoch CTC-positiven Patienten ein vielfach (230-fach) erhöhtes Krebsrisiko im Vergleich zu CTC-negativen Patienten haben.5
Abb.2: Detektion von CTCs bei einer Brustkrebspatientin durch Nutzung der atypischen Apoptoseeigenschaften von Krebszellen
Bislang erteilte die FDA für weniger als 15 blutbasierte Methoden (Stand Q1/2023) eine «Breakthrough Device Designation». Ausschließlich mit klinischen Daten belegte Verfahren können von der FDA in dieses spezielle Programm aufgenommen werden. Drei dieser Methoden stammen von der Firma Datar Cancer Genetics Ltd., die auf der oben beschriebenen negativen Selektion von CTCs beruhen. Bei diesen Tests handelt es sich neben einem generellen Brustkrebsscreening um die diagnostische Abklärung von Prostatakrebs bei Patienten mit einem PSA-Wert >3ng/ml Blut und um die Detektion von Gliomen. Nicht unerwähnt sollte bleiben, dass diese Verfahren auch symptomlose Tumore finden können, aber derzeit noch keine Aussage über die Aggressivität anhand von CTCs getroffen werden kann. Zusätzlich stellt sich die Frage, wie mit Patienten umgegangen wird, bei denen zwar CTCs vorhanden sind, jedoch in der Bildgebung kein Tumor entdeckt wird. Es wird bereits daran gearbeitet zukünftig auch für diese Situationen Antworten und Routinen zu entwickeln.
Dennoch liegen die allgemeinen Vorteile einer minimal-invasiven LB auf der Hand: dem Patienten kann praktisch in jeder Praxis Blut abgenommen werden und mögliche Risiken invasiver Methoden können zunächst vermieden werden. Folglich kann ein solcher Test ergänzend zur Früherkennung bei erhöhtem familiärem Risiko oder auch speziell im Brustkrebsscreening bei Patientinnen mit sehr dichtem Brustgewebe effizient eingesetzt werden.
Personalisiertes Therapiemanagement bei fortgeschrittenem Krebs
In den vergangenen Jahren hat eine Vielzahl von Basket Trials mit wachsendem Erfolg gezeigt, dass eine personalisierte Therapie anhand der molekularen Eigenschaften und unabhängig vom Tumorursprung sinnvoll ist.6 Dabei spielt die LB in der Onkologie eine zunehmend wichtige Rolle. Die Vielfalt der vorhandenen Verfahren ist sicherlich einer der Gründe, dass sich die LB bislang in den aktuellen Leitlinien nur in Nischen, z.B. EGFR-Testung bei Lungenkrebs, durchgesetzt hat. Vor allem bei schwierig zu behandelnden oder seltenen Tumoren zeigen verschiedene Publikationen allerdings klare Vorteile der LB auf, da sich, wenn Leitlinientherapien ausgeschöpft oder nicht vorhanden sind, häufig die Frage nach effektiven Weiterbehandlungen stellt.7–9 Bei fortgeschrittenen Tumoren kommt hinzu, dass i.d.R. mit jedem Therapiewechsel das Ansprechen der Folge-Therapie durch neue Resistenzen an Effektivität abnimmt und gleichzeitig das Management der Nebenwirkungen aufwändiger wird.10
Das aktuelle Methodenspektrum erlaubt mittels Isolation von ctDNA und CTCs aus der LB die Erstellung detaillierter molekularbiologischer und genetischer Tumorprofile. Die Identifikation diverser Biomarker zeigt dabei häufig Therapieoptionen auf, die nicht nur auf zielgerichtete Therapien beschränkt sind, sondern auch Hinweise auf die Wirksamkeit einer spezifischen zytotoxischen Therapie erlaubt. Bei den Kombinationstherapien zeigt sich, dass die systemische Chemotherapie immer noch ein Hauptpfeiler in der Behandlung maligner Tumore ist. In den Leitlinien variiert abhängig von der Tumorart die Anzahl der empfohlenen Chemotherapeutika deutlich. Ohne konkrete funktionelle Analysen ist die Wahl einer geeigneten Chemotherapie aktuell jedoch häufig ein empirischer Prozess.
LIQUID IMPACT ist eine klinische Pilotstudie, bei der Patienten mit fortgeschrittenem refraktärem Krebs eine Kombinationstherapie erhielten, die auf zirkulierenden Tumor-Biomarkern basiert (Exacta® Test), u.a. CTCs, ctDNA (409 Gene), exosomaler mRNA (20.800 Gene) und Pharmakogenetik.11 Für die Studie wurde in 1.299 realen Fällen die Existenz therapierelevanter blutbasierter Marker untersucht, um das Vorhandensein molekularer Targets zu evaluieren und anhand dieser die Studiengröße zu beurteilen. Final konnten 26 Patienten in die prospektive Studie eingeschlossen werden, von denen nach Verabreichung der durch die Testung ermittelten Therapien 12 eine partielle Remission zeigten und 11 in eine stabile Erkrankung überführt werden konnten. Dies entspricht insgesamt einer Krankheitskontrollrate (DCR) von 88,5%. Das mediane progressionsfreie Überleben (mPFS) und das mediane Gesamtüberleben (mOS) betrugen 4,3 Monate bzw. 8,8 Monate. In der Studie sind keine schwerwiegenden Nebenwirkungen beobachtet worden.11
Vorangegangen waren drei prospektive interventionelle Studien, die bei einer Gruppe von 230 Patienten zusätzlich zur LB auch Gewebe untersuchten (Genetik und Immunhistochemie). Diese Subpopulation wies eine 93%-ige Übereinstimmung des Ansprechverhaltens der Chemotherapeutika zwischen den durch LB isolierten CTCs und frischen Gewebsbiopsien auf. Der große Vorteil der LB ist die vereinfachte Gewinnung der Proben. Außerdem ermöglicht die LB je nach Tumorart überhaupt eine Probengenerierung und kann theoretisch nach jedem gravierenden Eingriff in das Therapiegeschehen wiederholt werden.
Rezidiv-Monitoring
Der Begriff «ctDNA Rezidiv» taucht im Rahmen des Monitorings seit 2021 auf und beschreibt einen auffälligen Anstieg an messbarer ctDNA in der LB ohne offensichtliches Rezidiv in der Bildgebung. Die Vorlaufzeit der Detektion von ctDNA bis zum radiologischen Befund betrug in verschiedenen retrospektiven Studien bis zu 11 Monate.16 Patientinnen mit HR+/HER2- Brustkrebs können auch mehr als 20 Jahre nach Erstdiagnose noch ein Rezidiv bilden. Das kumulative Risiko von Patientinnen mit BRCA1/2-Mutation nach einer ersten Brustkrebserkrankung innerhalb von 25 Jahren in der kontralateralen Brust Krebs zu entwickeln, liegt bei ca. 47% (bei unter 40-Jährigen sogar bei 63%).17,18 Entsprechend groß ist das Nutzen des Monitorings mittels LB für diese Risiko-Patientinnen. Ob und wie eine systemische Behandlung bereits bei Vorliegen eines ctDNA Rezidivs möglich bzw. sinnvoll ist, muss erst noch gezeigt werden. Eine Kombinationsanalyse zusammen mit CTCs ermöglicht eventuell eine noch umfassendere Betrachtungsweise. Die Daten sind hier allerdings noch uneinheitlich, da die Methoden derzeit stark voneinander abweichen.
Zusammenfassung
Vorteile der LB sind in verschiedenen Situationen gegeben, unabhängig davon, ob es sich um ein Screening oder das Management in fortgeschrittenen Krebsstadien handelt. Noch ist es verfrüht davon auszugehen, dass in naher Zukunft etablierte Methoden durch LB ersetzt werden. Dafür variieren die Verfahren für die CTC-Analyse zu sehr. Die kommende Regulierung der In-Vitro-Diagnostika (IVDR) wird hier ein zusätzliches Maß an Sicherheit in Europa schaffen. Allerdings kann die LB bereits jetzt schon einen wertvollen Beitrag in Ergänzung zu Standardverfahren leisten. Ein geeignetes Erwartungsmanagement sowohl für den behandelnden Arzt als auch für den Patienten ist notwendig, um Vorteile wie z.B. sensitive Früherkennung von malignen Erkrankungen zu ermöglichen, aber auch um Nachteile wie Überdiagnosen klar zu formulieren. Der Einsatz der personalisierten Onkologie in frühen Situationen, um bereits in der Erstlinie die Therapie anzupassen, wird sicherlich noch einige Zeit in Anspruch nehmen. In der fortgeschrittenen Krebssituation liegen aber bereits fundierte Daten vor, die einen Vorteil durch den Einsatz von LB deutlich hervorheben.
Literatur:
1 Akolkar D et al.: Circulating ensembles of tumor-associated cells: A redoubtable new systemic hallmark of cancer. Int J Cancer 2020; 146(12): 3485-94 2 Klein EA et al.: Clinical validation of a targeted methylation-based multi-cancer early detection test using an independent validation set. Ann Oncol 2021; 32(0): 1167-77 3 Crook T et al.: Accurate Screening for Early-Stage Breast Cancer by Detection and Profiling of Circulating Tumor Cells. Cancers (Basel) 2022; 14(14): 3341 4 Limaye S et al.: Accurate prostate cancer detection based on enrichment and characterization of prostate cancer specific circulating tumor cells. Cancer Med 2023; 12(8): 9116-27 5 Ranade A et al.: Hallmark Circulating Tumor-Associated Cell Clusters Signify 230 Times Higher One-Year Cancer Risk. Cancer Prev Res 2021; 14(1): 11-6 6 Haslam A et al.: A systematic review of basket and umbrella trials in oncology: the importance of tissue of origin and molecular target. Eur J Cancer; 178: 227-33 7 Nagarkar R et al.: Encyclopedic tumor analysis for guiding treatment of advanced, broadly refractory cancers: results from the RESILIENT trial. Oncotarget 2019; 10(54): 5605-21 8 Crook T et al.: Improved Treatment Outcomes by Using Patient Specific Drug Combinations in Mammalian Target of Rapamycin Activated Advanced Metastatic Cancers. Front Pharmacol 2021; 12: 61135 9 Crook T et al.: Angiogenesis Inhibitors in Personalized Combination Regimens for the Treatment of Advanced Refractory Cancers. Front Mol Med 2021; 1 10 Wang X et al.: Drug resistance and combating drug resistance in cancer. Cancer Drug Resist 2019; 2(2): 141-60 11 Patil D et al.: Multi-analyte liquid biopsies for molecular pathway guided personalized treatment selection in advanced refractory cancers: A clinical utility pilot study. Front Ocol 2022; 12: 972322 12 Ignatiadis M et al.: Circulating Tumor Cells and Circulating Tumor DNA: Challenges and Opportunities on the Path to Clinical Utility. Clin Cancer Res 2015; 21(21): 4786-800 13 Hayes DF et al.: Circulating tumor cells at each follow-up time point during therapy of metastatic breast cancer patients predict progression-free and overall survival. Clin Cancer Res 2006; 12(14): 4218-24 14 Khoo BL et al.: Short-term expansion of breast circulating cancer cells predicts response to anti-cancer therapy. Oncotarget 2015; 6(17): 15578-93 15 Crook T et al.: Clinical utility of circulating tumor-associated cells to predict and monitor chemo-response in solid tumors. Cancer Chemother Pharmacol 2021; 87(2): 197-205 16 Ignatiadis M et al.: Liquid biopsy enters the clinic - implementation issues and future challenges. Nat Rev Clin Oncol 2021; 18(5): 297-312 17 Graeser MK et al.: Contralateral breast cancer risk in BRCA1 and BRCA2 mutation carriers. J Clin Oncol 2009; 27(35): 5887-92 18 Pan H et al.: 20-Year Risks of Breast-Cancer Recurrence after Stopping Endocrine Therapy at 5 Years. N Engl J Med 2017; 277(19): 1836-46
Das könnte Sie auch interessieren:
„Ich habe den schönsten Beruf der Welt“
Mit dem diesjährigen Jahreskongress der Österreichischen Gesellschaft für Plastische, Ästhetische und Rekonstruktive Chirurgie (ÖGPÄRC) in Salzburg hat Prim. Univ.-Doz. Dr. Rupert Koller ...
Kurpfuscherei in der Ästhetik
Die Message lautet: „Ästhetische Eingriffe gehören ausschließlich in ärztliche Hände“ – das ist leider nicht immer so. Die Praxis sieht deutlich anders aus. JATROS Dermatologie & ...
Jugendlich statt „schön“ um jeden Preis
Die ästhetische Medizin hat sich aus den Möglichkeiten der Medizin und den Wünschen der Menschen entwickelt. Die angebotenen Behandlungen haben eine Sonderstellung, denn viele davon sind ...