Innovationen in der Behandlung von chronischen Wunden
Autor:innen:
Dr. Andrzej Hecker, MSc1,2
Assoc. Prof. Mag. Dr. Petra Kotzbeck1,2
Univ.-Prof. Dr. Lars-Peter Kamolz, MSc1,2
1 COREMED – Zentrum für Regenerative Medizin und Präzisionsmedizin
JOANNEUM RESEARCH Forschungs-
gesellschaft mbH
Graz
2 Klinische Abteilung für Plastische, Ästhetische und Rekonstruktive Chirurgie Universitätsklinik für Chirurgie
Medizinische Universität Graz
Korrespondierender Autor:
Dr. Andrzej Hecker, MSc
E-Mail: Andrzej.Hecker@joanneum.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Schätzungsweise 1–1,5% der Bevölkerung in den Industrieländern weisen chronische Wunden auf. Demnach werden in Europa in etwa 2–4% der gesamten Gesundheitsausgaben für die Wundversorgung verwendet.1 Steigende Inzidenzen sowie hohe Prävalenzen von chronischen Wunden stellen bei einer immer älter werdenden Gesellschaft demnach auch in Zukunft ein gesellschaftliches Problem dar.
Bei ausbleibendem Goldstandard für die Behandlung von chronischen Wunden können neue innovative (additive) Therapiemöglichkeiten sozioökonomisch sowie für betroffene Patient:innen einen nicht zu unterschätzenden Vorteil mit sich bringen. Additive Anwendungen von intelligenten Verbänden, Hautersatzmaterialien oder physikalischen Methoden wie der Kaltplasmatherapie oder Elektrostimulation können eine sinnvolle Ergänzung zum herkömmlichen Behandlungsregime bei chronischen Wunden sein. Ausgewählte innovative Behandlungen von chronischen Wunden werden im folgenden Abschnitt näher beschrieben.
„Intelligente Verbände“
„Intelligente Verbände“ („smart dressings“) sind innovative medizinische Hilfsmittel, die fortschrittliche Technologien nutzen, um eine verbesserte Überwachung und Behandlung von Wunden zu ermöglichen. Diese Verbände gehen über die herkömmlichen Verbandsmaterialien hinaus, indem sie therapeutische, diagnostische und/oder sensorische Funktionen integrieren. Hierdurch können wichtige Parameter der Wundumgebung in Echtzeit erfasst und überwacht werden. Dazu gehören wundheilungsbezogene Parameter wie Temperatur, pH-Wert, Feuchtigkeits- sowie Sauerstoffgehalt.2–4 Je nach gewünschter Funktion sind diese Verbände mit entsprechenden hohen Kosten verbunden oder befinden sich noch in der Entwicklungs- bzw. Zulassungsphase. Dies limitiert den klinischen Routineeinsatz von „intelligenten Verbänden“ stark. Aus diesem Grund sind alternative Produkte mit ähnlichen Funktionen nötig. Ein besonders vielversprechendes Produkt ist die biotechnologisch hergestellte bakterielle Nanocellulose (BNC), die bereits in der Verbrennungschirurgie erfolgreich eingesetzt wird. BNC schützt mit einem Wassergehalt von 95% die Wunde vor übermäßigem Flüssigkeitsverlust und absorbiert gleichzeitig Wundexsudat, was den Heilungsprozess maßgeblich beschleunigt. Die Kombination von Antiseptika mit BNC hat sich bereits als effizienter Ansatz zur Bekämpfung bakterieller Infektionen gezeigt.5,6 Neben der Antiseptika-Funktionalisierung konnte ein pH-Indikatorfarbstoff (GJM-534) erfolgreich mit BNC funktionalisiert werden. Hierdurch konnte ein pH-Monitoring durch den Verband selbst erreicht werden.7 Beide Modifikationen von BNC stellen klinisch praktikable Ansätze zur Verbesserung der Wundsituation von chronischen Wunden dar. Da das Beladen von BNC schnell und einfach durchgeführt werden kann, ist der Einsatz von funktionalisiertem BNC besonders gut für den klinischen Alltag geeignet. Insgesamt stellen intelligente Verbände eine vielversprechende Innovation im Bereich der modernen Wundversorgung dar.
Hautersatzmaterialien
Hautersatzmaterialien (Hautsubstitute) sind biologische oder (bio)synthetische Materialien, die offene Hautwunden vorübergehend oder dauerhaft abdecken. Je nachdem, welche Hautschicht wiederhergestellt werden soll, unterscheidet man zwischen epidermalen, dermalen und kombinierten Hautersatzmaterialien. Bei epidermalen Hautersatztechniken können autologe Zellen (z.B. Keratinozyten) aus einer intakten Hautprobe entnommen, isoliert, angereichert und wieder retour transplantiert werden. Dermale Hautsubstitute können azellulär oder zellulär aufgebaut sein und vom Menschen (Allograft) oder vom Tier (Xenograft) gewonnen werden.8 Die derzeit verfügbaren extrazellulären Matrizen sind überwiegend tierischen Ursprungs (Schwein, Rind) oder aus Amnion aufgebaut. Komponenten innerhalb der Matrizen sind häufig Kollagene, Elastin, Glykoproteine, Wachstumsfaktoren und Zytokine. Durch die enthaltenen Zytokine und Wachstumsfaktoren können dermale Matrizen somit Zellproliferation und -migration unterstützen. Hierdurch wird zum einen die Angiogenese begünstigt und zum anderen Inflammation und Matrixmetalloproteinasen reguliert, die schlussendlich über Gefäßeinsprossungen und Gewebsregeneration zu einer verbesserten Wundheilung führen können.8,9
Biologische Hautersatzmaterialien: Fischhaut und Hautersatz aus lebenden humanen Zellen
Fischhaut ist als neue biologisch abbaubare marine Omega-3-Wundmatrix schon seit geraumer Zeit in der Anwendung. Sie besitzt eine ähnliche Struktur und Zusammensetzung wie die extrazelluläre Matrix der menschlichen Haut. Studiendaten zeigen, dass Fischhaut gerade bei schweren und nichtheilenden Wunden den Heilungsprozess im Vergleich zur Standardtherapie beschleunigen kann. Hierbei scheint die Interaktion mit den Omega-3-Fettsäuren der Haut eine wichtige Rolle zu spielen.10 Daneben konnten sich ebenso zelluläre, biologisch aktive Hautersatzverfahren beim Einsatz in der Behandlung von chronischen Wunden behaupten.11–13 Ein solcher Hautersatz besteht aus lebenden, humanen Zellen wie Keratinozyten und Fibroblasten, die sich innerhalb einer Matrix (z.B. Kollagenmatrix) befinden.12,13
Entwicklung und Einsatz synthetischer Hautersatzmaterialien: eine breite Palette an Optionen
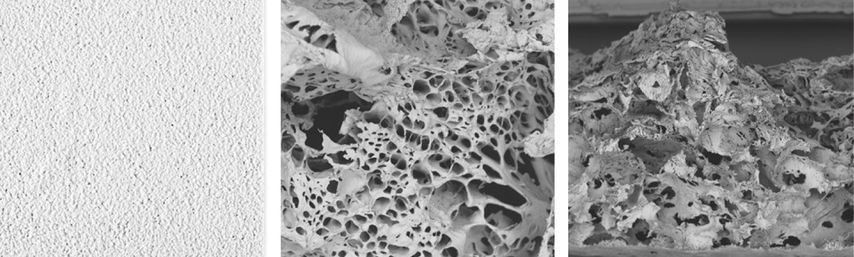
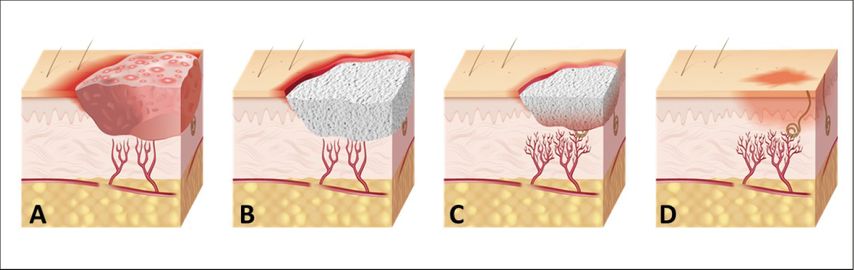
Neben biologischen Materialien kommen aber immer mehr auch rein synthetische Materialien zum Einsatz, da synthetische Materialien vergleichsweise mit wesentlich weniger Allergien sowie übertragbaren Infektionen einhergehen.8,14 Im Fokus der Entwicklung und Anwendung stehen Materialien, die auch Bestandteil der extrazellulären Matrix sind (zum Beispiel Kollagen, Hyaluronsäure und ihre Derivate). Darüber hinaus kommen auch verschiedene Polymere/Polymerkomposite wie zum Beispiel Polyurethan, Silikone, Polycaprolacton oder Polymilchsäureverbindungen bei synthetischen Hautsubstituten zum Einsatz. Polymilchsäure-basierende Hautsubstitute konnten bereits positive Resultate und eine sichere Anwendung bei der Behandlung von chronischen Wunden zeigen.14 Durch den synthetischen Charakter dieser Materialien ist eine artifizielle Matrixanpassung möglich. Hierdurch können u.a. Materialdicke, Porosität und Porengröße angepasst werden (Abb. 1). Je nach Porengrößen der synthetischen Matrizen können Zellmigration sowie Vaskularisation gesteuert werden (Abb. 2), auch beeinflussen unterschiedliche Porengrößen unterschiedliche Zellprozesse.15,16 Eine optimale Kombination von kleinen (unterstützen Zellmigration) und großen Poren (unterstützen das Einwachsen von Blutgefäßen) kann demnach auf mehreren Ebenen der Wundheilung förderlich wirken.
Abb. 1: V.li.n.re.: Synthetische Matrix im Ganzen, elektromikroskopisches Bild der bimodalen Struktur (kleine und große Poren) der Oberseite und Querschnitt der synthetischen Matrix. Mit freundlicher Genehmigung der PolyMedics Innovations GmbH
Abb. 2: Schematische Darstellung der Behandlung einer chronischen Wunde mit einer synthetischen Matrix. A) Chronische Wunde. B) Anwendung von synthetischer Matrix nach Débridement. C) Fortschreitende Vaskularisierung und Verkleinerung der Wundgröße. D) Wundheilung.
Kaltplasmatherapie
Plasma ist ein ionisiertes Gas und stellt neben fest, flüssig und gasförmig den vierten Aggregatszustand der Materie dar. Man unterscheidet zwischen nichtthermischem („kaltes“) und thermischem („heißes“) Plasma. Während „heißes“ Plasma vollständig ionisiert ist, bleibt „kaltes“ Plasma nur teilweise ionisiert. Die Reaktivität von „kaltem“ Plasma stammt im Gegensatz zum „heißen“ Plasma von energiereichen Elektronen. Dies führt dazu, dass im Gegensatz zum „heißen“ Plasma die beteiligten Moleküle und Ionen „kalt“ bleiben – somit ist temperaturbedingt eine Anwendung am Menschen möglich.17
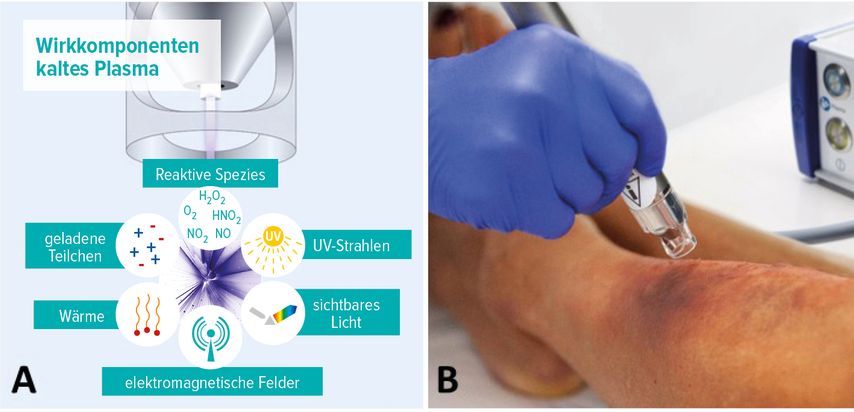
Plasma beinhaltet nicht nur sichtbares Licht und thermische sowie elektromagnetische Strahlung, sondern auch Infrarot- und UV-Strahlung, Ionen, Elektronen sowie reaktive Sauerstoff- und Stickstoff-Spezies (Abb. 3).17,18 Auch wenn das komplexe Funktionsprinzip von Kaltplasma bisher noch nicht vollständig geklärt ist, scheinen aus den genannten Plasmabestandteilen relevante Wechselwirkungen auszugehen, die zelluläre Funktionen anregen als auch blockieren können. Diese Wechselwirkungen zeichnen sich durch zellstimulierende sowie antimikrobielle Effekte aus, die schlussendlich positive Effekte auf die Wundheilung haben können. Reaktive Sauerstoff- und Stickstoff-Spezies besitzen desinfizierende sowie antibakterielle Eigenschaften, die zur mechanischen Lyse von Zellen und peroxidativen Schäden innerhalb der Mikroorganismen führen.17,18 Hierdurch können schlussendlich die Mikroorganismen eliminiert werden. Dieser Effekt konnte ebenso bei multiresistenten Keimen beobachtet werden.19
Abb. 3: A) Schematische Darstellung der Wirkkomponenten von Kaltplasma. B) Kaltplasmajetgerät im klinischen Einsatz. Mit freundlicher Genehmigung der neoplas med GmbH
Eine Reduktion der bakteriellen Besiedlung konnte bereits in klinischen Studien bei chronischen Wunden aufgezeigt werden, wobei diabetische Fußsyndrome dominierend von der Kaltplasma-Anwendung profitierten.20–22 Andere Studien hingegen konnten keinen positiven Effekt auf die bakterielle Besiedlung berichten.23,24 Neben antibakteriellen Effekten, kann sich die Kaltplasmaapplikation konkordant positiv auf die Wundheilung bei chronischen Wunden auswirken.22,24–26 Rezente randomisierte kontrollierte Studien berichteten die signifikante Überlegenheit der additiven Nutzung der Kaltplasmajet-Therapie gegenüber dem alleinigen „Standard of Care“ in der Behandlung von chronischen Wunden.24,26 Andere Studien hingegen berichteten über ausbleibende positive Effekte beim Kaltplasmaeinsatz in chronischen Wunden.21,23 Aufgrund der derzeitigen spärlichen Studienlage sowie heterogener Ergebnisse ist der Kaltplasmatherapie nur bedingt eine Evidenz hinsichtlich der Behandlung von chronischen Wunden zuzuschreiben. Auch wenn für eine abschließende Beurteilung weiterhin hochwertige Studien notwendig sind, kann nach derzeitigem Stand die Kaltplasmatherapie als sichere und additive physikalische Therapie bei Patient:innen mit chronischen Wunden angewendet werden.17,23
Elektrostimulation
Bei der Elektrostimulationstherapie wird der Körper durch von außen angelegte, elektrische Felder gereizt. Diese nutzen die im Körper vorhandenen Ladungsträger, um einen Stromfluss zu erzeugen. Durch elektrische Ströme auf das Wundgebiet können physiologische Prozesse der Wundheilung moduliert werden.27,28 Bei chronischen Wunden liegt eine Störung der Hautkontinuität vor, die zu einer Art „Kurzschluss“ der physiologischen, bioelektrischen Potenziale im entsprechenden Bereich führt. Dies hat in weiterer Folge einen negativen Einfluss auf die sogenannte Galvanotaxis. Bei der Galvanotaxis handelt es sich um eine durch den elektrischen Strom orientierte, aktive Bewegung von Zellen. Durch den galvanotaxischen Effekt wird unter anderem die wundbezogene Migration von neutrophilen Granulozyten, Makrophagen, Mastzellen, Keratinozyten oder Fibroblasten gefördert, die mitunter eine wichtige Rolle beim Wundheilungsprozess spielen. Während die Elektrostimulation die Migration von wundheilungsbezogenen Zellen fördert, können Bakterienmembranen durch jene zerstört werden. Dies führt zu einem antibakteriellen Effekt, der sich wie die gesteuerte Zellmigration positiv auf die Wundheilung auswirken kann. Neben antibakteriellen Eigenschaften können durch die Elektrostimulation auch eine Proliferation der Fibroblasten, Förderung der Angiogenese und eine vermehrte Ausschüttung von Wachstumsfaktoren unterstützt werden.27,28
Klinische Studien konnten bereits neben einer signifikanten Schmerzreduktion29 auch eine verbesserte Wundheilung bei Patient:innen mit chronischem Ulcus cruris durch additive Elektrostimulation aufzeigen.30,31 Dieser wundheilungsfördernde Effekt konnte ebenso bei diabetischen Fußulzera sowie bei Druckulzera beobachtet werden.28,32 Auch wenn die Anzahl der hochqualitativen, klinischen Studien in diesem Gebiet überschaubar ist, wird die Elektrostimulationstherapie als eine sichere und kostengünstige additive Therapiemöglichkeit zum „Stand of Care“ innerhalb der Versorgung von chronischen Wunden eingestuft.27–29,31
Fazit
Aufgrund von fehlendem therapeutischem Goldstandard stellt die Behandlung von chronischen Wunden eine enorme Herausforderung dar. Innovative Behandlungskonzepte bei chronischen Wunden wie zum Beispiel der Einsatz von intelligenten Verbänden, Hautersatzmaterialien, physikalischen Therapiekonzepten wie Kaltplasma oder Elektrotherapie können in der Behandlung bei therapierefraktären chronischen Wunden als sinnvolle (additive) Therapieoption herangezogen werden. Die teilweise hohen Produktpreise sowie die derzeitige spärliche Studienlage stellen jedoch hier gewisse Limitationen dar.
Literatur:
1 Posnett J et al.: The resource impact of wounds on health-care providers in Europe. J Wound Care 2009; 18(4): 154-61 2 Derakhshandeh H et al.: Smart bandages: the future of wound care. Trends Biotechnol 2018; 36(12): 1259-74 3 Milne SD et al.: A wearable wound moisture sensor as an indicator for wound dressing change: an observational study of wound moisture and status. Int Wound J 2016; 13(6): 1309-14 4 Mostafalu P et al.: Wireless flexible smart bandage for continuous monitoring of wound oxygenation. IEEE Trans Biomed Circuits Syst 2015; 9(5): 670-7 5 de Mattos IB et al.: Delivery of antiseptic solutions by a bacterial cellulose wound dressing: uptake, release and antibacterial efficacy of octenidine and povidone-iodine. Burns 2020; 46(4): 918-27 6 de Mattos IB et al.: Uptake of PHMB in a bacterial nanocellulose-based wound dressing: a feasible clinical procedure. Burns 2019; 45(4): 898-904 7 Nischwitz SP et al.: Continuous pH monitoring in wounds using a composite indicator dressing — a feasibility study. Burns 2019; 45(6): 1336-41 8 Hughes OB et al.: A review of cellular and acellular matrix products: indications, techniques, and outcomes. Plast Reconstr Surg 2016; 138(3 Suppl): 138S-47S 9 Dai C et al.: A. Skin substitutes for acute and chronic wound healing : an updated review. J Dermatolog Treat 2020; 31(6): 639-48 10 Ibrahim M et al.: Fish skin grafts versus alternative wound dressings in wound care: a systematic review of the literature. Cureus 2023; 15(3): 1-8 11 Sawad A Bin, Turkistani F: Treatment of venous leg ulcers using bilayered living cellular construct. J Comp Eff Res 2020; 9(13): 907-18 12 Marston WA et al.: Comparative effectiveness of a bilayered living cellular construct and a porcine collagen wound dressing in the treatment of venous leg ulcers. Wound Repair Regen 2014; 22(3): 334-40 13 Domaszewska-Szostek A et al.: Cell-based therapies for chronic wounds tested in clinical studies. Ann Plast Surg 2019; 83(6): e96-109 14 Chen HL et al.: Polylactic acid-based biomaterials in wound healing: a systematic review. Adv Skin Wound Care 2023; doi: 10.1097/ASW.0000000000000011. Online ahead of print 15 Chiu Y-C et al.: The role of pore size on vascularization and tissue remodeling in PEG hydrogels. Biomaterials 2011; 32(26): 6045-51 16 Bružauskaitė I et al.: Scaffolds and cells for tissue regeneration: different scaffold pore sizes—different cell effects. Cytotechnology 2016; 68(3): 355-69 17 Dubey SK et al.: Cold atmospheric plasma therapy in wound healing. Process Biochem 2022; 112: 112-23 18 Guo J et al.: Efficacy of cold atmospheric plasma therapy on chronic wounds: an updated systematic review and meta-analysis of RCTs. Comput Math Methods Med 2022; 2022 19 Haertel B et al.: Non-thermal atmospheric-pressure plasma possible application in wound healing. Biomol Ther (Seoul) 2014; 22(6): 477-90 20 Isbary G et al.: Successful and safe use of 2 min cold atmospheric argon plasma in chronic wounds: results of a randomized controlled trial. Br J Dermatol 2012; 167(2): 404-10 21 Brehmer F et al.: Alleviation of chronic venous leg ulcers with a hand-held dielectric barrier discharge plasma generator (PlasmaDerm® VU-2010): results of a monocentric, two-armed, open, prospective, randomized and controlled trial (NCT01415622). J Eur Acad Dermatology Venereol 2015; 29(1): 148-55 22 Samsavar S et al.: The evaluation of efficacy of atmospheric pressure plasma in diabetic ulcers healing: a randomized clinical trial. Dermatol Ther 2021; 34(6): e15169 23 Assadian O et al.: Effects and safety of atmospheric low-temperature plasma on bacterial reduction in chronic wounds and wound size reduction: a systematic review and meta-analysis. Int Wound J 2019; 16(1): 103-11 24 Stratmann B et al.: Effect of cold atmospheric plasma therapy vs standard therapy placebo on wound healing in patients with diabetic foot ulcers. JAMA Netw Open 2020; 3(7): e2010411 25 Mirpour S et al.: Cold atmospheric plasma as an effective method to treat diabetic foot ulcers: a randomized clinical trial. Sci Rep 2020; 10(1): 10440 26 Strohal R et al.: Chronic wounds treated with cold atmospheric plasmajet versus best practice wound dressings: a multicenter, randomized, non-inferiority trial. Sci Rep 2022; 12(1): 3645 27 Palmieri B et al.: Electromedical devices in wound healing management: a narrative review. J Wound Care 2020; 29(7): 408-18 28 Melotto G et al.: The effects of electrical stimulation on diabetic ulcers of foot and lower limb: a systematic review. Int Wound J 2022; 19(7): 1911-33 29 Leloup P et al.: The analgesic effect of electrostimulation (WoundEL®) in the treatment of leg ulcers. Int Wound J 2015; 12(6): 706-9 30 Ojeh N et al.: Feasibility of an electrostimulation system treatment for wound healing: A case series of patients with chronic ulcers in Barbados. Int Wound J 2016; 13(6): 1180-9 31 Borges D et al.: The effect of wound electrical stimulation in venous leg ulcer healing-a systematic review. J Vasc Surg Venous Lymphat Disord 2023; 11(5): 1070-9.e1 32 Polak A et al.: Reduction of pressure ulcer size with high-voltage pulsed current and high-frequency ultrasound: a randomised trial. J Wound Care 2016; 25(12): 742-54
Das könnte Sie auch interessieren:
„Ich habe den schönsten Beruf der Welt“
Mit dem diesjährigen Jahreskongress der Österreichischen Gesellschaft für Plastische, Ästhetische und Rekonstruktive Chirurgie (ÖGPÄRC) in Salzburg hat Prim. Univ.-Doz. Dr. Rupert Koller ...
Aktuelle Versorgungssituation von trans Männern
Die Versorgung von trans Personen ist in Österreich auf wenige Kliniken und Fachabteilungen beschränkt. Noch immer bestehen Ressentiments und die Patientengruppe wird in ...
Funktionell-ästhetische Nagelchirurgie
Die Entwicklung der Nagelchirurgie ist im Vergleich zu anderen chirurgischen Disziplinen noch wenig weit fortgeschritten. Dennoch stehen verschiedene Methoden sowohl zur Diagnosestellung ...