Chirurgische Therapie des Lymphödems
Autoren:
Dr. Tonatiuh Flores1, 2
Dr. Konstantin D. Bergmeister1, 2
Dr. Anton Staudenherz1, 3
Prim. Priv.-Doz. Dr. Karin Pieber1, 4
Prim. Assoc. Prof. Dr. Klaus F. Schrögendorfer1, 2
1 Karl-Landsteiner-Privatuniversität für Gesundheitswissenschaften, Krems
2 Klinische Abteilung für Plastische, Ästhetische und Rekonstruktive Chirurgie, Universitätsklinikum St. Pölten
3 Klinisches Institut für Nuklearmedizin, molekulare Bildgebung und spezielle Endokrinologie, Universitätsklinikum St. Pölten
4 Klinisches Institut für Physikalische Medizin und Rehabilitation, Universitätsklinikum St. Pölten
Korrespondierender Autor:
Dr. Tonatiuh Flores
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das sekundäre Lymphödem, meist als Folge onkologischer Eingriffe, ist eine große Belastung für Patienten. Mittels modernster Operationstechniken und fortschrittlicher Diagnostik kann das Lymphödem erfolgreich verbessert und die Lebensqualität von Patienten wiederhergestellt werden.
Keypoints
-
Die häufigste Ursache für sekundäre Lymphödeme in Industriestaaten sind Krebstherapien, insbesondere nach Brustkrebs.
-
Die chirurgische Therapie des Lymphödems sollte immer an die konservative Therapie gebunden sein.
-
Lymphvenöse Anastomosen und freie vaskularisierte Lymphknotenlappen können das Lymphödem der entsprechenden Extremität erfolgreich reduzieren.
Das Lymphsystem besteht aus lymphatischen Organen und dem Lymphgefäßsystem, verläuft parallel zu den Arterien und Venen des Körpers und ist von Lymphknoten zwischengeschaltet. Zusätzlich dient es dem Transport von Flüssigkeit und Lipiden. Ist die Homöostase zwischen Bildung und Abtransport lymphatischer Flüssigkeit gestört, verbleibt vermehrt Lymphe im Interstitium und ein Lymphödem resultiert. Bei längerem Fortbestehen führt dies zu chronischen Schwellungen und Entzündungsreaktionen, der Ablagerung von Fettzellen und letztendlich zu irreversiblen fibrotischen Umbauprozessen.
Das primäre Lymphödem stellt eine sehr seltene Krankheitsform dar. Meist kommt es hierbei, bedingt durch Entwicklungsstörungen, zu einer Unterentwicklung, einem partiellen Fehlen oder einer fehlerhaften Ausbildung von Lymphgefäßen (ein komplettes Fehlen von Lymphgefäßen ist nicht mit dem Leben vereinbar).1 Das sekundäre Lymphödem ist die häufigste Form des Lymphödems. Es tritt als Ergebnis direkten oder indirekten Schadens auf. Häufige Ursachen für das sekundäre Lymphödem in Industrieländern sind Infektionen, Traumata, die chronische venöse Insuffizienz, Übergewicht oder iatrogene Ursachen, insbesondere nach Krebstherapien. Die Entfernung oder Bestrahlung der Lymphabflusswege, aber auch Chemotherapien in der Therapie des Mammakarzinoms sind dabei die häufigste Ursache für sekundäre Lymphödeme.2,3
Einteilung
Die genaue Zahl primärer und sekundärer Lymphödeme ist unklar, da sich die Häufigkeiten weltweit stark unterscheiden. Das primäre Lymphödem kommt mit einer Häufigkeit von 1:100000 vor und ist stärker präsent in Entwicklungsländern.4 Frauen sind ca. 4,5- bis 6,1-mal öfter betroffen als Männer.5 Etwa 30% der primären Lymphödeme liegt eine genetische Erkrankung zugrunde (zumeist ist das VEGF-Gen davon betroffen).1
Die Gesamtinzidenz des sekundären Lymphödems wird auf 0,13–2% geschätzt.6 Obwohl sich die Radikalität der Tumorchirurgie in den letzten Jahren bei gleichbleibender onkologischer Sicherheit reduzierte, liegt die Inzidenz sekundärer Lymphödeme innerhalb von 12–24 Monaten nach axillärer Lymphknotenentfernung bei Mammakarzinom noch immer bei ca. 19,9%.7–9
Die Stadien des Lymphödems können nach verschiedenen Klassifikationen eingeteilt werden. Die geläufigste Einteilung ist die der International Society of Lymphology (Stadien 0–3).1
Das Intervallstadium oder auch latentes Stadium (Stadium 0) beschreibt einen subklinischen Verlauf. Das Lymphsystem ist hierbei zwar geschädigt, allerdings ist der Abtransport von Flüssigkeit noch regelrecht. Es tritt somit keine Schwellung auf. In Stadium I ist eine Schwellung bereits manifest, jedoch reversibel. Hier treten noch keine Gewebsveränderungen auf. Das Ödem ist weich und auf Druck verbleibt eine sichtbare Delle. Patienten in diesem Stadium profitieren sehr von einem konservativen Schema.
Das Lymphödem in Stadium II ist durch Hochlagern nicht mehr reversibel. Auf Druck verbleibt hier keine Delle mehr, da bereits ein fibrotischer Umbau des Unterhautgewebes begonnen hat. Bei konservativer Therapieresistenz ist hierbei bereits eine chirurgische Intervention indiziert. Das Stadium III beschreibt bereits den Zustand der Elephantiasis. Die betroffene Extremität ist stark geschwollen und betroffene Patienten sind in der Bewegung stark eingeschränkt. Fibrotische und adipöse Ablagerungen können zu einer gestörten Blutversorgung der Haut führen.
Diagnostik
Durch die in der Basisdiagnostik erhobenen Befunde kann (sofern keinerlei Komorbiditäten vorliegen und sich das Lymphödem im Stadium I oder höher befindet) die Diagnose gestellt werden. Bei Komorbiditäten (insbesondere Krebserkrankungen), dem Vorliegen eines Frühstadiums, der Planung einer chirurgischen Intervention oder initial uneindeutiger Befundung ist jedoch eine bildgebende Diagnostik zusätzlich notwendig.
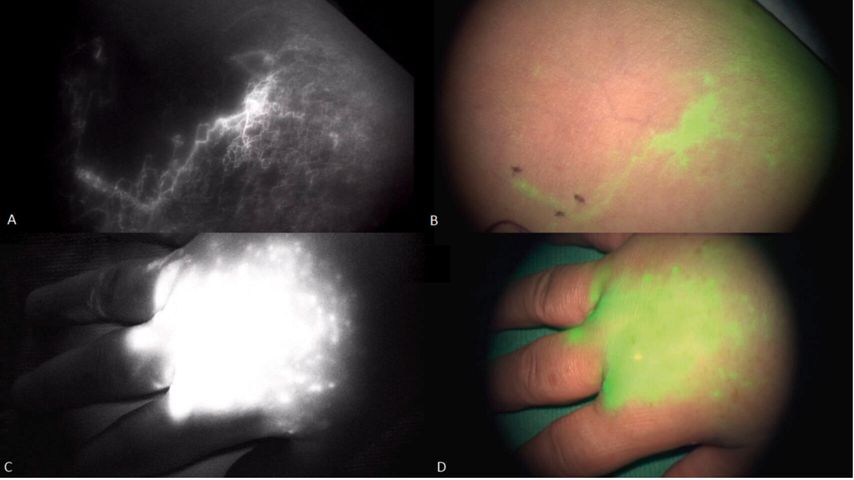
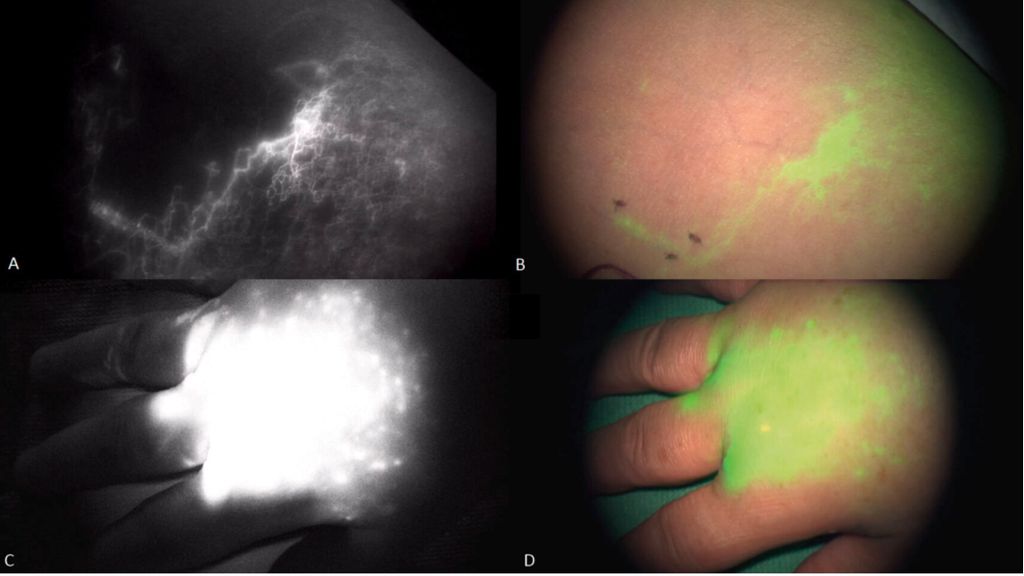
Den Goldstandard der bildgebenden Diagnostik zur Detektion eines Lymphödems stellt die Lymphszintigrafie dar. Sie ermöglicht eine morphologische Darstellung der oberflächlichen oder tiefen Lymphgefäße und auch der Lymphknoten. Zusätzlich dient die Indocyaningrün(ICG)-Fluoreszenz-Lymphangiografie zur Echtzeiterfassung von ausschließlich oberflächlichen Lymphgefäßen. Ist der Lymphabfluss gestört, erfolgt die Verteilung von ICG als diffuser „Backflow“ über die Haut (Abb. 1).
Abb. 1: Lymphgefäßdarstellung des Unterarms via ICG-Angiografie: A: Infrarotaufnahme (ICG) eines normalen Lymphgefäßes (in Weiß dargestellt), B: Nativaufnahme desselben Gefäßes mit ICG-Überlagerung (in Grün dargestellt), C: Infrarotaufnahme (ICG) eines dermalen Backflows bei insuffizientem lymphatischem Abstrom und Rückstau über die Haut in Stadium II des Lymphödems (weiße Wolke), D: Nativaufnahme desselben dermalen Backflows mit ICG-Überlagerung (grüne Wolke)
Therapie
Prinzipiell sollte bei Patienten mit hohem Risiko für ein Lymphödem immer eine Primärprävention etabliert werden, um das Entstehen zu verhindern. Ebenso soll das Fortschreiten des Lymphödems verhindert werden. Bei einem manifesten Ödem erfolgt die Basistherapie des Lymphödems immer konservativ und wird bei Bedarf um chirurgische Maßnahmen erweitert. Die Art und die Möglichkeit der Therapie richten sich nach dem Stadium des Befundes sowie nach der Komorbidität der Patienten (insbesondere Krebserkrankungen).
Konservative Therapie
Die konservative Therapie des Lymphödems zielt auf eine Reduktion der interstitiellen Flüssigkeit ab. Hierfür wurde die komplexe physikalische Entstauungstherapie (KPE) entwickelt, welche sich aus mehreren unterschiedlichen Therapien zusammensetzen. Diese beinhaltet die manuelle Lymphdrainage, die Kompressionstherapie (Entstauungsphase [PhaseI] und Erhaltungsphase [Phase II]) sowie gezielte körperliche Übungen, Hautpflege und falls erforderlich Hautsanierung sowie Aufklärung und Schulung zur Selbsttherapie.10
Chirurgische Therapien
Die chirurgische Therapie erfolgt nach konservativem Therapieversuch und ist immer an die begleitende konservative Therapie gebunden. Die Art der Operation richtet sich hierbei immer nach dem Verlauf, dem Stadium und der Lokalisation des Lymphödems. Generell zeigen sekundäre Lymphödeme ein besseres Ansprechen auf chirurgische Verfahren als primäre Erscheinungsformen.
Bei den plastisch-chirurgischen Verfahren zur Behandlung des Lymphödems werden zwei Gruppen unterschieden:
-
reduktive Verfahren, dazu zählen direkte Exzision und Liposuktion, und
-
physiologisch-rekonstruktive Verfahren, dazu zählen Lymphbypass mit Lymphgefäßtransfer, lymphovenöse Anastomosen (LVA) und die freie Transplantation von Lymphknoten („vascularized lymh node transfer“, VLNT).
Prinzipiell wird vom Seniorautor immer eine physiologische Rekonstruktion empfohlen und angestrebt. Die Liposuktion kann durch deutliche Verringerung des fibrosierten Fettgewebes als Vorbereitung auf eine physiologische Rekonstruktion mittels freien Lymphknotentransfers eingesetzt werden oder im Stadium III zur Gewichtsentlastung der betroffenen Extremität und leichteren Kompressionsbestrumpfung verhelfen.
Direkte Exzision
Das direkte Entfernen betroffenen Gewebes, auch Charles-Verfahren genannt, wurde erstmals 1912 beschrieben. Es beschreibt die radikale, zirkuläre epifasziale Exzision von Haut und Unterhautgewebe, gefolgt von einer Hauttransplantation. Diese Technik ist äußerst schwerwiegenden Fällen des Lymphödems vorbehalten und wird heutzutage kaum angewendet.2 Trotz erfolgreicher Reduktion des Lymphödems geht diese Technik mit schlechten ästhetischen Ergebnissen einher.
Liposuktion
Die Liposuktion oder Fettabsaugung dient der Volumsverringerung bei der betroffenen Extremität und stellt keine spezifische Therapie in der Lymphödemchirurgie dar. Jedoch kann bei Umwandlungen des Unterhautgewebes, die bereits stattgefunden haben, die Liposuktion die Veränderungen reduzieren und als Vorbereitung auf physiologisch-rekonstruktive Verfahren dienen (Abb. 2A, B).
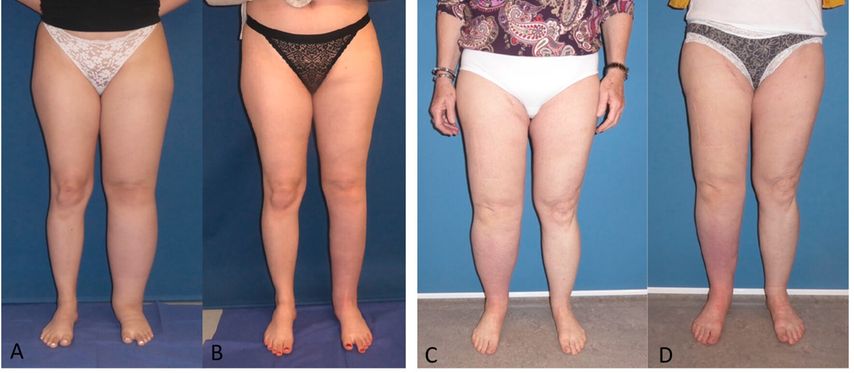
Abb. 2: Idiopathisches Lymphödem der linken unteren Extremität einer 19-jährigen Frau vor (A) und 12 Monate nach (B) Volumsreduktion mittels Liposuktion. Lymphödem nach Uteruskarzinom mit Lymphknotendissektion der rechten unteren Extremität bei einer 62-jährigen Frau vor (C) und 12 Monate nach (D) freiem Lymphknotentransfer auf einen Ast der A. tibialis posterior
Lymphovenöse Anastomose
Eine Form der physiologischen Rekonstruktion bei Lymphödemen stellt die Anastomose (chirurgische Verbindung) von Lymphgefäßen an Venen dar. Durch diese Verbindung kann die Lymphe früher und schneller in das venöse System abfließen.11 Die Hauptindikation zur Anlage einer lymphovenösen Anastomose (LVA), ist das obstruktive Lymphödem.
Zur präoperativen Planung der Anastomosenstellen wird ICG subkutan appliziert. Durch die Darstellung mittels Infrarotkamera werden ungestörte Lymphgefäße als klare Linien sowie Stellen mit gestörtem Abfluss als Wolke oder Stern (wegen eines Rückflusses über die Haut) dargestellt (Abb. 1). Sowohl das primäre als auch das sekundäre Lymphödem profitieren von diesem Bypasseingriff.
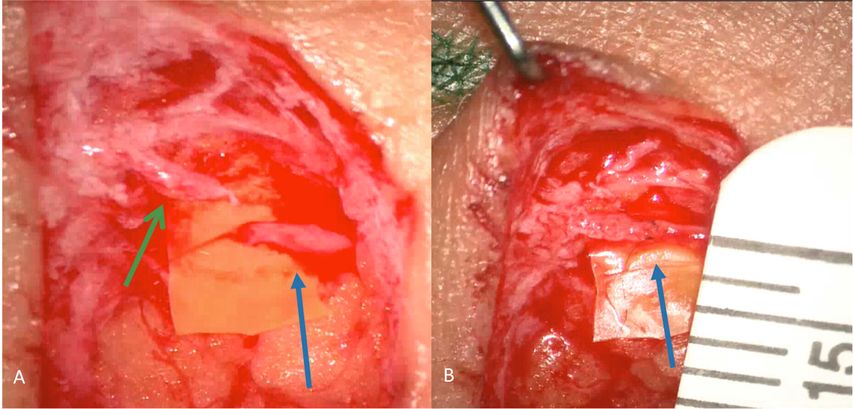
Zu Beginn des Eingriffes wird an den vorher mit ICG bestimmten Anastomosenstellen ein ca. 2–3cm langer, quer verlaufender Schnitt gesetzt. Das präoperativ angefärbte Lymphgefäß wird aufgesucht, mit Mikroinstrumentarium freipräpariert und abgesetzt. Anschließend wird eine kaliberstarke Hautvene präpariert, abgesetzt (Abb. 3A) und mit einer Fadenstärke von 11–0 (geringerer Durchmesser als das menschliche Haar), End-zu-End- oder End-zu-Seit-anastomosiert (Abb. 3B).12,13 Die Dichte und der erwünschte ungestörte Abfluss werden erneut mit ICG überprüft.
Abb. 3: A: Präparation des Lymphgefäßes (grüner Pfeil, Größe ca. 0,5mm) und der Vene (blauer Pfeil, Größe ca. 0,5mm), B: Anlage der lymphovenösen End-zu-End-Anastomose (blauer Pfeil). Lineal zum Größenvergleich
Vaskularisierter Lymphknotentransfer (freie Lappenplastik)
Diese Operationstechnik kommt ab Stadium II oder höher zum Einsatz, wenn eine totale Okklusion des Lymphsystems, eine partielle Okklusion mit frustraner konservativer Therapie oder rezidivierende Cellulitiden vorliegen.14
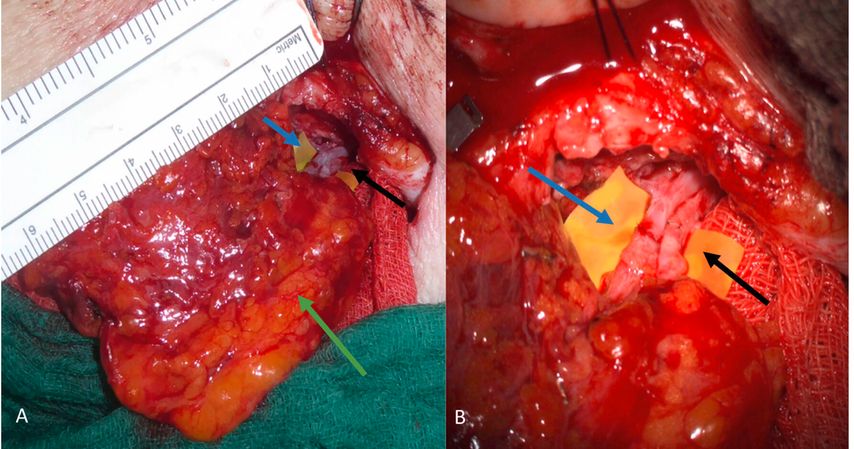
Freie mikrochirurgisch transferierte Lymphknotentransfers sind Lymphknotenkonvolute, welche in umliegendem Fettgewebe eingebettet als Lymphknotenlappen transplantiert werden. Dabei werden nur Arterien und Venen vernäht, nicht jedoch Lymphgefäße (Abb. 4). Diese führen am Transplantationsort zu einer erhöhten Drainage der umliegenden interstitiellen Flüssigkeit, welche sie dem angeschlossenem Venensystem zuführen.15 Transferierte Lymphknoten wirken somit als Pumpe und unterstützen den Abtransport von Lymphflüssigkeit aus dem umliegenden Gewebe. Je nach Empfängerstelle kann es notwendig sein, den Hautmantel des Lymphknotenlappens zur Integumenterweiterung mitzutransferieren. Dies ist z.B. am Handgelenk oder Knöchel notwendig. An Lokalisationen mit mehr Weichteilmantel kann der Lymphknotenlappen entweder vollständig eingebracht oder auch mit Spalthaut bedeckt werden. Dadurch trägt der Lappen nicht auf und die Kontur der Extremität kann beibehalten werden (Abb. 2C, D).
Abb. 4: A: Vaskularisierter Lymphknotenlappen (grüner Pfeil) vor dem Einnähen ins Empfängerbett. Im Hintergrund sind die arterielle (schwarzer Pfeil) und venöse Anastomose (blauer Pfeil) sichtbar. B: Arterieller (schwarzer Pfeil) und venöser Anschluss (blauer Pfeil) des VLNT
An den Empfängerstellen produzieren freie Lymphknotenlappen VEGF, welches zur Lymphangiogenese und folglich zur Verbindung von lymphatischen Bahnen mit dem Lymphknotenlappen führt. Bei der Transplantation von freien Lymphknotenpaketen ist postoperativ ein engmaschiges Monitoring indiziert, um die Durchblutung bis zum sicheren Einheilen zu überwachen. In den ersten postoperativen Tagen ist eine eingeschränkte Bettruhe erforderlich und die entsprechende Extremität sollte hoch- bzw. auf Herzhöhe gelagert werden.
Postoperatives Management
Eine manuelle Lymphdrainage sollte, wenn möglich täglich, ab dem ersten postoperativen Tag im stationären Bereich erfolgen. Nach der Entlassung sollte eine Lymphdrainage alle 2 Tage für die ersten 6 Wochen durchgeführt werden. Danach muss diese für weitere 3 Monate 2-mal wöchentlich erfolgen. Postoperativ sollte eine mäßige Kompression der entsprechenden Extremität mit Kurzzugbandagen, mit nicht zu starkem Zug außerhalb der komplexen physikalischen Entstauungstherapie (KPE), etabliert werden und Patienten sollten nach der Entlassung mit Flachstrick-Kompressionswäsche Klasse II nach Maß versorgt werden. Zwölf Monate nach dem Eingriff kann ein sukzessives Entwöhnen von der Kompressionswäsche erfolgen.
Conclusio
Das Lymphödem ist nicht selten eine Folge nach onkologischen Therapien im Kopf-Hals-Bereich, im gynäkologischen Bereich (Brust, Ovarien, Uterus), aber auch nach Prostatakarzinomen. Vor allem onkologische Eingriffe am Lymphsystem in Kombination mit Strahlentherapie können bei einer signifikanten Anzahl an Patienten zu Lymphödemen führen. Durch moderne Ansätze in der Diagnostik kann das Lymphödem frühzeitig erkannt und als Basistherapie konservativ durch eine KPE oft verbessert werden. Ab Stadium I sollte jedoch die Vorstellung an einer auf die Behandlung von Lymphödemen spezialisierten plastisch-rekonstruktiven Abteilung erfolgen, um eventuell notwendige physiologische mikrochirurgische Rekonstruktionen rechtzeitig in der umfassenden therapeutischen Versorgung der Patienten einzuplanen. Diese führen bei meist kurzen stationären Aufenthalten und hoher Erfolgsrate zur deutlichen Besserung der Beschwerdesymptomatik. Eine frühzeitige Absprache mit den zusammenarbeitenden Abteilungen (z.B. physikalische Medizin, Nuklearmedizin) und eine zeitgerechte Planung der postoperativen Therapiemaßnahmen sind wichtige Voraussetzungen für eine optimale interdisziplinäre Behandlung der Patienten.
Literatur:
1 Greene AK et al.: Lymphedema - presentation, diagnosis, and treatment. Berlin, Heidelberg, New York: Springer 2015; p. 353 2 Cheng MH et al.: Principles and practice of lymphedema surgery. Amsterdam: Elsevier Inc. 2016; p. 240 3 Szpalski C et al.: Treatment of upper extremity lymphedema following chemotherapy and radiation for head and neck cancer. Plast Reconstr Surg Glob Open 2020 8(3): e2672 4 Rockson SG et al.: Estimating the population burden of lymphedema. Ann N Y Acad Sci 2008; 1131: 147-54 5 Brunner U: Klinische Diagnostik des primären Lymphödems der Beine. Swiss Med 1981; 3: 59-64 6 Moffatt CJ et al.: Lymphoedema: an underestimated health problem. QJM 2003; 96(10): 731-8 7 Cormier JN et al.: Lymphedema beyond breast cancer: a systematic review and meta-analysis of cancer-related secondary lymphedema. Cancer 2010; 116(22): 5138-49 8 DiSipio T et al.: Incidence of unilateral arm lymphoedema after breast cancer: a systematic review and meta-analysis. Lancet Oncol 2013; 14(6): 500-15 9 McLaughlin SA et al.: Prevalence of lymphedema in women with breast cancer 5 years after sentinel lymph node biopsy or axillary dissection: patient perceptions and precautionary behaviors. J Clin Oncol 2008; 26(32): 5220-6 10 AWMF: S2k-Leitlinie Diagnostik und Therapie der Lymphödeme. AWMF online, May 2017, Reg.-Nr. 058-001: p. 92; www.awmf.org (letzter Zugriff: 10.11.2021) 11 Chang EI et al.: Evolution in surgical management of breast cancer-related lymphedema: the MD Anderson Cancer Center Experience. Plast Reconstr Surg Glob Open 2020 8(3): e2674 12 Campisi C, Boccardo F: Frontiers in lymphatic microsurgery. Microsurgery 1998 18(8): 462- 71 13 Campisi CC et al.: A single-site technique of multiple lymphatic-venous anastomoses for the treatment of peripheral lymphedema: long-term clinical outcome. J Reconstr Microsurg 2016; 32(1): 42-9 14 Chang EI et al.: Comprehensive overview of available donor sites for vascularized lymph node transfer. Plast Reconstr Surg Glob Open 2020 8(3): e2675 15 Cheng MH et al.: Vascularized groin lymph node flap transfer for postmastectomy upper limb lymphedema: flap anatomy, recipient sites, and outcomes. Plast Reconstr Surg 2013 131(6): 1286-98
Das könnte Sie auch interessieren:
„Ich habe den schönsten Beruf der Welt“
Mit dem diesjährigen Jahreskongress der Österreichischen Gesellschaft für Plastische, Ästhetische und Rekonstruktive Chirurgie (ÖGPÄRC) in Salzburg hat Prim. Univ.-Doz. Dr. Rupert Koller ...
Minimalinvasive Gesichtsrejuvenation
Die minimalinvasive Gesichtsverjüngung hat sich in den vergangenen Jahren rasant entwickelt. Patienten wünschen sich zunehmend effektive, aber zugleich schonende Methoden, die ohne ...
Neue Wege in der Versorgung grosser Wunden im Kalottenbereich
Grosse Defekte im Bereich der Kopfhaut können dank gesteuerter Geweberegeneration mittels alloplastischer, resorbierbarer Matrix mit dem GREAT-Konzept (Guided Tissue REgeneration by ...