Mehr kardiovaskuläre Ereignisse und Malignome?
Bericht: Ines Schulz-Hanke
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Mit Tofacitinib, einem Strukturanalogon von ATP, wurde 2013 erstmals ein Januskinase-Inhibitor (JAKi) in der Schweiz zugelassen. Die Vertreter dieser Medikamentenklasse haben sich gut eingeführt. Allerdings gab es immer wieder Hinweise darauf, dass die Therapie mit vermehrten kardiovaskulären Ereignissen und einem erhöhten Malignomrisiko einhergehen könnte. Wie sich die Puzzleteile der wissenschaftlichen Evidenz zusammenfügen.
JAKi binden an die intrazellulär liegenden Rezeptoren der Januskinasen, erklärte Prof. Dr. med. Diego Kyburz, Basel. Anders als Biologika verhindern sie damit nicht die Zytokinbindung am Rezeptor, sondern die intrazelluläre Signalübertragung, die nach dieser Bindung normalerweise einsetzt.1 Zur Januskinasen-Familie gehören JAK1 bis 3 sowie die Tyrosinkinase (TYK) 2. Sie können in verschiedenen Kombinationen am intrazellulären Teil von Zytokinrezeptoren binden. JAK1 spielt in der Steuerung der meisten der Zytokine eine Rolle, JAK2 kann auch an Nicht-Zytokin-Rezeptoren binden, beispielsweise an jene für Wachstumsfaktoren wie Erythropoetin, GM-CSF und G-CSF.2
Eine Erfolgsgeschichte mit breiter Wirkung
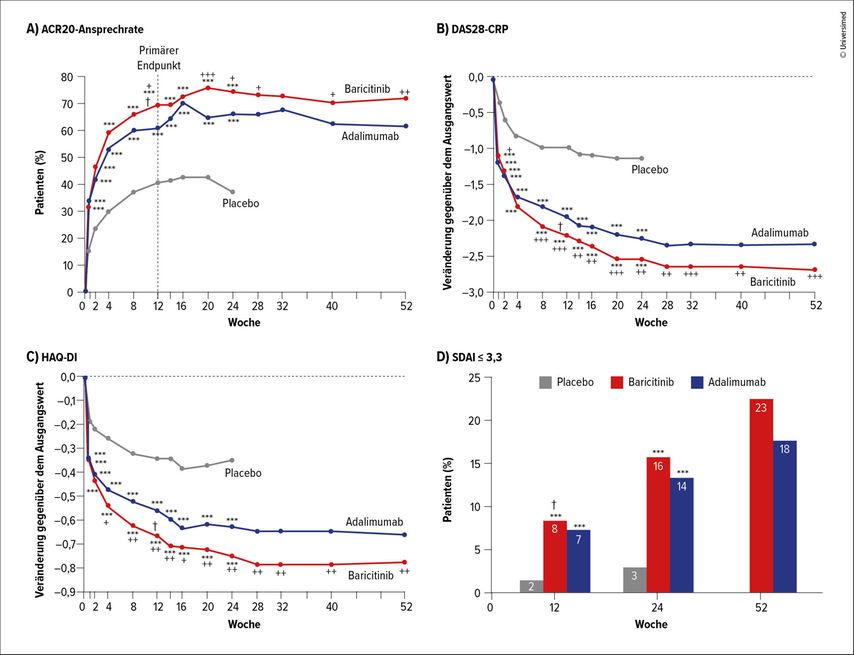
Januskinase-Inhibitoren wie Tofacitinib, Baricitinib oder Upadacitinib hemmen JAK1 bis 3 sowie TYK2 unterschiedlich stark.3 Insgesamt jedoch wirkten JAKi nicht nur ebenso gut wie eine Vergleichstherapie mit Biologika, erklärte Kyburz. Vielmehr habe sich für Baricitinib bei rheumatoider Arthritis (RA) ein signifikant besseres ACR20-Ansprechen und eine stärkere DAS28-CRP-Reduktion zeigen lassen als für den TNF-Blocker Adalimumab.4 Upadacitinib erzielte bei csDMARD-resistenten RA-Patient:innen ein besseres ACR20/50-Ansprechen, eine höhere DAS28-CRP-Reduktion und auch eine geringere klinische Krankheitsaktivität (CDAI≤10) als Placebo oder Adalimumab.5 Auch bei weiteren Indikationen haben sich JAKi bewährt, etwa Tofacitinib, das sich bei Psoriasisarthritis (PsA) als ähnlich wirksam wie Adalimumab erwies.6
Die 3 JAKi Tofacitinib, Baricitinib und Upadacitinib sind in der Schweiz für verschiedene Indikationen zugelassen.
-
RA: Tofacitinib, Baricitinib und Upadacitinib
-
PsA: Tofacitinib und Upadacitinib
-
ankylosierende Spondylitis: Tofacitinib und Upadacitinib
-
Colitis ulcerosa: Tofacitinib und Upadacitinib
-
Morbus Crohn: Upadacitinib
-
Riesenzellarteriitis: Upadacitinib (neu)
Mehr kardiovaskuläre Komplikationen und Malignome?
Auf Verlangen der Food and Drug Administration (FDA) wurde 2021 eine Sicherheitsstudie bei Patient:innen mit aktiver RA unter Methotrexat (MTX) durchgeführt. Diese ORAL Surveillance Study sollte zeigen, ob eine Therapie mit Tofacitinib das Risiko für kardiovaskuläre Ereignisse und/oder Malignome erhöht. Die Studie verglich 5 und 10mg Tofacitinib mit einem TNFi. Die Teilnehmenden mussten ≥50 Jahre alt sein und mindestens einen kardiovaskulären Risikofaktor aufweisen. Tatsächlich waren über 50% Jemals-Raucher, 66% hatten eine arterielle Hypertonie, 17% Diabetes und 11% eine koronare Herzkrankheit. Es handelte sich also um eine Population, in der kardiovaskuläre Ereignisse verstärkt auftreten.7,8
Es zeigte sich, dass in der mit JAKi behandelten Gruppe mehr MACE (kardiovaskulärer Tod, nicht fataler MI oder Schlaganfall) eintraten als in der mit dem TNFi behandelten. Die Hazard-Ratio (HR) lag bei 1,24 für 5mg Tofacitinib und bei 1,43 für 10mg. Die Nichtunterlegenheit von Tofacitinib gegenüber dem TNFi wurde statistisch nicht erreicht. Die Number Needed to Harm (NNH), also die Zahl der Patient:innen, die über ein Jahr 5mg Tofacitinib erhalten müsste, um verglichen mit einem TNFi eine zusätzliche schwerwiegende kardiovaskuläre Komplikation auszulösen, lag bei 567, für 10mg bei 319.
Die Studie zeigte zudem ein (teilweise statistisch signifikant) erhöhtes Malignomrisiko unter JAKi. Die HR lagen hier bei 1,47 für 5mg Tofacitinib und bei 1,48 für 10mg verglichen mit einem TNFi. Auch bezüglich des Malignomrisikos wurde also die prädefinierte Schwelle für Nichtunterlegenheit nicht erreicht. Klinisch müssten 276 Patient:innen für ein Jahr mit einem JAKi behandelt werden, um einen zusätzlichen Malignomfall auszulösen.
Abb. 1: A) Prozentsatz der Patienten, die gemäss den Kriterien des American College of Rheumatology (ACR20-Ansprechen) eine 20-prozentige Verbesserung aufwiesen. B) Veränderung des 28-Gelenk-Krankheitsaktivitäts-Scores (DAS28-CRP). C) LSM-Veränderung im «Health Assessment Questionnaire-Disability Index»(HAQ-DI)-Score, Verbesserung bei negativen Werten gegenüber dem Ausgangswert. D) Prozentsatz der Patienten mit einem «Simplified Disease Activity Index»(SDAI)-Score von 3,3 oder weniger (höhere Werte entsprechen grösserer Krankheitsaktivität, Werte ≤3,3 einer Remission)4
Individuelle Risikofaktoren
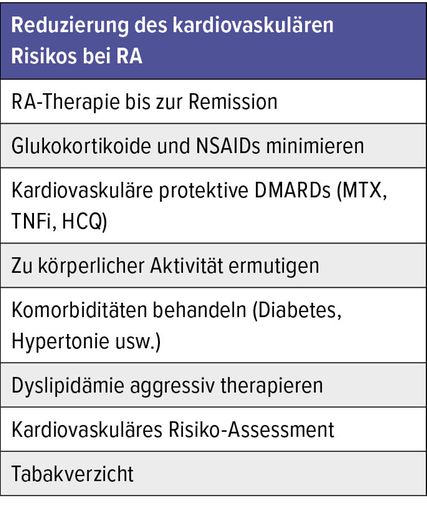
Tab. 1: Eine adäquate Kontrolle der Grunderkrankung und kardiovaskulärer Risikofaktoren reduziert das kardiovaskuläre Risiko bei RA16
Wesentliche Risikofaktoren für kardiovaskuläre Ereignisse und Malignome unter Tofacitinib sind ein Alter >65 Jahre und früheres oder gegenwärtiges Rauchen. Konkret ging die Hazard-Ratio für MACE bei isolierter Betrachtung der ≤65-Jährigen unter Tofacitinib vs. TNFi auf 1,1 zurück und erreichte in der Gruppe der >65-Jährigen 1,79. Ohne Tabakkonsum betrug die HR für ein MACE 1,02, das Risiko war dann unter JAKi und TNFi gleich hoch. Bei aktuellem Tabakkonsum erreichte die HR 1,20, bei früherem 2,17.
Die Hazard-Ratio für ein Malignom erreichte bei ≤65-Jährigen 1,36 und bei Älteren 1,70. Die HR für ein Malignom lag in Abhängigkeit vom Tabakkonsum bei 1,03 (nie), 1,62 (gegenwärtig) und 1,90 (früher). Diese Parameter spielten also eine entscheidende Rolle für ein erhöhtes Risiko unter Tofacitinib.8,9
Die «Tiefrisiko-Population»
Dies seien Menschen, die ≤65 Jahre alt sind und nie geraucht haben, so Kyburz. Bei ihnen sei weder das Malignitäts- noch das MACE-Risiko unter Tofacitinib höher als unter TNFi-Therapie. Im zeitlichen Verlauf stieg in der Gesamtpopulation der ORAL-Surveillance-Studie nach etwa 3 Jahren das Malignomrisiko unter Tofacitinib verglichen mit TNFi, in der Hochrisikopopulation schon nach etwas weniger als 1,5 Jahren. In der Low-Risk-Population wichen die Kurven nicht auseinander, in dieser Population entwickle sich auch kein Zusatzrisiko im zeitlichen Verlauf.9
Und was passiert im echten Leben?
Dass sich das Malignomrisiko bei Menschen mit RA unter einer JAKi-Therapie nicht von jenem unter einer TNFi- oder Nicht-TNFi-Biologika-Therapie unterscheidet, zeigen auch Krebsregister- und Mortalitätsdaten aus Schweden, die eine lange Beobachtungszeit und grosse Kollektive abdecken.10 Dies deckt sich mit der Datenanalyse aus dem internationalen JAK-pot- Register, die je knapp 13000 klinisch passende RA-Patientinnen und -Patienten unter TNFi- bzw. JAKi-Therapie verglich.11 Sowohl in der Gesamtpopulation als auch in der Subgruppe der Hochrisikopatientinnen und -patienten, die denen der ORAL-Surveillance-Studie ähnelten, zeigte sich hier kein signifikant erhöhtes Malignomrisiko in dieser grossen Real-World-Studie. Auch für MACE bildete sich kein erhöhtes Risiko ab. Die Real-World-Daten belegten also verglichen mit TNFi kein JAKi-assoziiertes signifikant erhöhtes Risiko für kardiovaskuläre Ereignisse und Malignome. In einer Netzwerkmetaanalyse über 62 randomisierte kontrollierte Studien und 16 Verlängerungsstudien schienen JAKi (30% Tofacitinib) die Malignominzidenz verglichen mit TNFi zu erhöhen. Hier waren 82000 Patient:innen mit RA, PsA, Psoriasis, axialer Spondyloarthritis, chronisch entzündlicher Darmerkrankung oder atopischer Dermatitis entweder mit einem JAKi oder TNFi behandelt worden.12 Doch sei dieser Effekt vor allem durch die ORAL-Surveillance-Studie getrieben, erklärte Kyburz.9 Verglichen mit Placebo oder MTX war das Malignomrisiko unter JAKi allerdings nicht erhöht. TNFi verminderten in dieser Metaanalyse das Malignomrisiko gegenüber Placebo. Möglicherweise sei also das erhöhte Malignomrisiko, das sich in der ORAL-Surveillance-Studie zeigte, darauf zurückzuführen, dass TNFi das Risiko reduziert, gab Kyburz zu bedenken.
Die therapeutische Bedeutung der JAKi bei RA
Den geltenden EULAR-Empfehlungen für die rheumatoide Arthritis zufolge wird eine Biologikatherapie für RA-Patient:innen empfohlen, die unzureichend auf MTX angesprochen haben. Eine JAKi-Therapie kann erwogen werden, jedoch nur nach einem Risiko-Assessment, das die in der ORAL-Surveillance-Studie festgestellten klinischen Risikofaktoren Alter >65 Jahre und früheren oder aktuellen Tabakkonsum berücksichtigt sowie weitere Faktoren, die das Risiko für kardiovaskuläre Ereignisse oder für Malignome erhöhten.13 Zu berücksichtigen sei ausserdem, dass Menschen mit RA ein gegenüber der Allgemeinbevölkerung deutlich erhöhtes MI-Risiko haben, und zwar ähnlich hoch wie bei Diabetes mellitus, betonte Kyburz.14 Allerdings sinke das RA-assoziierte kardiovaskuläre Risiko signifikant, wenn die Krankheit adäquat behandelt werde. Dies wurde in einer Metaanalyse deutlich, bei der das kardiovaskuläre Risiko unter TNFi-Behandlung oder mit konventionellen Basismedikamenten wie MTX signifikant zurückging.15
Factbox
Wichtig ist, dass individuelle Risikofaktoren kontrolliert werden. So kann bereits unabhängig von der Basistherapie das kardiovaskuläre Risiko gesenkt werden.
Weil eine adäquate Kontrolle der RA neben der Krankheit selbst auch das kardiovaskuläre Risiko reduziere, solle man nicht jede JAKi-Therapie abbrechen, sobald die Patient:innen 65 Jahre alt sind. Denn sie könnten mit anderen Mitteln nicht eingestellt werden, sodass das kardiovaskuläre Risiko steige und nicht sinke. Tatsächlich könne unter einer Treat-to-Target-Strategie und guter Krankheitskontrolle das kardiovaskuläre Risiko trotz RA auf das Niveau einer Normalpopulation sinken, so Kyburz.16
GLP-1-Agonisten gegen kardiovaskuläres Risiko bei RA
Bei RA-Patient:innen, die neben einem JAKi einen GLP-1-Agonisten erhalten, sinkt die Zahl der kardiovaskulären Ereignisse hochsignifikant (7,9% vs. 5,3%), wie eine Analyse mit einem Follow-up über 5 Jahre deutlich machte. Man könne also mit geeigneten Massnahmen das kardiovaskuläre Risiko auch bei Menschen unter einer JAKi-Therapie reduzieren, führte Kyburz aus.17
Die Zukunft der JAKi
Man könne die JAKi nicht abschreiben aufgrund der Daten über ein erhöhtes kardiovaskuläres Risiko, und das Feld entwickle sich weiter, prognostizierte Kyburz. Untersucht werde derzeit ihre Anwendung bei diversen Kollagenosen, die breite Wirkung der JAKi als auch der Interferon-Antagonisten biete sich dafür an. Darüber hinaus könnten eine duale Inhibition mit JAKi plus Bruton-Tyrosinkinase(BTK)-Inhibition oder plus ROCK-Inhibition Wirkung und Sicherheit optimieren. Eine duale JAK/ROCK-Inhibition bessere beispielsweise das Lipidprofil deutlich.
Quelle:
«Therapeutische Herausforderungen JAK Inhibitoren: Revisited», Vortrag von Prof. Dr. med. Diego Kyburz, Basel, anlässlich des SGR Jahreskongresses am 4. September 2025 in Interlaken, Schweiz
Literatur:
1 Tanaka Y et al.: Janus kinase-targeting therapies in rheumatology: a mechanisms-based approach. Nat Rev Rheumatol 2022; 18: 133-45 2 Szekanecz Z et al.: Autoinflammation and autoimmunity across rheumatic and musculoskeletal diseases. Nature Review Rheumatology 2021; 17(10): 585-95 3 Choy EH et al.: The effect of JAK1/JAK2 inhibition in rheumatoid arthritis: efficacy and safety of baricitinib. Rheumatol 2019; 37(4): 694-704 4 Taylor et al.: Baricitinib versus placebo or adalimumab in rheumatoid arthritis. N Engl J Med 2017; 376(7): 652-62 5 Fleischmann R et al.: Upadacitinib versus placebo or adalimumab in patients with rheumatoid arthritis and an inadequate response to methotrexate: results of a phase III, double-blind, randomized controlled trial. Arthritis Rheumatol 2019; 71(11): 1788-1800 6 Mease P et al.: Tofacitinib or adalimumab versus placebo for psoriatic arthritis. N Engl J Med 2017; 377(16): 1537-50 7 Charles-Shoeman C et al.: Risk factors for major adverse cardiovascular events in patients aged ≥50 years with RA and ≥1 additional cardiovascular risk factor: results from a phase 3b/4 randomized safety study of tofacitinib vs TNF inhibitors. Am Coll Rheum 2021; 73(9): Abstr 0958 8 Ytterberg SR et al.: Cardiovascular and cancer risk with tofacitinib in rheumatoid arthritis. N Engl J Med 2022; 386(4): 316-26 9 Kristensen et al.: Identification of two tofacitinib subpopulations with different relative risk versus TNF inhibitors: an analysis of the open label, randomised controlled study ORAL Surveillance. Ann Rheum Dis 2023; 82(7): 901-10 10 Huss V et al.: Cancer risks with JAKi and biological disease-modifying antirheumatic drugs in patients with rheumatoid arthritis or psoriatic arthritis: a national real-world cohort study. Ann Rheum Dis 2023; 82(7): 911-19 11 Ayman R et al.: Cancer incidence among rheumatoid arthritis patients treated with JAK-inhibitors compared to bDMARDs: data from an international collaboration of registers (The “JAK-pot” Study). Ann Rheum Dis 2025; 84(Suppl): 193-4 12 Russell MD et al.: JAK inhibitors and the risk of malignancy: a meta-analysis across disease indications. Ann Rheum Dis 2023; 82(8): 1059-67 13 Smolen JS et al.: EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2022 update. Ann Rheum Dis 2023; 82(1): 3-18 14 Lindhardsen J et al.: The risk of myocardial infarction in rheumatoid arthritis and diabetes mellitus: a Danish nationwide cohort study. Ann Rheum Dis 2011;70(6): 929-34 15 Roubille C et al.: The effects of tumour necrosis factor inhibitors, methotrexate, non-steroidal anti-inflammatory drugs and corticosteroids on cardiovascular events in rheumatoid arthritis, psoriasis and psoriatic arthritis: a systematic review and meta-analysis. Ann Rheum Dis 2015; 74(3): 480-9 16 England BR et al.: Increased cardiovascular risk in rheumatoid arthritis: mechanisms and implications. BMJ 2018; doi: 10.1136/bmj.k1036 17 Beltagy A et al.: GLP1 agonists mitigate the risk of cardiovascular events in Rheumatoid Arthritis patients treated with JAK inhibitors. Ann Rheum Dis 2025; 84: 61-2
Das könnte Sie auch interessieren:
Zervikale vaskuläre Pathologien: Diagnostik und Management
Vaskuläre Pathologien der Halswirbelsäule, insbesondere Dissektionen der A. carotis oder der A. vertebralis, sind potenziell lebensbedrohliche Zustände. Sie treten häufig infolge von ...
Seltene Kleingefässvaskulitiden im Fokus
Bei Vaskulitiden der kleinen Gefässe liegt eine nekrotisierende Entzündung der Gefässwand von kleinen intraparenchymatösen Arterien, Arteriolen, Kapillaren und Venolen vor. Was gilt es ...
Elektive Hüft-TEP bei Adipositas Grad III
Übergewichtige Patient:innen leiden früher als normalgewichtige Personen an einer Hüft- oder Kniearthrose. Allerdings sieht die aktuelle S3-Leitlinie zur Behandlung der Coxarthrose in ...