Welche Rolle spielt die Nuklearmedizin in der Demenzdiagnostik?
Autor:
Prim. Univ.-Prof. Dr. Thomas Leitha
Abteilung für nuklearmedizinische Diagnostik und Therapie
Klinik Donaustadt, Wien
Das pathophysiologische Wissen über diverse Demenzbilder wird immer komplexer. Um diese abzubilden, stellt die nuklearmedizinische Bildgebung verschiedene Methoden zur Verfügung. Die Einzelheiten dazu lesen Sie hier.
Keypoints
-
Diagnostische Bildgebung in der Demenzdiagnostik setzt eine klinische und neuropsychologische Testung voraus.
-
Vor jeder nuklearmedizinischen Diagnostik sollte zumindest eine orientierende morphologische (radiologische) Diagnostik vorliegen, da ausgeprägte morphologische Veränderungen zu funktionellen Veränderungen führen, die in Unkenntnis der morphologischen Veränderungen (Stroke,...) schwer erklärlich sind.
-
„Typische Befundmuster“ aus der Literatur reflektieren Ergebnisse aus Gruppenvergleichen. Vergleichbare diagnostische Ergebnisse sind im Einzelpatienten nur gemeinsam mit einer fundierten klinischen/neuropsychologischen Verdachtsdiagnose zu erreichen.
-
Bildgebung ist in der Regel ein „Problemlöser“ zwischen verschiedenen Verdachtsdiagnosen (atypischen Formen!) und per se keine endgültige Diagnose. Im klinischen Alltag liegt ihre Bedeutung neben der Erhärtung der Verdachtsdiagnose auch in deren Widerlegung, um weitere diagnostische und therapeutische Wege zu weisen.
-
Für unterschiedliche Aspekte der Demenzdiagnostik steht eine Vielzahl an verschiedenen nuklearmedizinischen Diagnoseverfahren zur Verfügung. Viel spricht dafür, dass wir von der reflektorischen Zuweisung primär zur FDG PET hin zu einer differenzierten sequentiellen Anwendung der einzelnen Tracer kommen müssen, um die immer spezifischeren diagnostischen Fragen abklären zu können.
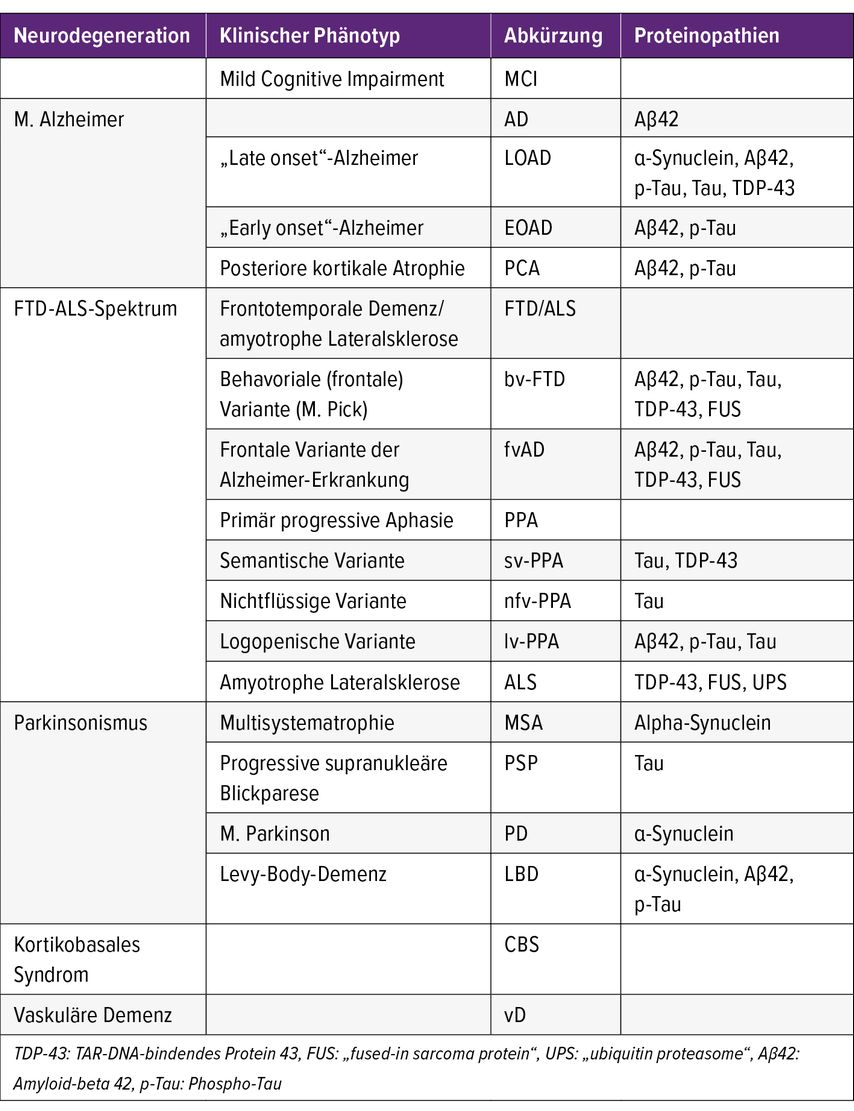
Die Nuklearmedizin ist im Kern eine bildgebende Diagnostik, die physiologische und pathophysiologische Prozesse abbildet. Aus diesem Grund wäre es logisch, in der Demenzdiagnostik die Wahl der einzelnen Untersuchungsmethoden nicht an die pathoanatomischen und klinischen Parameter des frühen 20. Jahrhunderts zu binden (Tab.1), sondern an die diese Krankheitsbilder definierenden Proteinopathien.1
Es stehen uns aber (noch) nicht für alle Marker geeignete Tracer zur Verfügung bzw. sind viele publizierte Tracer noch nicht als Radiopharmaka behördlich freigegeben. Deshalb orientieren sich Leitlinien meist an den traditionellen Einteilungen neurodegenerativer Krankheitsbilder. Das führt zwangsläufig zu Überschneidungen, sodass z.B. eine positive Amyloid-β-PET (Positronen-Emissions-Tomografie) auch bei einer Reihe anderer Krankheitsbilder als dem klassischen M. Alzheimer zu sehen ist. Andererseits ist eine negative FDG-PET (FDG: 18F-Fluorodeoxyglukose) keine Garantie für das Ausbleiben einer demenziellen Entwicklung. Die Zuweisung zu jeder nuklearmedizinischen Bildgebung setzt deshalb eine fachlich fundierte neuropsychologische Voruntersuchung und eine morphologische Bildgebung (CT, MR) voraus, um aus der Fülle funktioneller Untersuchungsmethoden auch mit der zu beginnen, die den größten diagnostischen Gewinn verspricht.
Was tun wir?Welche nuklearmedizinischen Untersuchungen sind möglich?
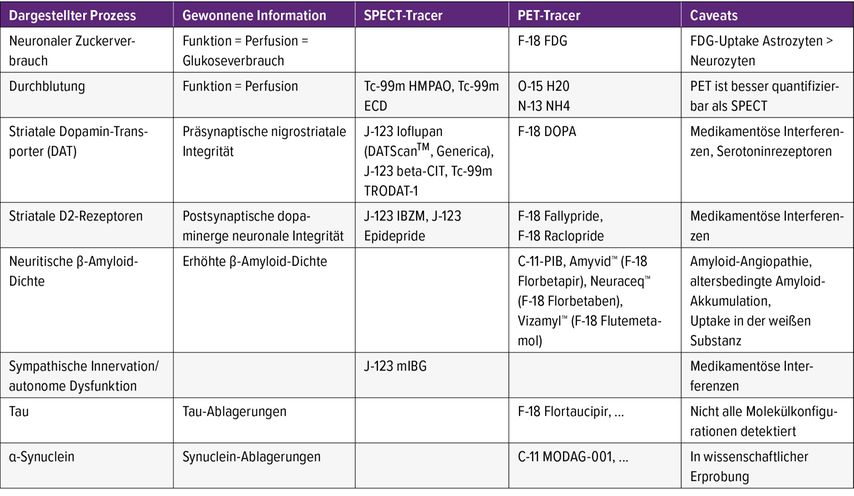
Tabelle 2 gibt einen Überblick über die wichtigsten Untersuchungsmethoden im Rahmen der Demenzdiagnostik. Nur noch sehr selten verwendete Methoden (z.B. Liquorszintigrafie beim Normaldruckhydrocephalus) werden nicht erwähnt.
Trotz unterschiedlicher Gerätespezifika ist die konventionelle Nuklearmedizin (z.B. in der M.-Parkinson[PD]-Diagnostik) mit Gammakameras nicht prinzipiell besser als die PET. Im Mittelpunkt steht weniger das Gerät (Gammakamera, PET, SPECT/CT, PET/CT, PET/MR), sondern mehr das verwendete Radiopharmakon (Tracer) und die dadurch gewonnene diagnostische Erkenntnis. Je nach örtlicher Geräteausstattung bzw. behördlicher Umgangsgenehmigung sind als Tracer sowohl Gamma- als auch Positronen-Emitter in Verwendung. Abgebildet werden sie entsprechend entweder mittels SPECT (Single-Photonen-Emissionstomografie), einer tomografischen Untersuchung in der Gammakamera oder PET, einer tomografischen Untersuchung für Positronen-Emitter im gleichnamigen Scanner. Obwohl die PET eine methodisch bessere Auflösung als die SPECT liefert, werden beide Techniken je nach verfügbarem Tracer angewandt und liefern in der Demenzdiagnostik dort, wo Tracer für beide Methoden verfügbar sind, weitgehend übereinstimmende Ergebnisse. Je nach Fragestellung lassen sie sich auch als Hybridbildgebung mit CT (selten MR) kombinieren (SPECT/CT, PET/CT, PET/MR).
FDG-PET
Beim Gesunden stehen in enger Übereinstimmung: die zerebrale Durchblutung, die das gesunde Gehirn über einen bestimmten Bereich autonom regelt, der Energieverbrauch, in erster Linie durch Verstoffwechselung von Glukose, und die neuronale Aktivität. Mit der FDG-PET quantifiziert man den Glukoseverbrauch verschiedener Gewebe, wobei bestimmte Demenzformen im Gruppenvergleich typische Muster haben. Auch die „Durchblutungstracer“ für SPECT und PET basieren auf den oben angeführten Beziehungen, sodass sich aus der regionalen Durchblutung auf die Stoffwechselaktivität und Funktion schließen lässt. Genau genommen gilt das aber nur für das gesunde ZNS und z.B. nicht nach rezenten Schlaganfällen („Luxusperfusion“). Etwas eingeschränkt wird dieses Konzept möglicherweise auch dadurch, dass die Astroglia eine nicht unerhebliche Glukoseaufnahme2 zeigt. Welchen Einfluss dies auf die Diagnostik hat, ist noch in Diskussion. Während in der Vergangenheit die FDG-PET die primäre nuklearmedizinische Diagnostik der Demenz war, hat sie ihre größte Trennschärfe in der initialen Beurteilung des Mild Cognitive Impairment (MCI) und in der Differenzialdiagnostik zwischen M. Alzheimer und frontotemporaler Demenz. Wie aber aus Tabelle 1 ersichtlich ist, gibt es auch hier z.B. mit der frontalen Variante der Alzheimer-Krankheit seltene Überlappungen, die nur in der Zusammenschau aller Befunde abgeklärt werden können.3
Amyloid-PET
Eine negative Amyloid-PET schließt all jene Krankheitsbilder aus, in denen es zu einer vermehrten neuritischen β-Amyloid-Anreicherung kommt, z.B. M. Alzheimer und z.T. Levy-Body-Demenz (LBD). Im Hinblick auf die proportional zum Lebensalter steigende Amyloid-Anreicherung auch bei Nichtdementen wird die Anwendung jenseits des 65. Lebensjahres nicht mehr empfohlen.
Sollten Therapieformen gegen β-Amyloid-Anreicherung in die klinische Praxis kommen, wäre die Methode, wie schon bisher in klinischen Studien, ein möglicher Gatekeeper. Da viele Targets (z.B. Amyloid, Tau) in verschiedenen Konfigurationen vorliegen können, ist – wie bei ihrer Bestimmung im Liquor und Blut („Fluid Biomarkers“) – nicht prinzipiell davon auszugehen, dass die einzelnen Tracer immer alle Targets binden. So ist in den USA F-18 Flortaucipir zwar als PET-Tracer in der Alzheimer-Diagnostik, nicht aber für andere Tau-Pathologien freigegeben. Die Befundung ist in der Praxis herausfordernd und erfordert ein spezielles Training, sodass die Diagnostik auf spezialisierte Zentren beschränkt ist.
Für Tau und α-Synuclein liegt in Europa noch kein registrierter Tracer vor. Da auch eine zerebrale Amyloid-Angiopathie zu positiven Befunden führt, handelt es sich zwar nicht im eigentlichen Sinn um „falsch positive“ Befunde, eine Nichtbeachtung dieser Differenzialdiagnose kann die Diagnostik aber auf eine falsche Spur führen.4
Rezeptorimaging
Bei einer Reihe von an Oberflächenrezeptoren bindenden Tracern (z.B. DOPA, IBZM, mIBG, beta-CIT, Ioflupan) muss schon bei der Zuweisung auf allfällige medikamentöse Interferenzen geachtet werden, um gegebenenfalls eine ausreichende Einnahmepause planen zu können.5 Dem Zuweiser muss also die Liste der eingenommenen Medikamente vorliegen – was bei älteren Multimorbiden in der Praxis schwierig, aber unumgänglich ist, um falsche Befunde zu vermeiden. Trizyklische Antidepressiva und Oxymetazolin-haltige Nasentropfen (NasivinTM) interferieren z.B. mit dem mIBG-Uptake!
Krankheitsbilder, bei denen die präsynaptische nigrostriatale dopaminerge Funktion gestört ist, lassen sich von der Alzheimer-Krankheit abgrenzen. Dazu zählen LBD, PD, progressive supranukleäre Blickparese, kortikobasale Degeneration sowie striatale Formen der Multisystematrophie (MSA). Da es mehr Gammakameras als PET gibt, werden meist SPECT-Tracer (Ioflupan) verwendet. Zur Differenzialdiagnose z.B. zwischen PD und MSA werden ergänzend auch die postsynaptischen D2-Rezeptoren dargestellt. Auch hier ist der Zugang zur SPECT-Untersuchung meist einfacher als zur PET.
Die Identifikation einer gestörten sympathischen Innervation/autonomen Dysfunktion mittels des SPECT-Tracers J-123 mIBG ist zwar wissenschaftlich gut belegt – z.B. zur Differenzierung zwischen PD und essenziellem Tremor –, sollte aber wegen des großen Einflusses medikamentöser Interferenzen gerade in einer älteren und oft multimorbiden Kohorte meiner Erfahrung nach auf Ausnahmefälle beschränkt bleiben.
Wie tun wir es?Vor Blickdiagnosen sei gewarnt
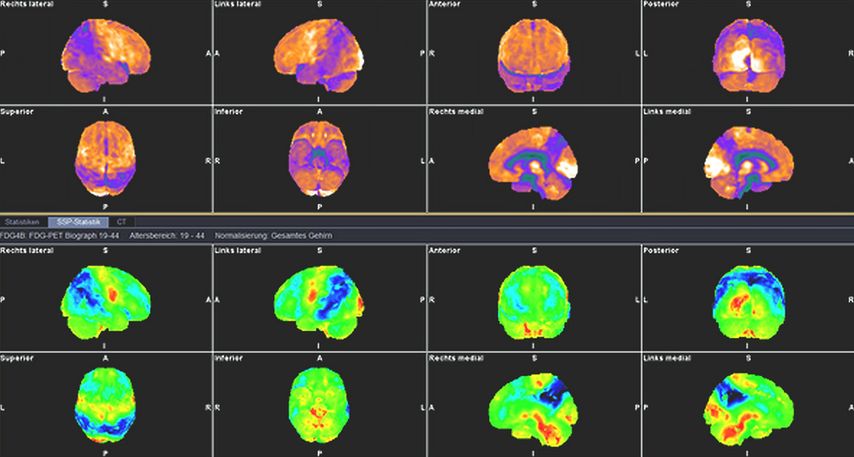
Die digitale Bildgebung führt prinzipiell zu Zahlenwerten, die in Bilder (grau, Farbe) umgesetzt werden, um sie visuell beurteilen zu können. Um die Objektivität der Befundung zu erhöhen, werden zusätzlich semiquantitative und quantitative Auswertungen, oft im Vergleich zu Normalkollektiven (Statistical Parametric Mapping, Stereotactic Surface Projection; Abb.1), durchgeführt. Dazu ist eine Reihe von Rechenschritten und volumetrischen Verformungen des Datensatzes erforderlich, die durchaus auf verschiedenen Plattformen das numerische Ergebnis beeinflussen können. „Normalkollektive“ sind auch geräte- und altersspezifisch. Somit sollten Verlaufsuntersuchungen immer auf denselben Geräten erfolgen. Die in der Literatur oft als „typische Befundmuster“ beschriebenen Verteilungen und deren diagnostische Performance stellen somit „Idealbilder“ zum Gruppenvergleich dar, denen im Einzelfall oft weniger eindeutige Befundausprägungen entsprechen. Grobe anatomische Veränderungen (z.B. Normaldruckhydrocephalus, ausgedehnte Infarkte) können die Ergebnisse zusätzlich massiv beeinflussen, sodass die Befundung immer in der Zusammenschau mit einer anatomischen Bildgebung zu erfolgen hat.6
Abb. 1: FDG-PET eines <50-jährigen Patienten mit Trisomie 21. Die oberen beiden Reihen zeigen die auf die Pons normalisierte kortiale Glukoseutilisation, die beiden unteren Reihen die statistische Abweichung vom Normalkollektiv (Dunkelblau entspricht minus 6 Standardabweichungen)
Sollen wir das tun?Leitlinien versus Praxis
Der Kliniker liest in der medizinischen Literatur beeindruckende Forschungsergebnisse mit immer besseren Diagnosemethoden, während die meisten rezenten Leitlinien und Empfehlungen7–10 die nuklearmedizinische Bildgebung nur als „Problemlöser“ in diagnostisch unklaren Fällen empfehlen. Nicht zuletzt werden auch die Untersuchungen von der Pflichtversicherung nicht oder nicht in einem kostendeckenden Ausmaß übernommen. Zuweisern ist oft auch nicht klar, dass z.B. ein C-11-markierter Tracer wegen seiner sehr kurzen Halbwertszeit (ca. 20,5 Minuten) nur innerhalb von Zentren (mit eigenem Zyklotron und eigener Radiopharmakaproduktion) zur Verfügung steht. Tracer mit F-18, einem Positronen-Emitter mit längerer Halbwertszeit (ca. 110 Minuten), können extern markiert und über eine längere Strecke zum PET-Scanner transportiert werden. Allerdings sind wir hier auf behördliche Vorgaben und das Angebot kommerzieller Hersteller angewiesen.
Zur besseren klinischen Einordnung wissenschaftlicher Ergebnisse muss auch berücksichtigt werden, dass die Bildgebung sehr häufig eine hohe Trennschärfe zwischen Gesunden und typischen Demenzbildern hat, z.B. ROC(„receiver operating characteristic“)-Werte von 0,96 zum typischen Alzheimer. In der klinischen Praxis untersuchen wir aber nicht klinisch Gesunde, sondern benötigen differenzialdiagnostische Informationen bei gesicherter Demenz. Hier kann die Trennschärfe geringer sein. Überdies zeigen die meisten Longitudinalstudien, dass sich auch die klinische Einschätzung der Krankheitsbilder im Zeitverlauf ändert und nicht immer mit dem postmortalen neuropathologischen Ergebnis übereinstimmt.11
Die Dont’s …
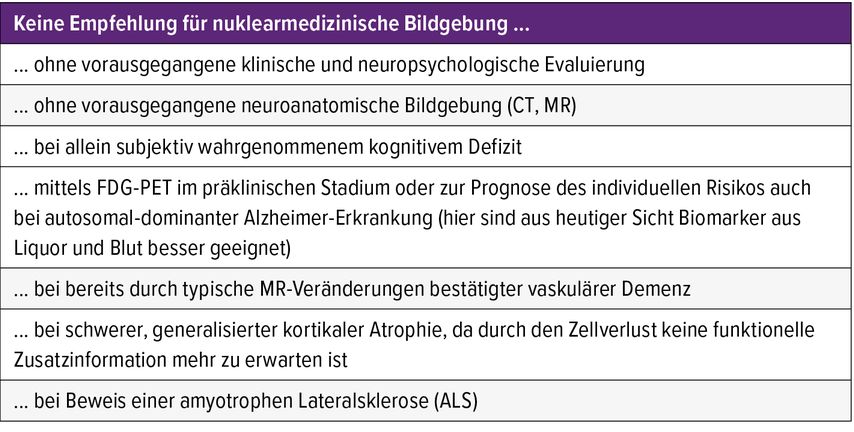
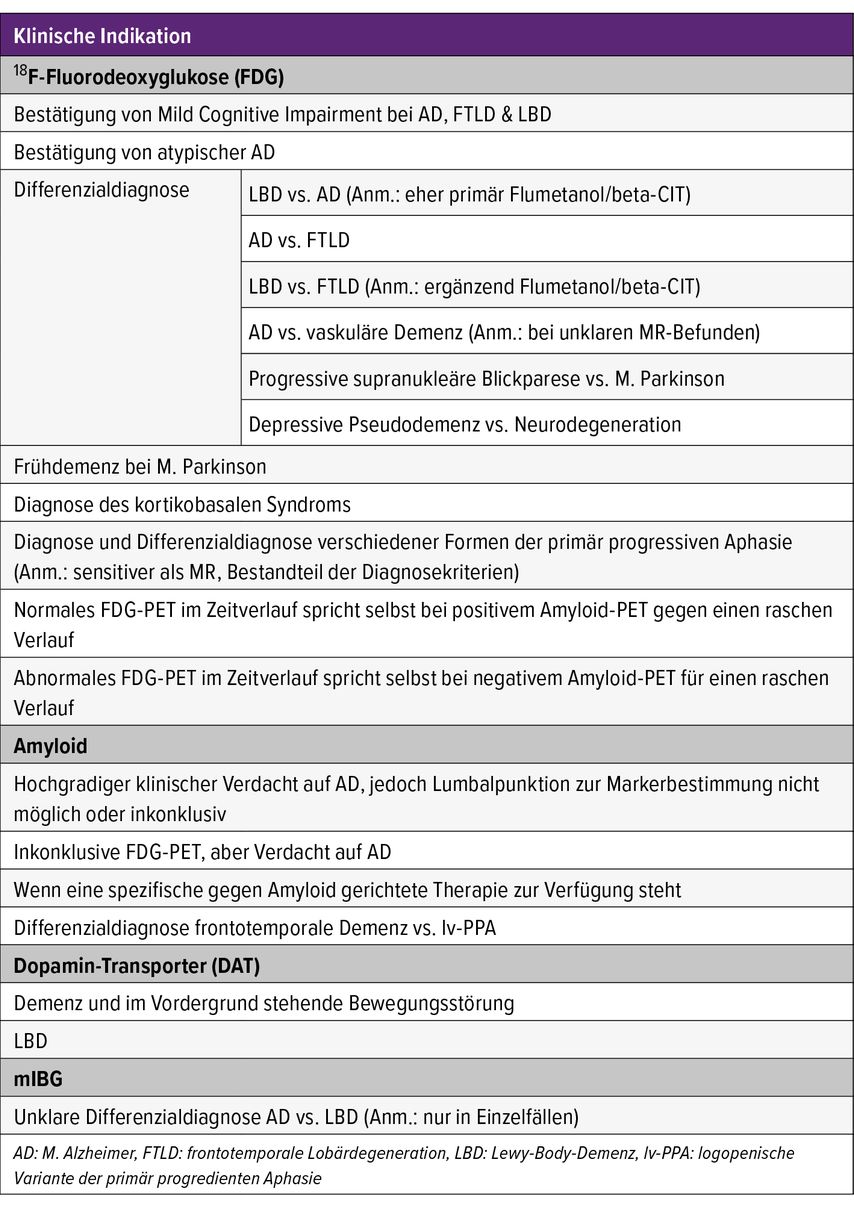
Während Indikationen und Reihenfolge der einzelnen Untersuchungen zum Teil in Diskussion sind, besteht ein klares Bild, welche klinischen Situationen keine Indikationen darstellen (Tab. 3).
… und Dos
Ein ausführlicher Expertenkonsens, der bei fehlender Evidenz mittels Delphi-Methode erreicht wurde, stammt aus dem Jahr 2018.8 Einige andere rezente Publikationen wurden bereits weiter oben erwähnt und sind in Tabelle 4 zusammengefasst. Während in der Vergangenheit, nicht zuletzt auf Basis der besseren Verfügbarkeit, häufig die nuklearmedizinische Demenzdiagnostik mit einer FDG-PET begonnen wurde, schlug kürzlich ein multiprofessionelles Expertengremium12 ein differenziertes Vorgehen vor. Auf Basis der klinischen (Familienanamnese), neuropsychologischen, serologischen (APOE-Genotyp, Biomarker) und morphologischen Diagnostik ergibt sich eine Vortestwahrscheinlichkeit. Entsprechend dieser empfiehlt sich für einzelne neurodegenerative Bilder eine unterschiedliche Reihenfolge der nuklearmedizinischen Diagnostik.
Untersuchungsgang 1 wird für Patienten vorgeschlagen, bei denen in erster Linie eine Alzheimer-Krankheit suszipiert wird, aber eine fragliche (atypische) klinische Präsentation oder morphologische Bildgebung vorliegt, bzw. deren Amyloid-Status für weitere therapeutische Entscheidungen benötigt wird. Hier empfiehlt sich ein Amyloid-PET als Erstuntersuchung und bei negativem oder inkonklusivem Ergebnis eine FDG-PET.
Untersuchungsgang 2 wird für Patienten vorgeschlagen, bei denen eine andere Demenzform als der Alzheimer-Typ suszipiert wird und keine auffallende Bewegungsstörung vorliegt. Hier empfiehlt sich ein FDG-PET als Erstuntersuchung und erst sekundär ein Amyloid-PET.
Untersuchungsgang 3 wird für Patienten mit kognitivem Defizit und einer Bewegungsstörung vorgeschlagen, bei denen mit einem DaT-SPECT oder einer mIBG-SPECT begonnen werden soll und inkonklusive Fälle dann zur FDG-PET weitergehen.
Alles in allem
Mit zunehmendem Wissen werden immer komplexere Aspekte demenzieller Zustandsbilder erkannt. Die nuklearmedizinische Bildgebung kann hier Verdachtsdiagnosen erhärten oder abschwächen. Sie hat ihre wesentliche Funktion als Problemlöser im Diagnosegang. Dazu ist eine klare Indikations- und Fragestellung auf Basis einer klinischen Vordiagnostik erforderlich.
Literatur:
1 Allegri RF: Moving from neurodegenerative dementias, to cognitive proteinopathies, replacing “where” by “what”. Dement Neuropsychol 2020; 14(3): 237-42 2 Xiang A et al.: Microglial activation states drive glucose uptake and FDG-PET alterations in neurodegenerative diseases. Sci Transl Med 2021; 13(615): eabe5640 3 Li CH et al.: Frontal variant of Alzheimer’s disease with asymmetric presentation mimicking frontotemporal dementia: case report and literature review. Brain Behav 2020; 10(3): e01548 4 Farid K et al.: Amyloid positron emission tomography in sporadic cerebral amyloid angiopathy: a systematic critical update. Neuroimage Clin 2017; 15: 247-63 5 Morbelli S et al.: EANM practice guideline/SNMMI procedure standard for dopaminergic imaging in Parkinsonian syndromes 1.0. Eur J Nucl Med Mol Imaging 2020; 47: 1885-912 6 Patel KP et al.: Multimodality imaging of dementia: clinical importance and role of integrated anatomic and molecular imaging. Radiographics 2020; 40: 200-22 7 American College of Radiology: ACR Appropriateness Criteria 2015. https://acsearch.acr.org/docs/69360/Narrative/ 8 Nobili F et al.: European Association of Nuclear Medicine and European Academy of Neurology recommendations for the use of brain ¹⁸F-fluorodeoxyglucosepositron emission tomography in neurodegenerative cognitive impairment and dementia: Delphi consensus. Eur J Neurol 2018; 25(10): 1201-17 9 S3-Leitlinie „Demenzen“. AWMF-Register-Nr.: 038-013 10 Frey KA et al.: ACR-ASNR practice parameter for brain PET/CT imaging dementia. Clin Nucl Med 2016 (revised 2020); 41(2): 118-25 11 Kautzky A et al.: Prediction of autopsy verified neuropathological change of Alzheimer’s disease using machine learning and MRI. Front Aging Neurosci 2018; 10: 406 12 Chételat G et al.: Amyloid-PET and ¹⁸F-FDG-PET in the diagnostic investigation of Alzheimer’s disease and other dementias. Lancet Neurol 2020; 19: 951-62
Das könnte Sie auch interessieren:
Wichtige Laborparameter bei Epilepsie: ein aktueller Überblick
Laborkontrollen sind bei Epilepsien aus verschiedensten Gründen erforderlich. Anfallssupprimierende Medikamente können Störwirkungen auf unterschiedliche Organsysteme haben, die unter ...
Alzheimer: laufende klinische Studien, State of the Art der Biomarkerdiagnostik und gemischte Pathologien
Die Forschung an neuen Therapien für die Alzheimerkrankheit (AD) erfährt ein nie dagewesenes Momentum. Auf der internationalen Alzheimer- und Parkinsonkonferenz AD/PD in Wien gab es ...
Nahrungsergänzungsmittel bei ME/CFS: neue Hoffnung oder falsche Versprechen?
Chronische Erschöpfung, die nicht vergeht, Schmerzen, Konzentrationsprobleme, ein Leben in Zeitlupe. Myalgische Enzephalomyelitis/Chronisches Fatigue-Syndrom (ME/CFS) betrifft weltweit ...