Speichel zur Diagnose von Demenzerkrankungen?
Autor:
Univ.-Prof. Mag. Dr. Christian Humpel
Psychiatrisches Labor für Experimentelle Alzheimer Forschung
Universitätsklinik für Psychiatrie I
Medizinische Universität Innsbruck
E-Mail: christian.humpel@i-med.ac.at
Die Alzheimerdemenz ist eine schwere neurodegenerative Erkrankung des Gehirns und führt zum Gedächtnisverlust. Biomarker in der Labordiagnose, vor allem in Liquor (Zerebrospinalflüssigkeit) und Blut, sollen eine Frühdiagnose dieser Krankheit unterstützen. Speichel könnte schnell und problemlos gewonnen werden und sollte dazu beitragen, neue Biomarker für eine Frühdiagnostik der Alzheimerdemenz zu finden.
Keypoint
-
Die Messung von 4 Biomarkern (beta-Amyloid40 und 42, Gesamt-Tau und Phospho-tau181) im Liquor erlaubt die Diagnose der Alzheimerdemenz mit hoher Wahrscheinlichkeit.
-
Im Blut gibt es derzeit noch keine etablierten Biomarker, wobei Phospho-Tau181 oder 217 im Plasma Erfolg versprechend sind.
-
Die Analyse von Biomarkern im Speichel ist noch am Beginn und muss optimiert werden, kann aber die Frühdiagnostik unterstützen.
Biomarker im Liquor und Blut
Die Diagnose demenzieller Erkrankungen, vor allem im frühen Stadium, ist nicht immer leicht und benötigt einen interdisziplinären Ansatz. Es wäre für den Arzt wünschenswert, einen Biomarker zu bekommen, der mit hoher Sicherheit den Status einer Krankheit darstellt. Ein Biomarker ist ein objektiv messbarer Parameter eines biologischen Prozesses und soll ein Laborparameter sein, der dem Arzt als Entscheidungshilfe dient, um seine Diagnose zu stellen bzw. um die Therapie zu überwachen. Daher soll ein Biomarker die klinische Diagnose unterstützen. Es gibt mehrere Arten von Biomarkern:
-
Der Biomarker des Alterns soll einen generellen Prozess des Alterns darstellen, aber nicht der Krankheit. Er soll messen, in welchem Stadium des Alters sich der Mensch befindet, also einen Hinweis auf das biologische Alter geben.
-
Der Biomarker der Krankheit soll objektiv darstellen, ob sich der Mensch vom Durchschnitt seines Alters unterscheidet und einen krankhaften Zustand durchläuft, der akut oder chronisch sein kein. Dieser Biomarker soll bei der Verbesserung der Krankheit wieder in seinen Ausgangszustand gehen.
-
Der Biomarker der Veränderung soll anzeigen, ob sich der Status der Krankheit verändert bzw. ob sich die Krankheit verschlechtert.
-
Der Biomarker der Therapie soll anzeigen, ob eine therapeutische Maßnahme anspricht.
Ein optimaler Biomarker muss
-
objektiv messbar und reproduzierbar sein; es sollten mindestens 3 Zentren weltweit dasselbe unabhängig finden,
-
spezifisch sein, >90%, um eine Krankheit von anderen Formen zu unterscheiden,
-
sensitiv sein, um möglichst genau den Parameter zu messen,
-
billig sein,
-
einfach zu verwenden sein, wobei vor allem einfacher Transport, Lagerung und Stabilität zu berücksichtigen sind, und
-
unproblematisch für den Patienten sein (also möglichst nichtinvasiv, ohne dass der Patient gestochen werden muss).
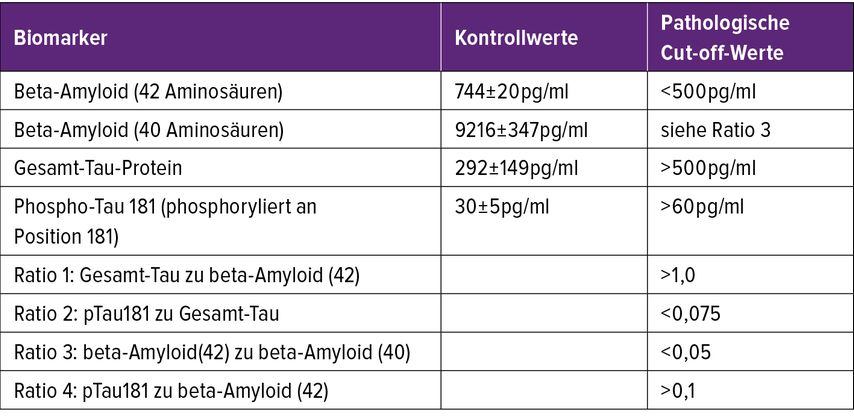
Die Körperflüssigkeit, die direkt mit dem Gehirn in Verbindung steht, ist die Zerebrospinalflüssigkeit (CSF, Liquor); daher ist die CSF-Analyse die derzeit beste und genaueste Laboranalyse, um Laborbiomarker bei neurodegenerativen Erkrankungen zu messen.1 Die Entnahme des Liquors (lumbale Punktion) ist jedoch ein invasiver Eingriff. In meinem Labor für experimentelle Alzheimerforschung an der Medizinischen Universität Innsbruck messen wir seit mehr als 15 Jahren (zusammen mit Univ.-Prof. Dr. Josef Marksteiner) Liquor-Biomarker und sind inzwischen auch nach ISO 9001:2015 zertifiziert. Durch engen Kontakt mit unserer Gedächtnissprechstunde (PD Dr. Michaela Defrancesco) können wir nicht nur Laborwerte, sondern auch einen ärztlichen Befund und eine Interpreation dem Zuweiser liefern. Die Zeit von Probenübernahme bis Ausgabe des Befundes erfolgt zumeist innerhalb von 2 Werktagen. Zur diagnostischen Beurteilung haben sich 4 Biomarker im Liquor international etabliert, deren „Normalwerte“ in Tabelle 1 gegeben sind. Diese 4 Biomarker werden bei uns mittels hochmoderner LUMIPULSE-Technologie mit einem G600 II (Fujirebio) gemessen. Wir sind damit in der Lage, mit einem automatischen Pipettier-Robotersystem Proben innerhalb von 35 Minuten zu messen. Diese 4 Biomarker sind beta-Amyloid mit 42 und 40 Aminosäuren und Gesamttau sowie das an Position 181 phosphorylierte Tau.
Um eine Krankheit zu definieren, müssen pathologische Cut-off-Werte bestimmt werden (diese sind in Tabelle 1 gegeben). In diesem Zusammenhang muss jedoch auch das Problem des Cut-off-Wertes klar sein, denn ein Wert von 499 oder 501 (bei einem Cut-off von 500) kann schlagartig die Diagnose ändern. In diesem Zusammenhang muss auch ein möglicher Messfehler von mindestens 1–5% bewusst sein, daher sind Cut-off-Werte auch hier als Bereich zu sehen – bzw. weisen wir in meinem Labor eindeutig darauf hin, wenn ein Biomarker im Grenzbereich liegt.
Die Messung aller 4 etablierten Biomarker im CSF hat Vor- und Nachteile. Diese Messung erlaubt eine Diagnose der Alzheimerdemenz mit bis zu 90–97%iger Sicherheit. Die CSF-Proben sind mind. 3 Tage bei Raumtemperatur in Polypropylenröhrchen stabil, sodass die Proben problemlos abgenommen und versandt werden können. Diese Analyse ist weltweit etabliert und reproduziert. Nachteile der Methode sind, dass es eines invasiven Eingriffes bedarf und die Patienten lumbal punktiert werden. Daher ist weder ein Screening von Patienten noch eine Mehrfachtestung leicht möglich. Leider können auch andere Formen der Demenz (z.B. Frontalhirndemenz) und leichte Demenzen (z.B. MCI) nicht sicher abgegrenzt werden.
Warum brauchen wir dringend Biomarker im Blut?
Die Liquorabnahme ist ein invasiver Eingriff und limitiert dramatisch die Analysen. Die Diagnose der Alzheimerdemenz aus Blut würde den Prozess revolutionieren. Leider gibt es bisher keinen etablierten Biomarker im Blut für Demenzen. Das größte Potenzial – ein Biomarker im Plasma für die Diagnose der Demenz – haben derzeit die phosphorylierten Tau-Proteine und werden international stark beforscht. Daten zeigen, dass eventuell Phospho-Tau 181 oder 217 im Plasma mögliche Blutbiomarker sind, wobei unsere präliminären Daten auf eher geringe Erhöhungen von pT181 im Plasma von Alzheimerpatienten (2,9±0,5pg/ml, n=10) verglichen mit Kontrollen (1,6±0,2pg/ml, n=10) hinweisen.
Biomarker im Speichel (Saliva)
Der Speichel (Saliva) ist farblos, geruchlos und hat einen pH von 6,6–7,1 und ein gesunder Erwachsener produziert 0,7–1,5l Speichel/Tag mit einem Speichelfluss von 0,6–1ml/min. Saliva besteht zu 99% aus Wasser, enthält aber viele Eiweiße, Hormone, Zucker, Lipide und Elektrolyte, und das Speichel-Proteom enthält ca. 2300 Eiweiße, wobei ca. 27% sogar ident sind mit dem Plasma-Eiweiß. Saliva wird sekretiert von den drei Speicheldrüsen, der Glandula parotis, Glandula submandibularis und Glandula sublingualis. Aber die Zusammensetzung und der Speichelfluss werden durch zahlreiche exogene Faktoren reguliert und verändert, sowohl durch Alter als auch Geschlecht, aber auch durch Rauchen, Alkohol, Stress oder Mundhygiene. Weiters beeinflussen zahlreiche Medikamente den Speichel, wie Antidepressiva, Antipsychotika, Anticholinergika oder Antihypertensiva, Medikamente, die zu zu einem trockenen Mund und damit zu reduzierter Speichelproduktion führen können. Weiters zeigen zahlreiche Publikationen, dass der Speichel auch bei verschiedenen Erkrankungen beeinflusst ist, wie Periodontitis, Parotitis, Tonsillitis, Diabetes, Schlaganfall oder auch Alzheimerdemenz.2
In unserem Labor interessieren wir uns dafür, ob Speichelanalysen ein möglicher Ansatz für eine Frühdiagnostik bei Alzheimerdemenz sein können. Speichel kann schnell und einfach gewonnen und im Labor aufgearbeitet werden. Leider zeigen unsere und andere Studien, dass die Speichelanalysen sehr heterogen sind und teilweise nicht direkt reproduzierbar. Daher ist es essenziell, Forschungen durchzuführen, um die Speichelgewinnung und Analyse zu optimieren. Wir konnten z.B. zeigen, dass Salivetten nicht geeignet sind, kleine Eiweiße zu extrahieren, oder dass Lipide im Speichel sehr instabil sind. In unseren Studien haben wir vorgeschlagen, den Speichel einfach mittels Spucken für exakt 2 Minuten in ein 50-ml-Röhrchen zu gewinnen; damit wird verhindert, dass Eiweiße verloren gehen. Der Speichel wird dann im Labor innerhalb von 3 Stunden prozessiert (siehe unten). Wir bestimmen auch das Gesamteiweiß, um die unterschiedlichen Konzentrationen des Speichels auszugleichen.
Sammeln von Speichel (Vorschlag)
-
Der Patient sollte mindestens 2 Stunden vorher keine Mundhygiene machen und nicht essen (Sinn würde es in der Früh vor dem Frühstück machen).
-
exakt 2 Minuten in ein vorgewogenes 50-ml-Falcon-Röhrchen spucken
-
im Labor innerhalb 3 Stunden aufarbeiten
-
Röhrchen wiegen und den Speichelfluss (µl/min) messen
-
zentrifugieren 3000xg 5 Minuten und Überstand abnehmen
-
in Röhrchen aufteilen und/oder sofort messen, lagern bei minus 80°C und Gesamteiweiß messen
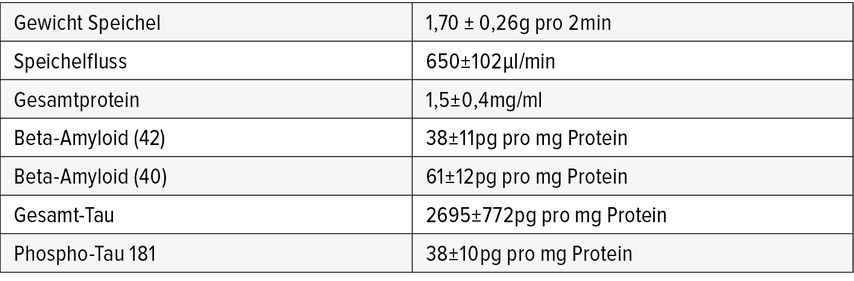
Unsere präliminären Studien zeigen, dass Speichelanalysen extrem wertvoll werden können, um die Diagnose der Alzheimerdemenz, aber auch anderer Krankheiten, zu optimieren. Bei Gehirnerkankungen stellt sich aber die Frage, wie spezifisch Aussagen über das Gehirn im Speichel sind. In der Tat ist das Gehirn über verschiedene Wege auch mit dem oralen Bereich, und damit dem Speichel, verbunden. So kommunizieren Moleküle aus dem Gehirn mit dem Speichel oder umgekehrt über 6 Wege: den kranialen Nerven, über den intranasalen Weg, über den lymphatischen Weg, über die sublinguale Route, über den peripheren Blutstrom oder über den oralen Darm-Vagus-Weg.2 Gerade die Bedeutung von Blutungen im Mundraum muss beachtet werden, da ansonsten nicht reiner Speichel gemessen wird, sondern die Verunreinigungen aus dem Blut. Hier ist es auch zielführend, Analysen über Blutkontamination (z.B. Transferrin) durchzuführen. In den Studien würde es auch Sinn machen, Entzündungsfaktoren (z.B. Interleukin 1 und 6) zu messen oder Cortisol für die zirkadiane Phase. Wir konnten in gesunden, 65 Jahre alten Menschen folgende Basiswerte im Speichel ermitteln (Tab. 2).
Ausblick
Die moderne Medizin und Labortechnik erlaubt die Messung von 100 oder 1000 Biomarkern gleichzeitig; gerade mit Proteomics können aus nur wenigen Mikrolitern zahlreiche Biomarker zur selben Zeit gemessen werden. Es laufen Studien, Biomarker aus nur 1 Tropfen Blut zu messen, so könnte es möglich werden, aus 1 Tropfen Fingerspitzenblut Diagnosen zu stellen. Sicher wird es dazu nötig sein, komplexe Analysen zahlreicher Biomarker durchzuführen und diese mittels biostatistischer oder bioinformatischer Methoden zu kombinieren und auszuwerten. Statistische Analysen mittels artifizieller Intelligenz (KI) und automatisierter Roboter werden dann schnell die Unterscheidung krankhafter Zustände erlauben. Auch sollten in Zukunft patientenspezifische Signaturen gemessen werden, die direkt auf den individuellen Patienten gerichtet sind. Abschließend aber haben wir immer noch das größte Problem zu meistern: Selbst wenn wir die besten und schnellsten Diagnosetests hätten, haben wir noch keine geeigneten Therapien, um die Alzheimerdemenz zu besiegen. Daher muss die Diagnoseforschung immer mit der Therapieforschung einhergehen.
Literatur:
● Zürcher C, Humpel C: Saliva: A challenging human fluid to diagnose brain disorders with a focus on Alzheimer‘s disease. Neural Regen Res 2023; 18: 2606-10 ● Humpel C: Identifying and validating biomarkers for diagnosing Alzheimer‘s disease. Trends Biotechnol 2011; 29(1): 26-32
Das könnte Sie auch interessieren:
Optische Kohärenztomografie bei Multipler Sklerose – wie viel ist genetisch?
Mit der optischen Kohärenztomographie kann durch die Messung retinaler Schichtatrophie die neuroaxonale Schädigung bei Multipler Sklerose erfasst werden. Eine neue Studie gibt Einblick ...
APOE und Anti-Amyloid-Therapien: Genetik im klinischen Alltag
Mit der Zulassung der ersten krankheitsmodifizierenden Therapien hat ein Paradigmenwechsel in der Behandlung der Alzheimerkrankheit begonnen. Anti-Amyloid-Antikörper können den ...
Highlights der ÖPG-Jahrestagung 2025
Vom 22. bis 24. Oktober 2025 fand die Jahrestagung der Österreichischen Parkinson-Gesellschaft in Graz statt. Tagungspräsidentin Assoc. Prof.in Dr.in Petra Schwingenschuh, Medizinische ...