Schwangerschaft & Co. bei MS
Autoren:
Dr. Klaus Berek
Dr. Franziska Di Pauli, PhD
Universitätsklinik für Neurologie
Medizinische Universität Innsbruck
Korrespondierende Autorin:
Dr. Franziska Di Pauli, PhD
E-Mail: franziska.dipauli@i-med.ac.at
Die Multiple Sklerose (MS) ist die häufigste neurologische Erkrankung des jungen Erwachsenenalters mit dem Risiko für eine bleibende Behinderung und deutlich mehr betroffenen Frauen als Männern. Da das typische Alter bei Erstmanifestation zwischen 20 und 30 Jahren liegt, spielt die Familienplanung eine große Rolle für die Betroffenen. Bei zumindest einem Drittel der Betroffenen stellt sich nach der Erstdiagnose ein Kinderwunsch ein. Somit besteht bereits bei Diagnose der Bedarf einer Beratung in Hinblick auf die künftige Familienplanung. Insbesondere besteht ein Aufklärungsbedarf über Themen wie Therapien in einer Schwangerschaft, Auswirkungen einer Schwangerschaft auf die MS, Kontrazeption oder auch über eine mögliche erbliche Komponente einer MS-Erkrankung.
Genetik und MS
Die Genese einer MS-Erkrankung ist bis heute nicht vollständig geklärt. Aktuell wird allgemein von einer multifaktoriellen Ursache mit einem Zusammenspiel aus genetischen und Umweltfaktoren ausgegangen. Hieraus erwachsen häufig Unsicherheiten bei Betroffenen und auch Angehörigen, wie etwa, ob eine MS-Erkrankung an Nachkommen vererbt werden kann, ob für andere Angehörige ein erhöhtes Erkrankungsrisiko besteht und inwiefern dies die Familienplanung beeinträchtigt.
Die genetische Komponente der MS war und ist Ziel zahlreicher genetisch-epidemiologischer Studien. Es konnte gezeigt werden, dass die erbliche Komponente einen Anteil von 30–60% an der Erkrankungsgenese hat. Das Risiko eines Kindes mit einem betroffenen Elternteil, selbst auch zu erkranken, wird auf ca. 2% geschätzt (gegenüber 0,2% bei nicht betroffenen Eltern). In Zwillingsstudien wurde eine Eineiigenkonkordanz von etwa 30% gefunden, wohingegen sich bei Zweieiigen ein Erkrankungsrisiko von ca. 5% und bei normalen Geschwistern von ca. 3% zeigte. In Studien konnten mehrere Risikogene für eine MS identifiziert werden, die allerdings alle das Risiko nur gering erhöhen und für eine individuelle Testung in der klinischen Praxis somit nicht von Bedeutung sind.
Zusammenfassend spielt eine genetische Komponente bei der MS-Genese eine wichtige Rolle, allerdings erhöht sich das Erkrankungsrisiko von Verwandten von MS-Betroffenen nur moderat.
Fertilität und Kontrazeption
Weder bei Männern noch bei Frauen mit MS besteht ein Hinweis auf eine Einschränkung der Fertilität. Allerdings muss in Einzelfällen bei einer bereits bestehenden Behinderung eine funktionelle Beeinträchtigung in Bezug auf die Familienplanung, Schwangerschaft und den Geburtsverlauf bedacht werden und diesbezüglich die Beratung erfolgen. Studien, die einen möglichen Zusammenhang zwischen Schubrisiko, MS-Verlauf und Kontrazeption untersuchen, blieben negativ. Darüber hinaus ergab sich kein Hinweis auf eine reduzierte Wirksamkeit einer Kontrazeption bei MS bzw. unter den derzeit zugelassenen krankheitsmodifizierenden Therapien, sodass eine Kontrazeption uneingeschränkt entsprechend der gynäkologischen Empfehlung durchgeführt werden kann. Bei einer Hormontherapie im Rahmen einer In-vitro-Fertilisation (IVF) wurde in kleineren Studien anschließend an die Behandlung ein erhöhtes Schubrisiko beobachtet. Die genaue Ursache hierfür ist unklar. Auch bleibt das optimale Protokoll für die IVF bei MS-Patientinnen offen und sollte hinsichtlich reproduktionsmedizinischer Gesichtspunkte gewählt werden.
MS-Krankheitsverlauf und Schwangerschaft
Eine häufige Befürchtung von MS-Patientinnen ist eine mögliche negative Beeinflussung der Schwangerschaft durch die Erkrankung oder vice versa.
Solche wechselseitigen negativen Einflüsse konnten in Studien bisher nicht nachgewiesen werden. Es wurde weder eine Häufung von Aborten, Frühgeburten oder Fehlbildungen bei MS-Patientinnen noch ein negativer Einfluss einer Schwangerschaft auf den MS-Verlauf beobachtet.
Bezugnehmend auf die Krankheitsaktivität wurde sogar ganz im Gegenteil beobachtet, dass die anhand der Schubfrequenz gemessene Krankheitsaktivität insbesondere im letzten Trimenon der Schwangerschaft sinkt. Dieses Phänomen wird mit Veränderungen des Immunsystems während der Schwangerschaft erklärt und führt zu einer maximalen Abnahme der Schubrate im dritten Trimenon um bis zu 80%. Nach der Entbindung kommt es dahingegen zu einem deutlichen Anstieg der Schubrate, welche das Niveau vor der Schwangerschaft überschreitet. Sie sinkt dann aber bis in etwa zum vierten postpartalen Monat wieder und so gleicht sich die Schubrate jener vor dem Eintreten der Schwangerschaft an.
Jedoch muss hier auf ein gewichtiges „caveat“ hingewiesen werden, da all dies primär auf unbehandelte Patientinnen zutrifft. Insbesondere ändert sich diese Einschätzung bei Patientinnen, die vor der Schwangerschaft aufgrund ihrer hohen Krankheitsaktivität eine hochwirksame krankheitsmodifizierende Therapie erhalten, da dort durchaus ein hohes Schubrisiko in der Schwangerschaft bestehen kann. Was diesbezüglich im Speziellen zu beachten ist, wird unten gesondert behandelt. Inkonsistent sind derzeit die Daten zwischen Schwangerschaft bzw. Geburt eines Kindes und dem Langzeitverlauf einer MS. Eine Verbesserung der Prognose durch die Geburt eines oder mehrerer Kinder konnte nicht in allen Untersuchungen bestätigt werden, jedenfalls aber zeigte sich kein Hinweis auf eine negative Beeinflussung.
Geburt und postpartale Phase
Ebenso wenig wie die Erkrankung die Schwangerschaft beeinflusst, beeinflusst sie die Wahl der Entbindungsform. Sowohl Kaiserschnitt als auch Epiduralanästhesie bergen bei MS-Patientinnen keine höheren Risiken als in der nicht erkrankten Bevölkerung. Beachtet werden muss wie oben erwähnt eine Einschränkung durch eine bereits bestehende Behinderung für die gewählte Entbindungsform.
Da grundsätzlich der Verlauf der MS in der Schwangerschaft günstig ist und eine krankheitsmodifizierende Therapie in den meisten Fällen nicht durchgeführt werden muss, erhält der Großteil der Patientinnen zum Geburtszeitpunkt und zu Beginn der Stillphase keine Therapie. Stillen ist von MS betroffenen, unbehandelten Müttern uneingeschränkt möglich. Die derzeit zugelassenen MS-Therapien sind in der Stillphase nicht zugelassen und es liegen nur sehr eingeschränkte Sicherheitsdaten vor. Im Falle, dass im Einzelfall ein frühzeitiger Therapiebeginn nötig ist oder die Therapie in der Schwangerschaft fortgeführt wurde, ist die Therapie bzw. ein vorzeitiges Abstillen mit der Patientin individuell zu diskutieren und gemeinsam zu entscheiden.
Schubtherapie in der Schwangerschaft und Stillphase
Auch wenn wie beschrieben die Schubrate während der Schwangerschaft abnimmt, erleidet dennoch ein Anteil der Patientinnen einen Schub in der Schwangerschaft. Prinzipiell ist bei Schüben in der Schwangerschaft eine Hochdosis-Cortison-Therapie durchaus möglich, jedoch sollte die Indikationsstellung streng erfolgen. Nach dem ersten Trimenon gilt eine Therapie als relativ unbedenklich. Im ersten Trimenon sollte jedoch aufgrund von Einzelfallberichten einer Kiefer-Lippen-Gaumen-Spaltbildung eine Hochdosis-Cortison-Therapie nur bei Schüben mit relevantem Defizit und nach ausführlicher Aufklärung der Patientin erwogen werden. Insbesondere sollten auch im 2. oder 3. Trimenon bei länger andauernden oder häufig nötigen Steroidtherapien mögliche negative Effekte (erhöhte Frühgeburtlichkeit oder fetale Wachstumsstörungen) und im Falle der Anwendung kurz vor der Geburt neonatale Anpassungsstörungen bedacht werden. Prednisolon/Methylprednisolon sind jedenfalls aufgrund einer geringeren Plazentagängigkeit gegenüber Dexamethason zu bevorzugen.
Während der Stillphase ist eine Schub-therapie mit hoch dosiertem Cortison ebenso unter strenger Indikationsstellung möglich. Die früher üblicherweise empfohlene 4-stündige Stillkarenz ist nach heutiger Datenlage nicht mehr nötig, da die über die Muttermilch aufgenommene Methylprednisolonmenge unter einer wirksamen therapeutischen Dosis liegt.
Krankheitsmodifizierende Dauertherapien und Schwangerschaft
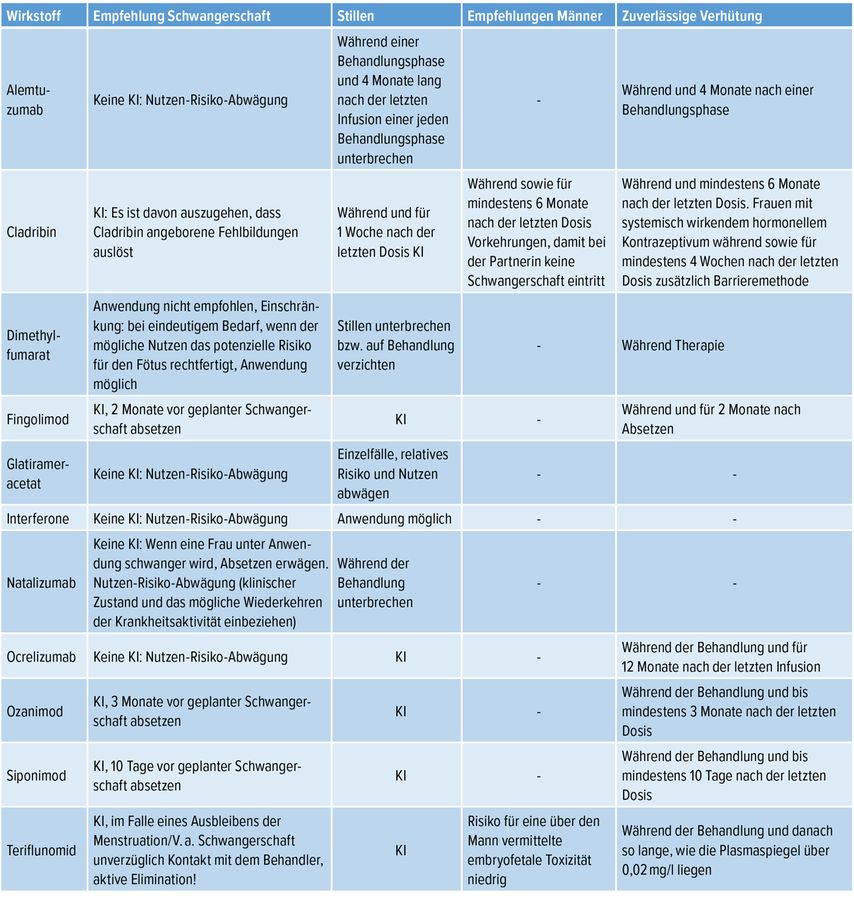
Die Komplexität dieses Themas ist die Folge einer erfreulichen Bilanz an neu zugelassenen Präparaten zur Langzeitprophylaxe bei MS. Aufgrund der diversen heute zur Verfügung stehenden Medikamente gibt es eine Vielzahl an Besonderheiten, die Beachtung finden sollten. Die jeweiligen Vorgaben der Fachinformation sind in Tabelle 1 zusammengefasst.
Tab. 1: Aktuell bei Multipler Sklerose zugelassene Therapien und ihre Anwendung in Bezug auf Familienplanung entsprechend der Fachinformation. KI: Kontraindikation
Prinzipiell sind bei Patientinnen aufgrund des günstigen Verlaufs einer MS in der Schwangerschaft krankheitsmodifizierende Therapien meist nicht nötig und entsprechend der Zulassung vor oder in der Schwangerschaft abzusetzen. Der genaue Zeitpunkt zum Absetzen variiert nach bekannter Teratogenität und entsprechend der Halbwertszeit (Tab. 1). Zusammenfassend kann festgehalten werden, dass die meisten Therapien nach derzeitiger Datenlage kontraindiziert sind oder eine eingeschränkte Zulassung in der Schwangerschaft besteht. In Einzelfällen ist eine Therapiefortführung nach entsprechender individueller Risikoabwägung mit einzelnen Substanzen bzw. Substanzklassen jedoch durchaus möglich und sinnvoll. Daher sollte bereits bei Einleitung einer entsprechenden Therapie mit der Patientin die Familienplanung besprochen werden und bei der Auswahl eines geeigneten Medikaments berücksichtigt werden. Falls im Einzelfall für eine medikamentöse Behandlung während der Schwangerschaft entschieden wird, muss in jedem Fall eine ausführliche Dokumentation über die individuelle Risikoaufklärung erfolgen.
Bei männlichen Patienten besteht außer für die Anwendung von Cladribin (siehe unten) bei den aktuell zugelassenen Medikamenten und der derzeitigen Datenlage keine Notwendigkeit für Maßnahmen, um eine Schwangerschaft bei einer Partnerin zu verhindern.
Eine Schwangerschaft unter Medikamentenexposition gilt als relativ sicher bei über 1000 beobachteten exponierten Schwangerschaften ohne nennenswerte Sicherheitssignale. Im folgenden Abschnitt werden kurz die einzelnen zugelassenen krankheitsmodifizierenden Therapien und ihre Anwendung in der Schwangerschaft zusammengefasst.
Ausreichend Daten existieren vor allem für die Gruppe der Interferone und Glatirameracetat, insbesondere für eine Exposition im ersten Trimenon. Dies hat zu einer Änderung der Zulassung geführt und eine Fortführung von Glatirameracetat bzw. Interferon kann nach einer individuellen Nutzen-Risiko-Beurteilung erwogen werden.
Die Anwendung von Dimethylfumarat wird in der Schwangerschaft nicht empfohlen, allerdings ist bei derzeit ca. 300 beobachteten exponierten Schwangerschaften eine Gabe laut Fachinformation bei eindeutigem Bedarf, wenn der mögliche Nutzen das potenzielle Risiko für den Fötus rechtfertigt, möglich. Derzeit wird von vielen Experten die Gabe bis zum Eintritt der Schwangerschaft und anschließendes, unmittelbares Absetzen favorisiert.
Für Teriflunomid liegen hingegen klare tierexperimentelle und humane Daten vor, die eine Teratogenität nachweisen. Daher besteht eine Gegenanzeige für eine Schwangerschaft und eine zuverlässige Verhütung muss angewendet werden, solange die Plasmaspiegel über 0,02% liegen. Dieser besonderen Vorgabe liegt die lange Plasmahalbwertszeit von Teriflunomid mit nachweisbaren Spiegeln bis zu 2 Jahre nach einer Behandlung zugrunde. Vor einer geplanten Schwangerschaft sind daher zwei Teriflunomid-Spiegelbestimmungen mit einem Ergebnis von unter 0,02% erforderlich. Im Mittel nimmt das eine Zeit von 8 Monaten in Anspruch. Zur beschleunigten Elimination kann bzw. soll eine aktive Elimination mit Cholestyramin angestrebt werden und wird insbesondere bei dem akzidentellen Eintritt einer Schwangerschaft klar gefordert.
Bei den hochwirksamen Therapien ist wie oben bereits erwähnt zu beachten, dass es nach aktuellem Wissen insbesondere bei Natalizumab, aber auch Fingolimod (und aufgrund eines suszipierten Klasseneffekts wahrscheinlich auch bei anderen Sphingosin-1-Phosphat-Rezeptor-Modulatoren) zu einer überschießenden Krankheitsaktivität (sogenannter „Rebound“) nach Absetzen der Behandlung kommen kann bzw. die Krankheitsaktivität zu ihrem Vortherapieniveau zurückkehren kann. Für Alemtuzumab, Ocrelizumab und Cladribin ist die diesbezügliche Datenlage zu gering, um eine Bewertung vorzunehmen. Wobei neuere Daten von CD-20-Antikörpern darauf hinweisen, dass die Krankheitsaktivität trotz Absetzen niedrig bleibt oder zumindest kein Risiko für einen „Rebound“ besteht. Um das Risiko für einen Schub in der Schwangerschaft nach einer hochwirksamen Therapie möglichst gering zu halten, scheint eine möglichst kurze Auswaschphase bedeutend zu sein. Bereits bei Beginn einer dieser Therapien bei Frauen mit Kinderwunsch in den nächsten Jahren sind diese Faktoren zu bedenken.
Eine Therapie mit Fingolimod ist in der Schwangerschaft aufgrund des Verdachts einer erhöhten Fehlbildungsrate unbedingt zu vermeiden. Vor Beginn der Therapie muss ein negativer Schwangerschaftstest vorliegen und ein Absetzen sollte 2 Monate vor Beendigung der Kontrazeption erfolgen. Da ein Klasseneffekt angenommen wird, gelten auch bei Ozanimod und Siponimod ähnliche Sicherheitsmaßnahmen, die aber aufgrund der unterschiedlichen Halbwertszeit der Substanzen und deren Metaboliten angepasst werden müssen: Im Falle von Ozanimod ist eine sichere Verhütung aufgrund der längeren Halbwertszeit seiner Hauptmetaboliten bis zu 3 Monate nach der letzten Einnahme nötig, bei Siponimod ist diese bis zu 10 Tage nach der letzten Einnahme fortzuführen.
Ähnlich wie diese Substanzgruppen ist auch Natalizumab, welches vor allem bei Frauen mit hoher Krankheitsaktivität eingesetzt wird, mit einer Rückkehr der per se hohen Schubrate, aber auch mit sogenannten „Rebound“-Phänomenen assoziiert. Hinweise auf eine erhöhte Fehlbildungsrate existieren jedoch bis dato nicht, limitierend muss allerdings gesagt werden, dass die Anzahl der exponierten Schwangerschaften, bei denen eine Gabe über das erste Trimenon hinaus erfolgte, begrenzt sind. Bei Verabreichung bis in das letzte Trimenon wurden lediglich Blutbildveränderungen (Anämie, Thrombozytopenie) beim Neugeborenen beobachtet, welche sich ohne eine spezifische Behandlung zurückbildeten. Neugeborene, deren Mütter während des dritten Schwangerschaftstrimenons Natalizumab erhalten haben, sollten auf potenzielle hämatologische Anomalien hin überwacht werden. Aufgrund des möglichen Risikos für eine Krankheitsaktivierung nach Absetzen ist aktuell nach individueller Nutzen-Risiko-Abwägung die Weiterführung der Therapie in der Schwangerschaft bzw. Fortführung bis zum positiven Schwangerschaftstest möglich. Nach Expertenmeinung wird, wenn im Einzelfall für eine Weiterführung der Therapie in der Schwangerschaft entschieden wird, ein verlängertes Dosierungsintervall von sechs Wochen und eine Gabe bis zur maximal 34. Schwangerschaftswoche empfohlen, um mögliche Blutbildveränderungen beim Neugeborenen zu vermeiden. Ein unverzüglicher postpartaler Wiederbeginn nach spätestens 2 Wochen ist empfohlen. Stillen wird nicht empfohlen, allerdings kann, da Natalizumab nur in geringen Mengen in der Muttermilch nachweisbar ist, nach strenger Abwägung in begründeten Ausnahmefällen unter der Therapie gestillt werden.
Bei dem monoklonalen Antikörper Ocrelizumab ist laut Fachinformation bis 12 Monate (EMA, FDA 6 Monate) nach Behandlungsbeendigung eine verlässliche Verhütungsmethode anzuwenden. Allerdings beträgt die Halbwertszeit nur 26 Tage und es gibt keine Hinweise auf einen teratogenen Effekt. Daher weicht die Meinung vieler Experten von der sehr strikt gehaltenen EMA-Indikation ab und eine Schwangerschaft wird 4 Monate nach dem letzten Therapiezyklus als unbedenklich eingestuft. Allerdings muss das Risiko für eine Infekthäufung durch die vorangegangene Therapie mit einer B-Zell-Depletion in Betracht gezogen werden.
Ähnliche Empfehlungen bestehen für Alemtuzumab, wo ebenfalls 4 Monate nach Behandlung eine verlässliche Verhütungsmethode anzuwenden ist. Auch hier werden die Risiken für den Verlauf der Schwanger- schaft bzw. das Ungeborene vorwiegend durch häufige Nebenwirkungen (erhöhte Infektionsgefahr und Schilddrüsenerkrankung) determiniert. Der gesamte Behandlungsplan (2 Zyklen) sollte vor einer Schwangerschaft abgeschlossen sein, da eine Unterbrechung der Therapie mit einer erhöhten postpartalen Schubrate assoziiert ist.
Bei bekannter tierexperimentell nachgewiesener Teratogenität ist Cladribin bei einer Schwangerschaft kontraindiziert und es muss während und mindestens 6 Monate nach dem letzten Behandlungszyklus eine zuverlässige Verhütungsmethode angewendet werden. Dies gilt aufgrund der zu erwartenden unerwünschten Wirkungen auf die Gametogenese auch für männliche Patienten. Als Zusatz wird Patientinnen mit systemisch wirkenden hormonellen Kontrazeptiva in den ersten 4 Wochen nach Therapie eine ergänzende Barrieremethode nahegelegt. Zusätzlich wird das Vorliegen eines negativen Schwangerschaftstests vor jedem Therapiezyklus und die Wahrung eines zeitlichen Mindestabstandes von 1 Woche zwischen Ende des Therapiezyklus und dem Stillen vorgeschrieben.
Literatur:
bei den Verfassern
Das könnte Sie auch interessieren:
Highlights der ÖPG-Jahrestagung 2025
Vom 22. bis 24. Oktober 2025 fand die Jahrestagung der Österreichischen Parkinson-Gesellschaft in Graz statt. Tagungspräsidentin Assoc. Prof.in Dr.in Petra Schwingenschuh, Medizinische ...
Neue globale Daten zur Epidemiologie von Kopfschmerzerkrankungen
Eine neue Studie des „Global Burden of Disease Collaborator“-Netzwerks hat nun die globale Krankheitslast durch die häufigsten Kopfschmerzerkrankungen beziffern können.1 Dabei fielen ...
Wie sich Antidepressiva auf Blutdruck, Cholesterin und Gewicht auswirken
Bis zu 17% der Erwachsenen in Europa und Nordamerika nehmen Antidepressiva ein, die u.a. zu Gewichtszunahme, Blutdruckveränderungen und erhöhten Cholesterin- und Leberwerten führen ...