Liquid Biopsies bei adulten diffusen Gliomen
Autorinnen:
Johanna Gesperger, PhD
Adelheid Wöhrer, MD, PhD
Medizinische Universität Wien
Universitätsklinik für Neurologie
Abteilung für Neuropathologie und Neurochemie
E-Mail:
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das Konzept der Liquid Biopsy wurde erstmals in den frühen 2010er-Jahren für den Nachweis zirkulierender Tumorzellen eingeführt und seitdem auch auf den Nachweis zirkulierender Tumor-DNA und RNA erweitert. Wie sie zur Biomarkeranalyse in der klinischen Routine eingesetzt werden könnte, wird hier beschrieben.
In den letzten Jahren wurde den Liquid Biopsies vermehrt Aufmerksamkeit geschenkt und ihr Potenzial als Biomarker für zwei onkologische Anwendungsgebiete aufgezeigt:
-
zum Screening gesunder Kontrollprobanden insbesondere auf Tumoren, die nicht durch konventionelles Screening abgedeckt werden
-
für das longitudinale Monitoring bestehender Krebserkrankungen als Prädiktoren für Prognose und Therapieansprechen1
In diesem Artikel stellen wir den aktuellen Forschungsstand, Anwendungen und Trends dieser vielversprechenden Technologie in Bezug auf adulte diffuse Gliome vor.
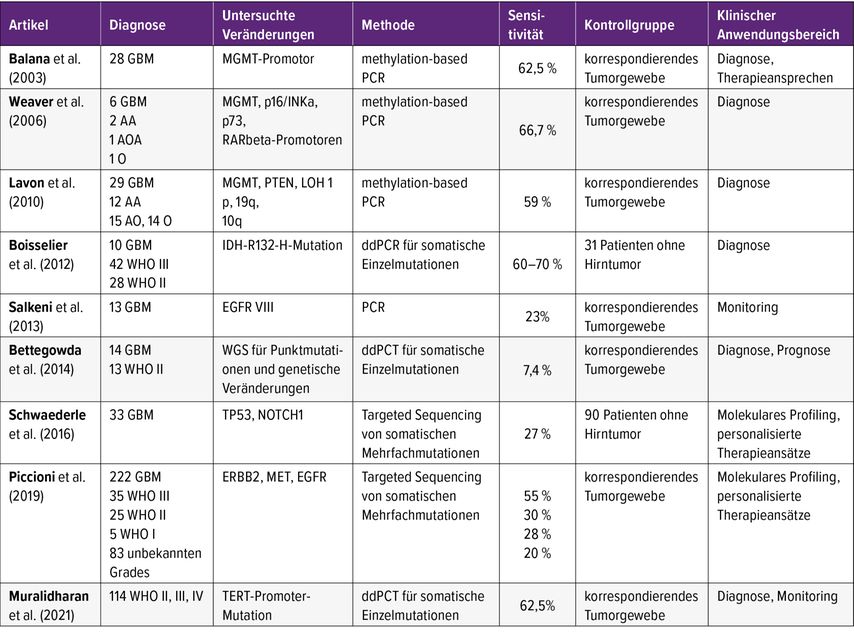
Bei Liquid Biopsies werden generell biologische Flüssigkeiten wie Blut, Liquor, Urin oder Speichel entnommen und auf tumorspezifisches Material untersucht. Dieses kann in Form von zirkulierender Tumor-DNA (ctDNA), RNA (beides häufig gebunden in extrazellulären Vesikeln [EV]wie Exosomen oder Mikrovesikeln) oder als zirkulierende Tumorzellen (CTC) vorliegen. In den letzten zehn Jahren sind umfangreiche Studien publiziert worden, die die hohe klinische Relevanz von Liquid Biopsies für verschiedene solide Tumore wie etwa Mammakarzinom, Lungenkarzinom, kolorektale Tumore sowie Melanome beschreiben.1 Primäre Hirntumore schnitten dabei deutlich schlechter ab. Dennoch ist in den letzten Jahren auch hier das Interesse an Liquid Biopsies stark gestiegen, und mehrere Studien befassten sich mit dem Nachweis zirkulierender Tumorzellen, Tumor-DNA und RNA in Blut und Liquor von Gliompatienten.2 Tabelle 1 zeigt eine Übersicht über die Studien der letzten Jahre, in denen ctDNA im Blut von Patienten mit Gliomen untersucht wurde.
Tab. 1: Übersicht über prospektive Studien, für die ctDNA aus dem Blut als Liquid Biopsy für die Detektion von Gliom-spezifischen Biomarkern untersucht wurde (modifiziert nach Boire et al., 2022)2
Technische Durchführung
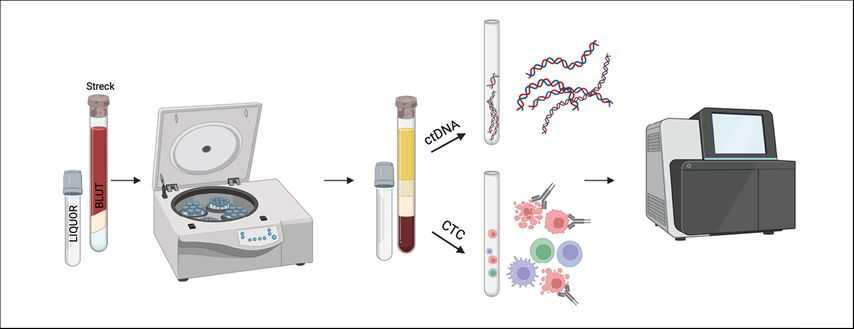
Für die Fragestellung Hirntumore und Gliome sind Blut und Liquor die bislang am häufigsten verwendeten Flüssigkeiten, wobei das Plasma dem Serum in seiner Aussagekraft meist überlegen ist. Es werden mindestens 5ml Blut benötigt, idealerweise in einem Röhrchen mit DNA-Stabilisatoren (z.B. Streck Tubes, Abb. 1). Im Anschluss sind zwei Zentrifugationsschritte nötig, um die Zellfraktion vom Plasma zu trennen und in weiterer Folge auch kleinere Reste von Zelldebris zu entfernen. Für Liquorproben hingegen ist ein niedrigerer Zentrifugationsschritt ausreichend. Während DNA aus der Plasmafraktion mittels ct-DNA isolation kits isoliert wird, verwendet man Anreicherungsmethoden, um zirkulierende Tumorzellen zu isolieren. Zu den am meisten verwendeten Nachweismethoden zählen die „real-time“ oder „digital droplet PCR“ für den Nachweis einzelner Gene, das „ultradeep NGS“ für breitere Genpanels und EPIC Arrays für den Nachweis von DNA-Methylierungsmustern.2
Abb. 1: Technische Verarbeitung von Blut und Liquor zur Gewinnung von Liquid-Biopsy-Biomarkern. Es müssen mindestens 5 ml Blut in ein Röhrchen mit DNA-Stabilisatoren abgenommen werden. Anschließend werden Plasma bzw. Serum von der zellulären Fraktion durch spezielle Zentrifugationsschritte getrennt. Danach können verschiedene Methoden zur Bestimmung von zirkulierenden Tumorzellen oder zirkulierender Tumor-DNA durchgeführt werden
Genetische Biomarker
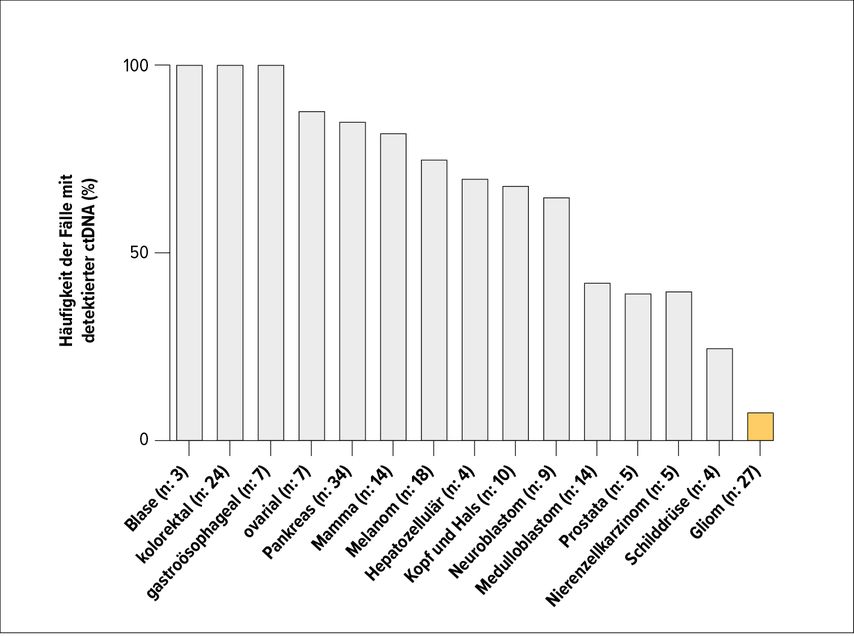
Zirkulierende Tumor-DNA kann verwendet werden, um tumorspezifische Mutationen und Genfusionen zu detektieren. Da sich DNA hauptsächlich im Kern der Tumorzellen befindet, wird diese insbesondere beim Zelltod freigesetzt, in geringerem Umfang auch bei Zellproliferationsvorgängen. Als Caveat gilt, dass die Mutationsfrequenz in den meisten primären ZNS-Tumoren relativ gering ist und sogar beim Glioblastom im Durchschnitt bei nur 74 Mutationen pro Tumor liegt. Eine weitere Herausforderung stellen Leukozyten im Blut dar, bei denen im höheren Lebensalter häufig eine klonale Hämatopoese (meist unklarer klinischer Signifikanz) vorliegt, deren Mutationen solche von soliden Tumoren im Hintergrund verschleiern können. ctDNA ist bei den meisten Patienten mit metastasierendem Krebs und einem beträchtlichen Anteil von Patienten mit lokalisierten Tumoren nachweisbar. Dabei gilt, dass nicht nur der positive Nachweis, sondern auch die Konzentration der ctDNA an sich prognostisch relevant ist. Je höher die Konzentration, umso kürzer die Überlebensdauer der Patienten. Im Gegensatz zu vielen systemischen Krebserkrankungen liegen die Detektionsraten bei Gliomen bei nur 10–55% (siehe Abb. 2).3 Grund dafür ist einerseits die Blut-Hirn-Schranke und andererseits eine niedrige Mutationsfrequenz.3
Abb. 2: Prozentuelle Häufigkeiten der diagnostizierten Tumorfälle, bei denen zirkulierende Tumor-DNA im Blut festgestellt werden konnte (modifiziert nach Bettegowda et al., 2014)3
Zu den kommerziellen Tests zum Nachweis von ctDNA zählen neben dem GRAIL4 auch der CancerSEEK-Test,5 der seit 2018 auf dem Markt ist. Der CancerSEEK umfasst mehrere tumorspezifische Gene und Proteine und weist Sensitivitäten von 69–98% (je nach Tumor) beziehungsweise eine Spezifität von 99% auf. Mittlerweile werden größere Genpanels, die in der Tumordiagnostik eingesetzt werden, in adaptierter Form auch für Liquid Biopsies angeboten. Obwohl dadurch die Nachweisraten insgesamt in den letzten Jahren stark verbessert wurden, ist die Detektion von ct-DNA-basierten Mutationen bei Gliomen nach wie vor eine Herausforderung (bis 55%). Als besonders sensitive Methode mit deutlich höheren Nachweisraten (7/8 pos. im Liquor, 10/12 in Plasma und 10/16 in Urin) wurde unlängst INVAR beschrieben.6 INVAR („INtegration of VARiant reads“) ist eine technisch und finanziell sehr aufwendige Methode, die auf einem personalisierten Fingerprint des Tumors bestehend aus Tausenden von Mutationen und Varianten beruht, um damit die Liquid Biopsies zu screenen.
Mehrere Studien sind der Frage nachgegangen, ob Liquor eine bessere Alternative zum Plasma darstellt. In einer der größten bisherigen Serien7 waren in der Rezidivsituation Gliom-spezifische Mutationen bei 42/85 Patienten mit diversen Gliomen (IDH-mutiert und IDH-Wildtyp) im Lumballiquor nachweisbar. Interessanterweise war der positive Nachweis von ctDNA nur selten mit einer positiven Liquorzytologie assoziiert. In Zusammenschau mit weiteren Studien dürften die ctDNA-Nachweisraten im Liquor insgesamt ähnlich oder etwas höher als im Plasma sein. Die Sensitivität im Liquor ist dabei abhängig von der jeweilgen Tumorlast und der Lokalisation in Bezug auf die Liquorräume. Da Lumbalpunktionen jedoch aufwendig und invasiv sind, eignen sie sich zum regelmäßigen klinischen Monitoring eher wenig.
Zirkulierende Tumorzellen sind zwar überraschenderweise auch im peripheren Blut von Gliompatienten nachweisbar (in 20–50% der Glioblastome), jedoch nicht mit dem Auftreten systemischer Metastasen oder mit dem Überleben assoziiert. Derzeit spielen sie in der Diagnostik von Liquid Biopsies eine untergeordnete Rolle.8
Epigenetische Biomarker
Der Großteil der aus Tumoren freigesetzten Kern-DNA ist nicht mutiert und daher in mutationsabhängigen Assays nicht aussagekräftig. Bei der Erstellung von DNA-Methylierungsprofilen werden im Gegensatz dazu jedoch alle ctDNA-Fragmente verwendet, weshalb sie auch für Tumoren mit geringer Mutationslast besonders sensitiv sind. Gleichzeitig kann auch die Information zur Ursprungszelle für die Tumorklassifikation genutzt werden. Zu den epigenetischen Nachweismethoden zählen das „whole genome bisulfite sequencing“ (WGBS, höchste Genauigkeit, AUC-Werte >0,99), EPIC-Arrays9 und das „cell-free methylated DNA immunoprecipitation-sequencing“ (cfMeDIP-seq).10 Erste Machine-Learning-basierte Classifier, die den Tumortyp anhand der Methylierungsmuster der cfDNA vorhersagen, erreichen sehr hohe Genauigkeiten und Detektionsraten. Einer dieser Scores, der „glioma epigenetic liquid biopsy“ oder GeLB Score,11 ist ab einem Cut-off von 49% hochsensitiv und spezifisch (beides >99%) für das Vorliegen eines Glioms, der Abgrenzung zu anderen Tumoren und nichtneoplastischen Läsionen, und auch in der Differenzierung der Pseudoprogression von einem Tumorrezidiv.
RNA-basierte Biomarker
Die Hauptvorteile der RNA-basierten Biomarker sind, dass sie einerseits organspezifisch sind und andererseits phänotypische Veränderungen der Tumorzellen widerspiegeln. Außerdem befindet sich relativ viel RNA im Zytoplasma und kann auch von lebenden Zellen freigesetzt werden. RNA-basierte Liquid Biopsies können in mRNA, miRNA (18–23 Nukleotide) oder zirkulärer RNA vorliegen und werden mehrheitlich in extrazellulären Vesikeln (EVs) transportiert.12
EVs sind in praktisch allen Körperflüssigkeiten vorhanden und können sogar die Blut-Hirn-Schranke passieren. miRNAs spielen in der Biologie von Gliomen eine wichtige Rolle und können sowohl als Onko-miR oder Tumorsuppressor-miR wirken.13 Unter den zahlreichen relevanten miRs findet sich miR21, die bei Patienten mit Glioblastom wiederholt und konsistent sowohl im Blut als auch im Liquor als erhöht gefunden worden ist.14 Die Sensitivität liegt sowohl im Blut als auch im Liquor bei 80–90% deutlich höher als bei vielen ctDNA-basierten Biomarkern. Ähnlich wie bei ctDNA und zirkulierenden Tumorzellen ist das Standardisieren der Methoden von Blutabnahme, Aufarbeitung und Auswertung eine große Herausforderung.
Fazit
Zusammengefasst stellen die Standardisierung der Blutabnahme, das Isolieren von Plasma und die entsprechenden Analysetechniken wichtige nächste Schritte dar, um Liquid Biopsies in die praktische Routine zu integrieren. Ähnlich wichtig ist ihre systematische Untersuchung innerhalb prospektiver klinischer Studien, um ihren Stellenwert zu definieren. Der Nachweis von ctDNA im Plasma von Gliompatienten gelingt mit derzeitigen Methoden, die zunehmend auf breiteren Genpanels basieren, abhängig vom jeweiligen Tumor und seiner Lage, bei etwa 50% der Fälle. Die gleichzeitige Analyse von Liquor dürfte die Sensitivität weiter erhöhen. Besonders hohe Detektionsraten mit derzeit 80–99% zeigen dabei epigenetische und microRNA-basierte Testverfahren.
Literatur:
1 Alix-Panabières, Pantel K: Cancer Discov 2021; 11(4): 858-73 2 Boire A et al.: Neuro Oncol 2019; 21(5): 571-83 3 Bettegowda C et al.: Sci Transl Med 2014; 6(224): 69-122 4 Klein EA et al.: Ann Oncol 2021; 32(9): 1167-77 5 Cohen JD et al.: Science 2018; 359(6378): 926-30 6 Wan JCM et al.: Sci Transl Med 2020; 12(548): eaaz8084 7 Miller AM et al.: Nature 2019; 565(7741): 654-58 8 Müller C et al.: Sci Transl Med 2014; 6(247): ra101 9 van der Pol Y, Mouliere F: Cancer Cell 2019; 36(4): 350-68 10 Nassiri F et al.: Nat Med 2020; 26(7): 1044- 1047 11 Sabedot TS et al.: Neuro Oncol 2021; 23(9): 1494-1508 12 Soffietti R et al.: Neuro Oncol 2022; 24(6): 855-871 13 Gustafson D et al.: Front Cardiovasc Med 2017; 4: 1-12 14 Aloizou AM et al.: Toxicol Rep 2020; 7: 1514-30
Das könnte Sie auch interessieren:
Wichtige Laborparameter bei Epilepsie: ein aktueller Überblick
Laborkontrollen sind bei Epilepsien aus verschiedensten Gründen erforderlich. Anfallssupprimierende Medikamente können Störwirkungen auf unterschiedliche Organsysteme haben, die unter ...
Alzheimer: laufende klinische Studien, State of the Art der Biomarkerdiagnostik und gemischte Pathologien
Die Forschung an neuen Therapien für die Alzheimerkrankheit (AD) erfährt ein nie dagewesenes Momentum. Auf der internationalen Alzheimer- und Parkinsonkonferenz AD/PD in Wien gab es ...
Nahrungsergänzungsmittel bei ME/CFS: neue Hoffnung oder falsche Versprechen?
Chronische Erschöpfung, die nicht vergeht, Schmerzen, Konzentrationsprobleme, ein Leben in Zeitlupe. Myalgische Enzephalomyelitis/Chronisches Fatigue-Syndrom (ME/CFS) betrifft weltweit ...