Schlaganfall-Management bei onkologischen Erkrankungen
Autoren:
Univ.-Prof. Dr. Wilfried Lang1
Dr. Thomas Töll, PhD2
1 FA für Neurologie und Psychiatrie
Sigmund Freud PrivatUniversität Wien
2 Universitätsklinik für Neurologie, Innsbruck
Korrespondenz:
E-Mail: lang@neuro-vienna.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Eine onkologische oder insbesondere hämatoonkologische Diagnose kann das Risiko für Schlaganfälle erhöhen. Medizinisches Personal sollte sich dieses Risikos bewusst sein und ein gefestigtes Wissen über Diagnostik, Therapie und Besonderheiten in der Betreuung von Patient:innen mit Krebs und Schlaganfall haben.
Keypoints
-
Bei Patient:innen mit aktiver onkologischer Erkrankung besteht neben der allgemein bekannten erhöhten Inzidenz venöser thromboembolischer Ereignisse auch ein deutlich erhöhtes Risiko für das Auftreten arterieller Ereignisse – wie des akuten Koronarsyndroms oder des ischämischen Hirninfarkts. Hierbei handelt es sich meist um Adenokarzinome oder hämatoonkologische Erkrankungen.
-
Pathophysiologisch bedeutsam ist die paraneoplastische Hyperkoagulopathie mit den Endstrecken der disseminierten intravasalen Koagulopathie und nichtbakteriellen thrombotischen Endokarditis, die sowohl laborchemisch als auch in der zerebralen Bildgebung zu typischen Konstellationen führen kann.
-
Bei Patient:innen mit aktiver Tumorerkrankung wird das Schlaganfallmanagement in allen Phasen beeinflusst – von der rekanalisierenden Akuttherapie über die diagnostische Aufarbeitung bis hin zur interdisziplinären langfristigen Betreuung.
Epidemiologie und Hintergrund
Der Großteil der ischämischen Hirninfarkte bzw. transitorischen ischämischen Attacken (TIA; per Definition Symptomdauer <24 Stunden und bildgebend nicht nachweisbare zerebrale Läsion) wird in der ätiologischen Aufarbeitung der atherosklerotischen Makro- und Mikroangiopathie sowie der kardial-embolischen Genese zugeordnet. Im Falle einer nicht zuordenbaren Schlaganfallätiologie und/oder Kombination aus bestimmten klinischen, bildgebenden und laborchemischen Konstellationen sollte eine (okkulte) onkologische Grunderkrankung als Schlaganfall-auslösender oder -begünstigender Faktor in die Differenzialdiagnostik miteinbezogen werden.
In einer großen Kohorte von Patient:innen mit onkologischer Erstdiagnose (n=279719) zeigte sich im Vergleich zu einer entsprechend ausgewählten Kontrollgruppe eine deutlich erhöhte Inzidenz ischämischer Hirninfarkte in den ersten sechs Monaten ab Diagnose von 3,0% vs. 1,6% (HR: 1,9; 95% CI: 1,8–2,0), die sich nach circa einem Jahr wieder der Normalbevölkerung anglich.1 Das höchste Schlaganfallrisiko fand sich innerhalb des ersten Monats nach Diagnosestellung.1,2
Es besteht ein hohes Risiko für frühe thrombotische Ereignisse und Rezidivschlaganfälle vor allem bei Adenokarzinomen.3 Autopsiestudien zeigen bei ca. 15% der Patient:innen mit onkologischen Erkrankungen einen (ischämischen oder hämorrhagischen) Schlaganfall. Aktive onkologische Erkrankungen (Rezidive, Metastasen, laufende Therapie) sind im Vergleich zu nichtaktiven Krebserkrankungen mit schwereren Schlaganfällen und einer erhöhten Mortalität assoziiert („in-hospital mortality“: 21,9% vs. 6,2%).4
Ebenso sind myeloproliferative Erkrankungen (insbesondere mit JAK2-Mutation) mit einem bis zu zehnfach erhöhten Risiko für ischämische zerebrale Ereignisse assoziiert und können bisweilen mit deutlichen diagnostischen Verzögerungen einhergehen.5 Pathophysiologisch spielen eine Schlaganfall-begünstigende Rolle:6,7
-
die Tumor-Koagulopathie/paraneoplastische Hyperkoagulopathie (u.a. über Gewebsfaktor-Sezernierung und -Aktivierung, Endothel- und Thrombozytenaktivierung, extrazelluläre Vesikel aus Tumorzellen, inflammatorische Zytokine, klonale Hämatopoese) mit disseminierter intravasaler Koagulopathie/Verbrauchskoagulopathie und nicht bakterieller thrombotischer Endokarditis
-
indirekte Faktoren wie das Absetzen einer vorbestehenden kardiovaskulären Sekundärprävention
-
Strahlenangiopathie
-
kardiotoxische Chemotherapeutika
-
Medikamente mit prokoagulatorischem Effekt
Klinisches Spektrum und Zusatzdiagnostik
Ein spezifisches klinisch-neurologisches Bild bei Schlaganfällen auf Basis einer onkologischen Grunderkrankung besteht nicht. Das Auftreten verhält sich analog zu den anderen Ätiologien – eher liegen schwere Schlaganfälle vor, weniger kardiovaskuläre Risikofaktoren und ein jüngeres Patient:innenalter.4,8 Die Koprävalenz von venösen Thrombosen, v.a. atypischer Lokalisation (Mesenterialvenen, Pfortader, Lebervenen, Sinusvenenthrombosen) sollte den Verdacht auf mögliche okkulte myeloproliferative Erkrankungen (MPN) lenken.
Bei MPN mit JAK2-Mutation können ischämische zerebrale Ereignisse den peripheren Blutbildveränderungen um ein bis zwei Jahre vorausgehen.9 Auch bei rezidivierenden ischämischen Hirninfarkten unter an sich suffizienter Gerinnungstherapie und nicht zuordenbarer Ätiologie sollte an mögliche MPN gedacht werden. Bei kryptogenen juvenilen Schlaganfällen in Kombination mit Coombs-negativer hämolytischer Anämie, aplastischem Syndrom oder unklaren abdominellen Symptomen sollte eine paroxysmale nächtliche Hämoglobinurie ausgeschlossen werden.10
Bei onkologischen Erkrankungen findet sich bei mehr als 70% der Patient:innen ein spezifisches Muster in der MRT (DWI-Sequenzen; „diffusion-weighted imaging“) mit multiplen, disseminierten, kleinen (<1cm) Hirninfarkten in mehreren vaskulären Territorien. Der Anteil von okkulten Tumorerkrankungen bei embolischem Infarktmuster und kryptogener Schlaganfallätiologie (trotz leitliniengerechter Ursachenabklärung) wird auf bis zu 20% geschätzt.6,8
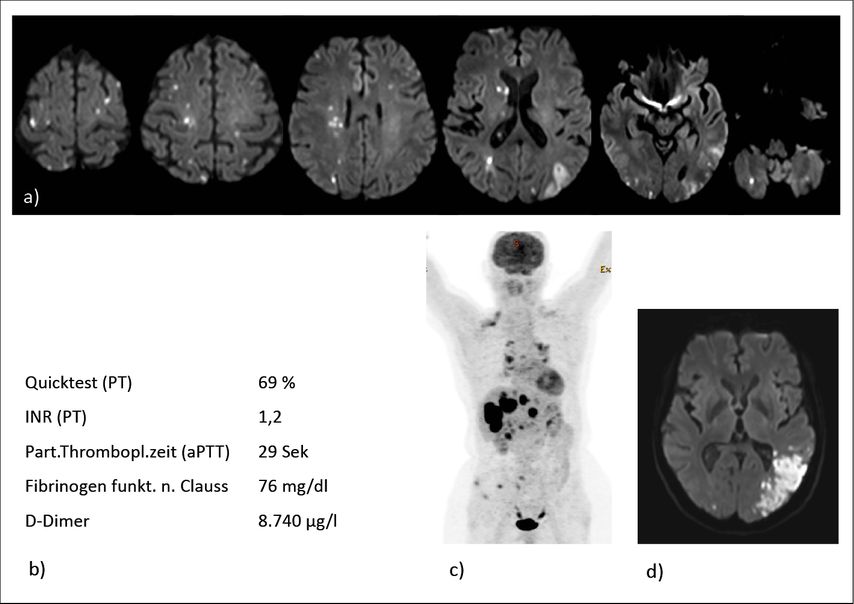
Abb. 1: Patientin, 65 Jahre, mit Aphasie und Hemianopsie (onkologische Erkrankung unbekannt, kein Nachweis einer kardialen Emboliequelle). a) cMRT-DWI-Sequenzen mit disseminierten Hirninfarkten in allen Gefäßterritorien, b) Fibrinogenverbrauch und D-Dimer-Erhöhung bei Verbrauchskoagulopathie, c) Erstdiagnose Npl. bronchi (gering diff. bronchogenes Adeno-Ca., T4 N3 M1b mit Lebermetastasen, Hirnmetastase, multiplen Knochenmetastasen), d) Schlaganfallrezidiv nach ca. vier Monaten
In der transkraniellen Dopplersonografie finden sich häufiger mikroembolische Signale als bei Personen ohne onkologische Erkrankung.6 Erhöhte D-Dimere können ebenso diagnoseweisend sein und sind vor allem mit fortgeschrittenen oder metastasierten onkologischen Erkrankungen (insb. Adenokarzinomen) assoziiert und ein prognostischer Marker.11 Erhöhte D-Dimere, Verbrauch von Fibrinogen, Gerinnungsfaktoren und Thrombozyten in Kombination mit thrombotischen Ereignissen sind Ausdruck einer chronischen disseminierten intravaskulären Koagulation.12
Akutbehandlung des ischämischen Schlaganfalls bei onkologischen Patient:innen
Als Mittel der rekanalisierenden Akuttherapie des ischämischen Hirninfarktes stehen die systemische/intravenöse Thrombolyse (IVT; Alteplase, Tenecteplase) und endovaskuläre Therapieverfahren (EVT; mechanische Thrombektomie, intraarterielle Lyse) zur Verfügung. Deren Auswahl und Kombination beruhen auf dem Ausmaß der klinischen Defizite, Zeitverläufen, dem Gefäßstatus und individuellen erweiterten bildmorphologischen Aspekten in Spezialfällen.
Endovaskuläre Therapie (EVT)
Rezente Metaanalysen und nationale Fallserien zeigen, dass die EVT bei Schlaganfallpatient:innen mit onkologischer Grunderkrankung vergleichbare Rekanalisationsraten erzielt. Auch ist das Risiko für eine intrazerebrale Blutung vergleichbar mit Personen ohne onkologische Erkrankung – das Verfahren an sich scheint somit ein vergleichbares Sicherheitsprofil zu haben. Jedoch sind die Spitalsmortalität und die 90-Tage-Mortalität höher und der Anteil an Patient:innen mit gutem funktionellem Outcome ist geringer.13–15 Diese ungünstigeren Langzeitergebnisse werden durch das hohe Risiko für frühe Schlaganfallrezidive mitbedingt.15
In die Interpretationen miteinbezogen werden muss auch, dass Patient:innen mit aktiven onkologischen Erkrankungen aus den Interventionsstudien ausgeschlossen wurden und die Daten zur EVT in diesem Kollektiv limitiert sind. Zusammenfassend wird auf Basis der aktuellen Daten die EVT prinzipiell auch bei Patient:innen mit onkologischen Erkrankungen eingesetzt, da auch hier im Vergleich zur konservativen Therapie bei Großgefäßverschlüssen von einem Nutzen auszugehen ist. Ob die ansonsten standardmäßige Kombination vonzuerst intravenöser Thrombolyse („Bridging-Therapie“) mit nachfolgender mechanischer Thrombektomie auch bei Patient:innen mit aktiver Tumorerkrankung vorteilhaft ist, kann derzeit nicht beantwortet werden und muss ebenso im Einzelfall kritisch abgewogen werden.
Intravenöse Thrombolyse (IVT)
Grundsätzlich ist der Einsatz der IVT bei onkologischer Erkrankung stets eine Abwägung von Nutzen und Risiken im Einzelfall. Blutungskomplikationen nach IVT können durch die onkologische Erkrankung selbst (Einblutung in Tumor/Metastasen, Gefäßarrosionen, Thrombozytopenie, Verbrauchskoagulopathie) oder durch die onkologische Therapie (Thrombozytopenie, vorangehende Biopsie etc.) verursacht sein.
Bei Patient:innen mit onkologischen Erkrankungen ohne zerebrale Metastasen, die eine Lebenserwartung von mehr als sechs Monaten haben, wird empfohlen, die IVT zu erwägen.16 Ein Neoplasma mit einem erhöhten Blutungsrisiko stellt laut Arzneimittelzulassung eine Kontraindikation für Alteplase und Tenecteplase dar. Bei gastrointestinalen Tumoren wird auf das lokale Blutungsrisiko hingewiesen. Allerdings fand eine große retrospektive Studie kein erhöhtes Risiko für lebensbedrohliche Blutungen.17 Thrombozytopenien im Rahmen hämatoonkologischer Erkrankungen oder Chemotherapien sind ein potenzieller Risikofaktor für Lyse-assoziierte Blutungen.
Prinzipiell stellt eine Thrombozytenzahl unter 100000/mm3 eine Kontraindikation laut Zulassung dar. Allerdings ist es eine generelle Praxis, aus Zeitgründen nicht auf den Laborbefund zu warten (insbesondere wenn die onkologische Erkrankung unbekannt ist). Es konnte auch gezeigt werden, dass eine mild bzw. mäßiggradig ausgeprägte Thrombozytopenie bei Patient:innen mit IVT gut toleriert wird.16 Anamnese bzw. klinische Zeichen einer Blutungsneigung sind daher vor Einsatz der IVT zu beachten.
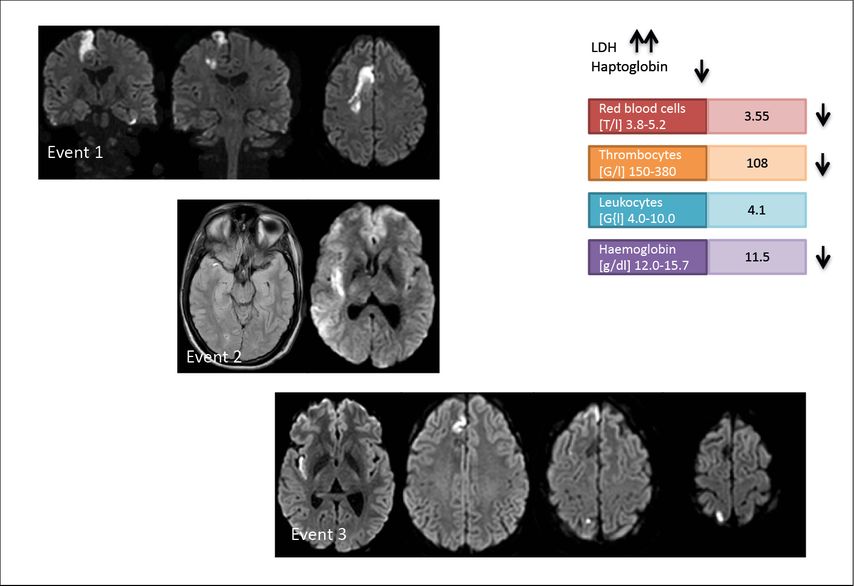
Abb. 2: Patient, 19 Jahre, mit rezidivierenden Hirninfarkten (drei Ereignisse in vier Monaten) unklarer Ätiologie (hämatologische Erkrankung noch nicht zugeordnet), cMRT-DWI-Sequenzen der zerebralen Läsionen. Exemplarische Laborbefunde mit hämolytischer Anämie und Thrombozytopenie. Erstdiagnose einer paroxysmalen nächtlichen Hämoglobinurie (GPI-AP-Defekt 16% Erythrozyten, 51% Retikulozyten, 65% Monozyten)
Von einem erhöhten intrakraniellen Blutungsrisiko beim Einsatz der IVT bei zerebralen Metastasen ist auszugehen und es ist entsprechend in der Literatur beschrieben (Schilddrüse, Chorionkarzinom, Nierenzellkarzinom, Melanom, hepatozelluläres Karzinom).18
Frühe Sekundärprävention
Prinzipiell bestimmt die Ursache (kardial-embolisch, arterio-arteriell-embolisch, atherosklerotische Mikroangiopathie, andere spezifische Ursachen, kryptogen) des Ereignisses die Wahl der frühen antithrombotischen Sekundärprävention nach TIA/ischämischem Hirninfarkt. In die Therapieentscheidung (niedermolekulare Heparine, unfraktionierte Heparine, Vitamin-K-Antagonisten, direkte orale Antikoagulanzien, Thrombozytenfunktionshemmer in Monotherapie oder kombiniert) fließen v.a. klinisches Syndrom, bildgebendes Läsionsmuster, vorangehende Akuttherapie (IVT, EVT, Stentangioplastie etc.) sowie die Begleiterkrankungen ein.
Im Falle einer für den Hirninfarkt/TIA verantwortlichen paraneoplastischen Hyperkoagulopathie oder koprävalenten venösen Thromboembolie (dadurch evtl. paradoxe Embolie) sollten die Auswahl und Dauer der Gerinnnungstherapie im interdisziplinären Setting gewählt werden; berücksichtigt werden von neuro-radiologischer Seite die zerebrale Läsionslast und ein dadurch resultierendes Einblutungsrisiko, des Weiteren spielen die onkologische Diagnose mit Blutungsrisiko, Arzneimittelinteraktionen (p-Glycoproteine, CYP3A4) und logistische Aspekte eine Rolle.
Niedermolekulare Heparine und direkte orale Antikoagulanzien (hier FX-Hemmer) scheinen den Vitamin-K-Antagonisten überlegen.7 Der Vergleich zu Thrombozytenfunktionshemmern in diesem Setting bedarf weiterer Studien.19
Literatur:
1 Navi BB et al.: Thromboembolism in patients with cancer. J Am Coll Cardiol 2017; 70(8): 926-38 2 Oberndorfer S et al.: Stroke in cancer patients: a risk factor analysis. JNeurooncol 2009; 94(2): 227 3 Navi BB et al.: Risk of arterial thromboembolism in patients with breast cancer. Thromb Res 2016; 140: S169 4 Kneihsl M et al.: Poor short-term outcome in patients with ischaemic stroke and active cancer. J Neurol 2016; 263(1): 150-6 5 De Stefano V et al.: Benefit-risk profile of cytoreductive drugs along with antiplatelet and antithrombotic therapy after transient ischemic attack or ischemic stroke in myeloproliferative neoplasms. Blood Cancer J 2018; 8(3): 25 6 Navi BB et al.: Mechanisms of ischemic stroke in patients with cancer: aprospective study. Ann Neurol 2021; 90(1): 159-69 7 Sun MY et al.: Bridging the gap in cancer-related stroke management: update on therapeutic and preventive approaches. Int J Mol Sci 2023; 24(9): 7981 8 Kim SJ et al.: Clues to occult cancer in patients with ischemic stroke. PLoS One 2012; 7(9): e44959 9 Kalala F et al.: Transient ischemic attacks as the first presentation of JAK2-V617F positive chronic myeloproliferative neoplasm. Hematol Rep 2012; 4(2): e12 10 Patriquin CJ et al.: How we treat paroxysmal nocturnal hemoglobinuria: a consensus statement of the Canadian PNH Network and review of the national registry. Eur J Haematol 2019; 102(1): 36-52 11 Schwarzbach CJ et al.: Stroke and cancer: the importance of cancer-associated hypercoagulation as a possible stroke etiology. Stroke 2012; 43(11): 3029-34 12 Levi M: Management of cancer-associated disseminated intravascular coagulation. Thromb Res 2016; 140 (Suppl. 1): S66-70 13 Aloizou AM et al.: Mechanical thrombectomy for acute ischemic stroke in patients with malignancy: a systematic review. J Clin Med 2022; 11(16): 4696 14 Duan L et al.: Outcomes after endovascular thrombectomy for acute ischemic stroke patients with active cancer: a systematic review and meta-analysis. Front Neurol 2022; 13: 992825 15 Verschoof MA et al.: A MR CLEAN Registry substudy. Neurology 2022; 98(10): e993-1001 16 Powers WJ et al.: Guidelines for the early management of patients with acute ischemic stroke: 2019 update to the 2018 guidelines for the early management of acute ischemic stroke: a guideline for healthcare professionals from the american heart association/american stroke association. Stroke 2019; 50(12): e344-418 17 Inohara T et al.: Thrombolytic therapy in older acute ischemic stroke patients with gastrointestinal malignancy or recent bleeding. Eur Stroke J 2020; 5(1): 47-55 18 Ladak AA et al.: Intravenous thrombolysis in acute ischemic stroke management in patients with active malignancies: a topical review. J Stroke Cerebrovasc Dis 2021; 30(6): 105728 19 Navi BB et al.: Enoxaparin vs aspirin in patients with cancer and ischemic stroke: the TEACH pilot randomized clinical trial. JAMA Neurol 2018; 75(3): 379-81
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...