Risikostratifizierung für SCD bei ischämischer Kardiomyopathie
Autoren:
PD Dr. med. Philipp Krisai
Mikko Mutti,diplomierter Arzt
Universitäres Herzzentrum Basel
Universitätsspital Basel
E-Mail: philipp.krisai@usb.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Trotz grosser Fortschritte in der Medizin ist der plötzliche Herztod für etwa 10–15% aller Todesfälle in Europa verantwortlich und fordert in der Schweiz somit jährlich 7000–11000 Leben.1 In etwa 75% der Fälle liegt eine ischämische Kardiomyopathie als zugrunde liegende Ursache vor.2 Dieser Artikel setzt sich kritisch mit den aktuellen Leitlinien für die Indikationsstellung zur ICD-Implantation als Primärprophylaxe des plötzlichen Herztods bei Patienten mit einer ischämischen Kardiomyopathie auseinander.
Keypoints
-
Moderne Therapiestrategien haben das Risiko des plötzlichen Herztods in den letzten Jahrzehnten deutlich reduziert.
-
Die LVEF bleibt ein wichtiger, aber alleinstehend unzureichender Prädiktor für den plötzlichen Herztod, insbesondere bei nur leicht eingeschränkter oder erhaltener Pumpfunktion.
-
Laufende Studien wie PROFID EHRA und PROTECT-ICD könnten die Risikostratifizierung und ICD-Indikationsstellung wesentlich verändern und künftige Leitlinien relevant beeinflussen.
Der Wandel des Patientenkollektivs
Die aktuellen ESC-Leitlinien empfehlen zur Primärprävention des plötzlichen Herztodes (SCD) den Einsatz eines implantierbaren Kardioverter-Defibrillators (ICD) bei Patienten mit koronarer Herzkrankheit, symptomatischer Herzinsuffizienz (NYHA II–III) und linksventrikulärer Ejektionsfraktion (LVEF) ≤35% trotz mindestens dreimonatiger optimaler medikamentöser Therapie (Klasse I, Evidenzgrad A).3 Die Evidenzbasis dieser Empfehlung stützt sich massgeblich auf die MADIT-II-Studie, in welcher die primärprophylaktische ICD-Implantation bei 742 Patienten mit ischämischer Kardiomyopathie, LVEF <30% und einem zurückliegenden Myokardinfarkt untersucht wurde. In der ICD-Gruppe zeigte sich über einen mittleren Zeitraum von 20 Monaten eine absolute Risikoreduktion der Gesamtmortalität um 5,8% (NNT: 17) und über einen Zeitraum von 8 Jahren eine durchschnittliche Lebensverlängerung von ungefähr sechs Monaten.4,5
Die Übertragbarkeit dieser Studienergebnisse aus dem Jahr 2002 auf die heutige Patientenpopulation ist jedoch möglicherweise eingeschränkt. Ein Blick auf zwei exemplarische Patienten soll dies verdeutlichen. Der durchschnittliche Studienpatient in der MADIT-II-Studie wurde im Jahr 1999 eingeschlossen, war männlich, 64-jährig und hatte kürzlich einen Myokardinfarkt erlitten, der mittels koronarer Bypassoperation therapiert wurde. Bei Einschluss betrug seine LVEF 23% und er hatte eine Medikation bestehend aus einem Betablocker, einem ACE-Hemmer, Digitalis, einem Diuretikum und einem Statin. Seine Prognose war vom arrhythmischen Risiko dominiert. Dem steht ein typischer Patient von heute mit reduzierter LVEF gegenüber, wie er beispielsweise in der DAPA-HF-Studie im Jahr 2018 eingeschlossen wurde: männlich, 66-jährig und mit Status nach Myokardinfarkt, der erfolgreich mittels perkutaner Koronarintervention behandelt wurde. Initial war seine LVEF 28%, nach drei Monaten optimaler medikamentöser Therapie (OMT) inkl. ACE-Hemmer, ARNI, SGLT2-Inhibitor, MRA und Betablocker liegt seine LVEF bei 34%.6 Der Kliniker steht nun vor der schwierigen Frage, ob der zweite Patient auf Basis der generierten Evidenz des ersten Patienten behandelt werden soll.
Diesen Wandel im Patientenkollektiv und des Risikos für SCD bestätigt eine Metaanalyse, welche während des Zeitraums von 1994–2014 bei über 40000 Patienten mit Herzinsuffizienz mit reduzierter Ejektionsfraktion (HFrEF) einen Rückgang der Rate an SCD um 44% zeigen konnte.7 Auch bei Patienten mit kürzlich erlittenem Myokardinfarkt ist unter moderner Therapie das Risiko für einen plötzlichen Herztod deutlich gesunken, wie eine Sekundäranalyse der PARADISE-MI- (Einschlüsse 2016–2020) und der VALIANT-Studie (Einschlüsse 1998–2001) zeigen konnte. Besonders auffällig war der Unterschied im ersten Monat nach akutem Myokardinfarkt, in welchem das Risiko für die kombinierte Inzidenz von SCD und reanimationspflichtigem Herzstillstand zu Zeiten von VALIANT in etwa doppelt so hoch war wie während PARADISE-MI (19,3 vs. 9,5 Ereignisse pro 100 Patientenjahre).8
Optimaler Zeitpunkt der Risikostratifizierung
Risikostratifizierung bei de novo HFrEF – nach drei Monaten noch zu früh?
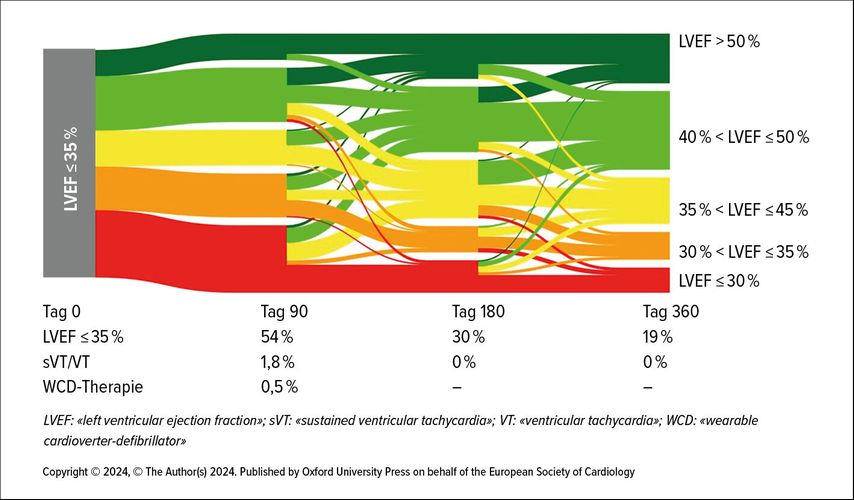
Die aktuellen Leitlinien empfehlen eine Risikostratifizierung für einen ICD nach drei Monaten optimaler medikamentöser Therapie.3 Ergebnisse der Heart Failure Optimization Study (HF-OPT) suggerieren jedoch, dass eine Risikostratifizierung nach drei Monaten OMT bei bestimmten Patienten möglicherweise zu früh ist. In dieser Beobachtungsstudie wurde bei 598 Patienten mit der Neudiagnose HFrEF (LVEF ≤35%) früh eine leitliniengerechte medikamentöse Therapie initiiert und unter dem Schutz eines tragbaren Defibrillators (WCD) kontinuierlich optimiert. Bereits nach 90 Tagen erreichten 46% der Patienten mit ischämischer Kardiopathie eine LVEF über 35%, nach 180 Tagen waren es 68% und nach 360 Tagen sogar 77% (Abb.1). In den ersten 90 Tagen kam es bei 1,8% der Patienten zu insgesamt 34 anhaltenden Episoden an ventrikulärer Tachykardie (VT) oder Kammerflimmern (VF), nach diesem Zeitraum wurde nur noch eine Episode einer nicht anhaltenden VT beobachtet. Diese Ergebnisse zeigen, dass sich die LVEF bei vielen Patienten auch über die ersten drei Monate hinaus weiter verbessert, wodurch im Zeitverlauf immer weniger Patienten das LVEF-Kriterium für eine ICD-Indikation erfüllen. Dies geschieht ohne erhöhtes Risiko für maligne ventrikuläre Arrhythmien in diesem Zeitraum.9
Abb. 1: Sankey-Diagramm der individuellen LVEF-Veränderung von Tag 0 bis Tag 360 bei Patienten mit ischämischer Kardiomyopathie (n=236) (modifiziert und ins Deutsche übersetzt nach Veltmann C et al.: Therapy duration and improvement of ventricular function in de novo heart failure: the Heart Failure Optimization study. Eur Heart J 2024; 45: 2771-81; https://doi.org/10.1093/eurheartj/ehae334; open access article distributed under the terms of the Creative Commons CC BY license )9
Risikostratifizierung nach Myokardinfarkt – ist frühzeitig besser?
Obwohl das Risiko für einen SCD oder eine Reanimation wegen Herzstillstands in den ersten 30 Tagen nach einem Myokardinfarkt ungefähr achtfach erhöht ist im Vergleich zu nach einem Jahr, empfehlen die aktuellen Leitlinien basierend auf zwei Studien keine frühzeitige primärprophylaktische ICD-Implantation nach Myokardinfarkt.3,10 In der DINAMIT-Studie war eine ICD-Implantation im Zeitraum von 6–40 Tagen nach Myokardinfarkt bei Patienten mit einer LVEF ≤35% und reduzierter Herzrhythmusvariabilität zwar mit einer Reduktion der Todesrate durch Arrhythmien assoziiert, konnte jedoch aufgrund einer erhöhten Rate an nicht arrhythmischen Todesfällen keine Reduktion der Gesamtmortalität nachweisen.11 Diese Ergebnisse wurden durch die IRIS-Studie bei Patienten mit zusätzlichen Risikofaktoren bestätigt.12 Beide Studien waren jedoch aufgrund einer relativ geringen Ereigniszahl, einer selektiven Patientenauswahl und der damals noch nicht optimierten medikamentösen Therapien bei HFrEF limitiert, sodass eine Reevaluation einer frühzeitigen ICD-Implantation bei ausgewählten Hochrisikopatienten Sinn macht. Die multizentrische, randomisierte PROTECT-ICD-Studie (NCT03588286) untersucht aktuell, ob eine programmierte ventrikuläre Stimulation früh nach Myokardinfarkt bei Patienten mit einer LVEF ≤40% hilft, Hochrisikopatienten für eine ICD-Implantation gezielter zu identifizieren.13
Art der Risikostratifizierung?
Neben der NYHA-Klasse stellt die LVEF derzeit das wichtigste Entscheidungskriterium für oder gegen eine ICD-Implantation dar, obwohl uns mittlerweile zahlreiche Biomarker und fortgeschrittene bildgebende Verfahren zur Verfügung stehen, welche die Risikostratifizierung potenziell verbessern könnten. Zusätzlich ist bekannt, dass Patienten mit einer LVEF ≤35% zwar das höhere relative Risiko für einen SCD haben, in absoluten Zahlen jedoch die Mehrzahl der SCD bei Patienten mit einer LVEF >35% auftritt.14
Das internationale PROFID-Projekt widmet sich diesen Fragestellungen. In einer Analyse von über 140000 Patienten aus 20 internationalen Datensätzen wurde untersucht, ob die Risikostratifizierung über die LVEF hinaus verbessert werden kann, insbesondere bei Patienten mit einer LVEF >35%. Die Ergebnisse waren jedoch ernüchternd: Weder die LVEF alleine noch in Kombination mit anderen klinisch verfügbaren Parametern konnte sich als zuverlässiger Prädiktor für einen SCD oder eine adäquate ICD-Therapie behaupten. In einer Subanalyse zeigte auch eine kardiale Magnetresonanztomografie keinen zusätzlichen prädiktiven Nutzen. Die C-Statistiken der getesteten Prädiktionsmodelle lagen in allen untersuchten Gruppen (LVEF stark reduziert, moderat reduziert oder erhalten) zwischen 0,5 und 0,6 und entsprechen somit einer Risikovorhersage nahe dem Zufallsniveau, beispielsweise per Münzwurf. Zusätzlich hat die Studie gezeigt, dass die Eventraten in den untersuchten Populationen ohne ICD sehr gering sind: Nach 36 Monaten erlitten 3,41% der Patienten mit einer LVEF ≤35% und 0,87% derjenigen mit einer LVEF >35% einen plötzlichen Herztod. Eine wesentliche Limitation der PROFID-Analyse liegt jedoch in der grossen Heterogenität der eingeschlossenen Datensätze. Unterschiede in Studiendesigns, verfügbaren Variablen sowie verwendeten MRI-Protokollen schränken die Aussagekraft der Ergebnisse erheblich ein.15
Angesichts des in den letzten 20 Jahren rückläufigen arrhythmischen Risikos in einem veränderten Patientenkollektiv ist es sinnvoll, primärprophylaktische ICD-Studien zu wiederholen. In der aktuell laufenden PROFID-EHRA-Studie (NCT05665608) werden Patienten nach Myokardinfarkt, die gemäss den aktuellen Leitlinien eine ICD-Indikation haben, randomisiert einer OMT ohne ICD oder einer OMT mit ICD zugeteilt, mit dem primären Endpunkt der Gesamtmortalität. Die PROFID-EHRA-Studie untersucht darüber hinaus das Potenzial neuer Marker zur personalisierten Risikovorhersage des SCD sowie den Einsatz künstlicher Intelligenz zur Analyse von 12-Kanal-EKG.16
Fazit und Einordnung der Leitlinien
Gemäss den aktuellen ESC-Leitlinien wird bei Patienten mit koronarer Herzkrankheit, einer symptomatischen Herzinsuffizienz (NYHA II–III) und einer LVEF ≤35% trotz mindestens dreimonatiger optimaler medikamentöser Behandlung die Implantation eines ICD zur Primärprävention des SCD empfohlen.3 Bei genauerer Betrachtung der Evidenz hinter den Leitlinien und im Kontext neuerer Studien wird jedoch deutlich, dass die Übersetzung dieser Empfehlung in die aktuelle klinische Realität oft nicht so einfach ist, wie sie auf den ersten Blick erscheint.
Das Patientenkollektiv hat sich in den letzten zwei Jahrzehnten wesentlich gewandelt und das absolute Risiko für einen plötzlichen Herztod bei ischämischer Kardiomyopathie ist heute deutlich geringer als zur Zeit von MADIT-II. Diese Entwicklung wird am ehesten durch verbesserte Reperfusionsstrategien sowie den Einsatz moderner Herzinsuffizienztherapien erklärt.
Die Risikostratifizierung des SCD bei Patienten mit ischämischer Kardiomyopathie ist und bleibt ein spannendes Feld, welches in den kommenden Jahren von neuen Daten profitieren wird. Sowohl der optimale Zeitpunkt als auch neue Möglichkeiten zur Risikostratifizierung beispielsweise mit genetischen Markern oder KI-basierten EKG-Analysen sind Gegenstand intensiver Forschung. Die mit Spannung erwarteten Ergebnisse der Studien PROFID EHRA und PROTECT-ICD könnten in den kommenden Jahren die Leitlinienempfehlungen relevant beeinflussen.
Bis dahin bleibt die sorgfältige, patientenindividuelle Nutzen-Risiko-Abwägung entscheidend, dies unter Berücksichtigung der aktuellen Leitlinien, der klinischen Situation im Kontext neuer wissenschaftlicher Evidenz und des individuellen Patientenwillens. Nur so lässt sich im Spannungsfeld zwischen Über- und Unterversorgung eine qualitativ hochwertige und verantwortungsvolle Versorgung gewährleisten.
Literatur:
1 Lynge TH et al.: Nationwide burden of sudden cardiac death: a study of 54,028 deaths in Denmark. Heart Rhythm 2021; 18: 1657-65 2 Fox CS et al.: Temporal trends in coronary heart disease mortality and sudden cardiac death from 1950 to 1999: the Framingham Heart Study. Circulation 2004; 110: 522-7 3 Zeppenfeld K et al.: 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: developed by the task force for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death . Eur Heart J 2022; 43: 3997-4126 4 Moss AJ et al.: Prophylactic implantation of a defibrillator in patients with myocardial infarction and reduced ejection fraction. N Engl J Med 2002; 346: 877-83 5 Goldenberg I et al.: Long-term benefit of primary prevention with an implantable cardioverter-defibrillator: an extended 8-year follow-up study of the Multicenter Automatic Defibrillator Implantation Trial II. Circulation 2010; 122: 1265-71 6 McMurray JJV et al.: Dapagliflozin in patients with heart failure and reduced ejection fraction. N Engl J Med 2019; 381: 1995-2008 7 Shen L et al.: Declining risk of sudden death in heart failure. N Engl J Med 2017; 377: 41-51 8 Curtain JP et al.: Rates of sudden death after myocardial infarction - insights from the VALIANT and PARADISE-MI trials. JAMA Cardiol 2024; 9: 928-33 9 Veltmann C et al.: Therapy duration and improvement of ventricular function in de novo heart failure: the Heart Failure Optimization study. Eur Heart J 2024; 45: 2771-81 10 Solomon SD et al.: Sudden death in patients with myocardial infarction and left ventricular dysfunction, heart failure, or both. N Engl J Med 2005; 352: 2581-8 11 Hohnloser SH et al.: Prophylactic use of an implantable cardioverter-defibrillator after acute myocardial infarction. N Engl J Med 2004; 351: 2481-8 12 Steinbeck G et al.: Defibrillator implantation early after myocardial infarction. N Engl J Med 2009; 361: 1427-36 13 Zaman S et al.: Programmed Ventricular Stimulation to Risk Stratify for Early Cardioverter-Defibrillator Implantation to Prevent Tachyarrhythmias following Acute Myocardial Infarction (PROTECT-ICD): trial protocol, background and significance. Heart Lung Circ 2016; 25: 1055-62 14 Stecker EC et al.: Population-based analysis of sudden cardiac death with and without left ventricular systolic dysfunction: two-year findings from the Oregon sudden unexpected death study. J Am Coll Cardiol 2006; 47: 1161-6 15 Peek N et al.: Sudden cardiac death after myocardial infarction: individual participant data from pooled cohorts. Eur Heart J 2024; 45: 4616-26 16 Prevention Of Sudden Cardiac Death After Myocardial Infarction by Defibrillator Implantation (PROFID EHRA). https://clinicaltrials.gov/study/NCT05665608 ; zuletzt aufgerufen am 27.8.2025
Das könnte Sie auch interessieren:
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
Antibiotika bei Endokarditis: ambulante Fortsetzung der stationären Therapie
Nach einer erfolgreichen initialen stationären, parenteralen Antibiotikatherapie besteht bei vielen Patient:innen mit bakterieller Endokarditis die Option einer ambulanten ...