Was bedeuten die neuen Leitlinien für die Praxis?
Bericht:
Mag. pharm. Irene Senn, PhD
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Mit den 2023 veröffentlichten ACR/CHEST-Empfehlungen liegen erstmals systematische Handlungsanweisungen für Screening, Monitoring und Therapie der interstitiellen Lungenerkrankung (ILD) bei rheumatischen Erkrankungen vor. Aufgrund der begrenzten Evidenzbasis enthalten sie jedoch zahlreiche „bedingte Empfehlungen“, was zu Unsicherheiten in der klinischen Praxis führen kann. Dr. Kastriot Kastrati diskutierte diese Herausforderungen im Rahmen der ÖGR-Jahrestagung in Wien.
Die interstitielle Lungenerkrankung (ILD) stellt aufgrund ihrer Seltenheit und unspezifischer Symptomatik weiterhin eine diagnostische Herausforderung dar. Durchschnittlich vergehen 15,5 Monate zwischen dem Auftreten erster Symptome und der ILD-Diagnose. Etwa jeder sechste Patient (17,4%) erhält initial eine Fehldiagnose – am häufigsten wird fälschlicherweise eine COPD diagnostiziert.1
Prävalenz und Manifestationsmuster
Ein wichtiger Aspekt bei der diagnostischen Einordnung ist die Grunderkrankung der Patienten, denn je nach Art der rheumatischen Erkrankung variiert das Risiko für eine ILD erheblich. Dabei unterscheiden sich nicht nur die Prävalenzraten, sondern auch die charakteristischen radiologischen Muster. Während bei der rheumatoiden Arthritis (RA) meist ein UIP-Muster (gewöhnliche interstitielle Pneumonie) dominiert, sind bei systemischer Sklerose (SSc) und idiopathischer inflammatorischer Myositis (IIM) häufiger NSIP-Muster (unspezifische interstitielle Pneumonie) zu finden. Das Sjögren-Syndrom (SjS) ist hingegen typischerweise mit einer lymphozytären interstitiellen Pneumonie (LIP) assoziiert.2
Systematisches Screening und Risikostratifizierung
Basierend auf diesen unterschiedlichen Prävalenzraten und Manifestationsmustern empfehlen die ACR/CHEST-Leitlinien des American College of Rheumatology (ACR) und des American College of Chest Physicians (CHEST) eine systematische Risikostratifizierung für das ILD-Screening bei systemischen Autoimmunerkrankungen (SARD).3 Die Entscheidung für ein Screening basiert auf demografischen, serologischen und klinischen Risikofaktoren. Zu den demografischen Risikofaktoren zählen männliches Geschlecht und höheres Alter (bei RA und SjS) sowie eine frühe Krankheitsmanifestation (bei SSc). Serologisch sind spezifische Autoantikörper relevant: Scl-70-Antikörper (bei SSc), Anti-Synthetase- und Anti-MDA-5-Antikörper (bei IIM) sowie Rheumafaktoren und Anti-CCP-Antikörper (bei RA). „Wichtig ist, dass Myositisantikörper nicht zwingend antinukleäre Antikörper sind“, betonte Kastrati. Die für ILD relevanten Antikörper können im Zytoplasma lokalisiert und damit im ANA-Test negativ sein. Ein negativer ANA-Test schließt damit eine rheumatische ILD also nicht aus.
Für das Screening empfehlen die ACR/CHEST-Leitlinien eine Kombination aus Lungenfunktionstest (PFT) und hochauflösender Computertomografie (HRCT), da diese Methode die höchste Sensitivität und Spezifität aufweist. Ein alleiniger PFT weist eine zu geringe Zuverlässigkeit auf und ist daher nicht ausreichend.4 Röntgenuntersuchungen, 6-Minuten-Gehtest und Bronchoskopie werden in den Leitlinien nicht empfohlen.
Verlaufskontrolle und Progressionskriterien
An das initiale Screening schließt sich als wesentlicher Bestandteil des Managements eine systematische Verlaufskontrolle an. Die ACR/CHEST-Leitlinien empfehlen zur Überwachung regelmäßige Lungenfunktionsprüfungen (PFT) und ein bedarfsadaptiertes HRCT-Monitoring. Bei unauffälligem initialem Screening sollten Patienten mit hohem Risiko jährlich nachuntersucht werden.3 Die Sinnhaftigkeit dieser Empfehlung wird durch eine rezente Registerstudie bestätigt, die zeigt, dass bei SSc-Patienten die Inzidenz der ILD über einen Zeitraum von zehn Jahren konstant bleibt.5 Bei bestätigter ILD-Diagnose sollten in den ersten Monaten häufigere PFTs durchgeführt werden. „Die in den Leitlinien empfohlene ambulante Entsättigungsmessung machen wir nicht, es gibt zu wenig Evidenz dazu. Ich persönlich würde hier stattdessen die respiratorische Symptomatik ergänzen“, kommentierte Kastrati.
Für die Definition der ILD-Progression existieren verschiedene Kriterien. Die PPF-Kriterien bewerten einen Zeitraum von zwölf Monaten und fordern eine Verschlechterung in mindestens zwei von drei Domänen (respiratorische Symptome, Lungenfunktion, radiologische Progression). Die INBUILD-Kriterien hingegen betrachten 24 Monate und berücksichtigen zusätzlich Kombinationen aus moderatem FVC-Abfall und klinischer Verschlechterung. In der klinischen Praxis erweisen sich jedoch die radiologischen Veränderungen im HRCT als der am häufigsten erfüllte Parameter für eine Progression, gab Kastrati zu bedenken.
Aktuelle therapeutische Strategien
Die therapeutischen Optionen für SARD-assoziierte ILD haben sich in den vergangenen zwei Jahrzehnten erheblich erweitert. Während vor 2007 nur etwa 14% der ILD-Patienten eine spezifische Therapie erhielten, stieg dieser Anteil nach 2016 auf 57% – insbesondere durch den vermehrten Einsatz von Mycophenolat.6
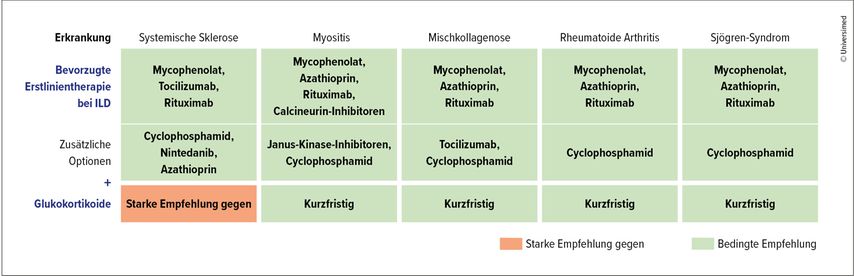
Die ACR/CHEST-Leitlinien basieren auf limitierter Evidenz, geben aber dennoch klare Therapieempfehlungen (Abb.1): Mycophenolat wird als Erstlinientherapieoption bei allen SARD-assoziierten ILD empfohlen, ebenso Azathioprin (mit Ausnahme der SSc-ILD). Die starke Empfehlung gegen Glukokortikoide bei SSc-ILD gründet auf dem bekannten Risiko für renale Krisen.7 Für die SSc-ILD stehen zusätzliche Therapieoptionen zur Verfügung: Tocilizumab erhielt auf Basis der fokusSSced-Studie, die einen signifikant geringeren FVC-Verfall im Vergleich zu Placebo zeigte, eine bedingte Empfehlung.8 Auch die Kombinationstherapie von Nintedanib und Mycophenolat wird bedingt empfohlen – basierend auf der SENSCIS-Studie. Eine Post-hoc-Analyse bestätigte einen geringeren FVC-Verlust unter der Kombination im Vergleich zur Mycophenolat-Monotherapie.9 „Insgesamt wird dem Kliniker jedoch sehr viel Spielraum überlassen, ohne klare Empfehlungen zu geben“, resümierte Kastrati.
Infektionsprophylaxe und Transplantation
Neben den spezifischen Therapieoptionen betonen die britischen Leitlinien zudem die Bedeutung supportiver Maßnahmen, insbesondere des Infektionsmanagements.10 „Die Tatsache, dass 75% der respiratorischen Todesursachen bei ILD-Patienten auf Infektionen zurückzuführen sind, unterstreicht die Bedeutung einer konsequenten Impfprophylaxe gegen Pneumokokken, Influenza und Covid-19“, machte Kastrati deutlich.
Für Patienten mit schweren oder therapierefraktären Verläufen muss die Option einer Lungentransplantation evaluiert werden. Eine aktuelle Konsensus-Publikation definiert hierfür Kriterien, die für die Evaluation hilfreich sein könnten: Als Kontraindikation wird beispielsweise bei SSc-Patienten etwa eine schwerwiegende gastrointestinale Beteiligung angeführt.11
Fazit
Die ACR/CHEST-Leitlinien 2023 bieten erstmals einen systematischen Rahmen für das Management der ILD bei rheumatischen Erkrankungen. Trotz der überwiegend niedrigen Evidenzqualität und zahlreicher bedingter Empfehlungen ermöglichen sie eine Orientierung für den klinischen Alltag. Die für 2025 erwarteten europäischen Leitlinien werden möglicherweise neue Akzente bei der Bewertung verschiedener diagnostischer und therapeutischer Strategien setzen.
Quelle:
Jahrestagung der Österreichischen Gesellschaft für Rheumatologie & Rehabilitation (ÖGR), 28.–30. November 2024, Wien
Literatur:
1 Spagnolo P et al.: Patient journey, disease burden and treatment paradigms in patients with interstitial lung disease with progressive pulmonary fibrosis in Europe. Am J Respir Crit Care Med 2024; A7297 2 Joy GM et al.: Prevalence, imaging patterns and risk factors of interstitial lung disease in connective tissue disease. Eur Respir Rev 2023; 32(167) 3 Johnson SR et al.: 2023 American College of Rheumatology (ACR)/American College of Chest Physicians (CHEST) Guideline for the screening and monitoring of interstitial lung disease in people with systemic autoimmune rheumatic diseases. Arthritis Care Res 2024; 76(8): 1070-82 4 Suliman YA et al.: Brief Report: Pulmonary function tests: high rate of false-negative results in the early detection and screening of scleroderma-related interstitial lung disease. Arthritis Rheumatol 2015; 67(12): 3256-61 4 Bruni C et al.: OP0019 Incidence and risk factors for new onset interstitial lung disease in systemic sclerosis: insights from an analysis of the EUSTAR cohort. Ann Rheum Dis 2024; 83(Suppl 1): 66 6 Campochiaro C et al.: OP0225 Changes in treatment patterns and their influence on the outcome of systemic sclerosis-interstitial lung disease (ssc-ild) patients. Annals of the Rheumatic Diseases 2024; 83: 175 7 Johnson SR et al.: 2023 American College of Rheumatology/American College of Chest Physicians Guideline for the Treatment of Interstitial Lung Disease in People with Systemic Autoimmune Rheumatic Diseases. Arthritis Care Res (Hoboken) 2024; 76(8): 1051-69 8 Khanna D et al.: Tocilizumab in systemic sclerosis: a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Respir Med 2020; 8(10): 963-74 9 Distler O et al.: Nintedanib for systemic sclerosis–associated interstitial lung disease. New England Journal of Medicine 2019; 380(26): 2518-28 10 Denton CP et al.: The 2024 British Society for Rheumatology guideline for management of systemic sclerosis. Rheumatology 2024; 63(11): 2956-75 11 Crespo MM et al.: ISHLT consensus document on lung transplantation in patients with connective tissue disease. J Heart Lung Transplant 2021; 40(11): 1251-66
Das könnte Sie auch interessieren:
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
Antibiotika bei Endokarditis: ambulante Fortsetzung der stationären Therapie
Nach einer erfolgreichen initialen stationären, parenteralen Antibiotikatherapie besteht bei vielen Patient:innen mit bakterieller Endokarditis die Option einer ambulanten ...