Mykosen der Nasennebenhöhlen
Autor:innen:
Dr. Veronika Rupprechter
Abteilung für Hals-, Nasen- und Ohrenheilkunde
KABEG Klinikum Klagenfurt
E-Mail: veronika.rupprechter@kabeg.at
Dr. Julian Kleinknecht
Abteilung für Hals-, Nasen- und Ohrenheilkunde
KABEG Klinikum Klagenfurt
E-Mail: julian.kleinknecht@kabeg.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Wir wollen einen Überblick über Pilzinfektionen der Nasennebenhöhlengeben, insbesondere über invasive Formen sowie deren Komplikationen, und anschließend über eine unserer Patient:innen mit einer invasiven Nasennebenhöhlenmykose berichten.
Keypoints
-
Das Immunsystem ist der wichtigste Einflussfaktor für den Verlauf von Pilzsinusitiden.
-
SARS-CoV-2-Infektionen dürften begünstigend für die Entwicklung von invasiven Nasennebenhöhlenmykosen sein.
-
Die Therapie der Pilzsinusitis richtet sich nach dem Erkrankungsbild. Während die Behandlung der nichtinvasiven Mykose meist unkompliziert mittels operativer Sanierung behoben ist, stellt sich die Behandlung der invasiven Mykose als langwierige und oft nicht zufriedenstellende Therapie heraus.
Während der SARS-CoV-2-Pandemie beobachteten wir an unserer Abteilung vielfach ausgeprägte Pilzinfektionen der Nasennebenhöhlen und insbesondere gehäuft Pilzinfektionen der Keilbeinhöhle. Zusätzlich sahen wir zwei Fälle einer invasiven Mykose der Nasennebenhöhlen mit orbitaler Beteiligung und Erblindung. Dieser Anstieg der Pilzinfektionen im Zusammenhang mit der SARS-CoV-2-Pandemie wird auch in anderen Zentren bzw. in der Literatur beschrieben.
Die Pilzsinusitis
Pilzsporen sind allgegenwärtig und werden kontinuierlich eingeatmet. Eine Pilzsinusitis bezeichnet ein sehr breites Spektrum an Erkrankungen. Es reicht von einer symptomlosen Pilzbesiedelung der Atemwege bis hin zur lebensbedrohlichen Infektion mit Ausbreitung über die Grenzen der Atemwege hinaus. Das Ausmaß der Entzündung ist eng mit dem Immunsystem des Betroffenen verknüpft.1
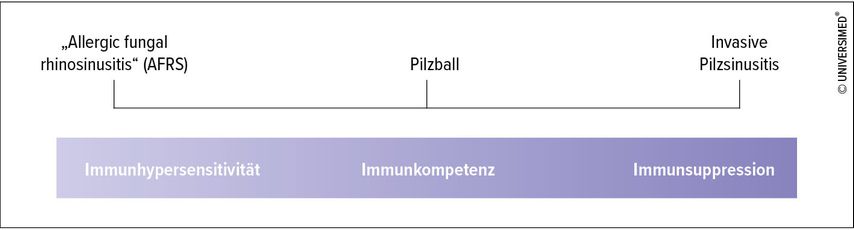
Deshalb wird durch die EPOS 2020 Guidelines die Pilzsinusitis anhand ihrer Interaktion mit dem Immunsystem in drei Phänotypen (Abb. 1) eingeteilt:2
„allergic fungal rhinosinusitis“ (AFRS): bei Hypersensitivität des Immunsystems
-
Pilzball: bei Immunkompetenten
invasive Mykose: bei Immunsupprimierten
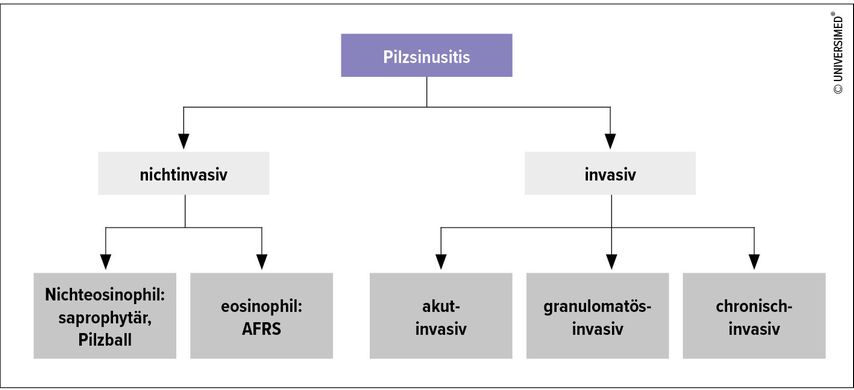
Allgemein kann man Pilzsinusitiden in nichtinvasive und invasive Infektionen unterteilen (Abb. 2).
Nichtinvasive Pilzsinusitis
Die nichtinvasive Form wird unterteilt in:1–3
-
saprophytäre Pilzbesiedelung: tritt bei eingeschränkter mukoziliärer Clearance auf (z.B. zystische Fibrose)
-
kompaktes Pilzmyzel bzw. Pilzball: kommt vornehmlich in der Kieferhöhle, gelegentlich auch in der Keilbeinhöhle, vor. Es zeigen sich dicht angesammelte Pilzhyphen und eine umgebende nichteosinophile Entzündungsreaktion. Die Genese wird hauptsächlich als dentogener Art angenommen.
-
eosinophile Pilzsinusitis oder auch „allergic fungal rhinosinusitis“ (AFRS): wird in den EPOS 2020 Guidelines als Sonderform der chronischen Sinusitis mit nasalen Polypen gewertet. 5–10% der chronischen Rhinosinusitiden werden der AFRS zugrunde gelegt. Pathognomisch besteht eine IgE-vermittelte Hypersensitivität der Mukosa gegenüber Pilzantigen.
Invasive Pilzsinusitis
Die invasive Pilzsinusitis wird eingeteilt in:1, 3
-
akut-invasive Pilzsinusitis: tritt vornehmlich bei Immunsupprimierten auf. Es zeigt sich eine Invasion der Pilzhyphen in das umliegende Gewebe und Gefäße mit Gewebsnekrosen. Meist wird die Infektion ausgelöst durch Aspergillus oder Mucor. Die Letalität liegt bei 20–50%.
-
granulomatös-invasive Pilzsinusitis: Granulombildung, gehäuftes Vorkommen in Indien und Pakistan. Häufigster Erreger ist Aspergillus flavus. Die Letalität liegt bei 15%.
chronisch-invasive Pilzsinusitis: Die Infektion verläuft langsamer (>4 Wochen). Der meist nachweisbare Erreger ist Aspergillus fumigatus. Die Betroffenen weisen meist eine leichte Immunsuppression auf (z.B. bei Diabetes mellitus, Glukokortikoidtherapie). Die Letalität liegt bei etwa 40%.
Min Young Seo et al. propagieren zusätzlich die Einführung einer neuen Form der Pilzsinusitis: die sogenannte „microinvasive fungal rhinosinusitis“. Sie beschreiben Fälle von Pilzballsinusitiden mit histologischer Schleimhautinvasion, aber ohne Angioinvasion. Der nachweisbare Erreger war ausschließlich Aspergillus fumigatus.4
Symptomatik
Die nichtinvasive Pilzsinusitis kann asymptomatisch verlaufen. Ebenso können sich Symptome wie nasale Obstruktion, eitrige Sekretion, „postnasal drip“, Kopf- oder Gesichtsschmerzen zeigen.
Die invasive Pilzsinusitis ist gekennzeichnet durch Schmerzen, Sehstörung, Doppelbilder, periorbitale Schwellung, Ausbildung eines Exophthalmus oder auch eines Telekanthus. Zum Zeitpunkt der Diagnose werden bei 50–60% orbitale Beteiligungen beschrieben.
Jedoch gibt es auch Fälle von nichtinvasiven Pilzbällen des Sinus sphenoidalis mit Beteiligung des Nervus opticus im Sinne einer Neuropathie und Sehstörung aufgrund der anatomischen Nähe.2, 3, 5
Ätiologie
Ursachen für eine invasive Pilzinfektion sind der reduzierte Immunstatus der Patient:innen und hier auch insbesondere ein vorliegender Diabetes mellitus. Dies erklärt auch ein vermehrtes Vorkommen von invasiven Pilzinfektionen in Ländern mit hohen Diabetesraten. Weiters sind hämatoonkologische Erkrankungen, und hier insbesondere eine Neutropenie, ein wichtiger Risikofaktor für invasive Pilzinfektionen.2, 3
Nicht nur an unserer Abteilung fiel ein vermehrtes Auftreten von ausgeprägten und invasiven Pilzinsinusitiden während der SARS-CoV-2-Pandemie auf, auch in der Literatur wird ein deutlicher Anstieg der Fälle weltweit beschrieben. Die Pilzinfektionen treten sowohl während der akuten SARS-CoV-2-Infektion als auch insbesondere in der Post-Covid-Phase auf.
Als Ursache für die häufigere Invasivität der Pilzinfektion im Rahmen einer SARS-CoV-2-Infektion werden einerseits Nebenwirkungen der Behandlung von Covid-19 (durch Steroidtherapie ausgelöste Hyperglykämien) angenommen, andererseits dürften epitheliale Verletzungen im Respirationstrakt sowie die oft begleitende Lymphopenie bei Covid-19 eine Invasivität der Pilzinfektion begünstigen. Zusammengefasst wird eine durch SARS-CoV-2 ausgelöste Immundysfunktion angenommen.3, 6
Diagnostik
Die Diagnostik umfasst neben der Anamnese (vorangegangene Zahnbehandlung, immunsuppressive Medikamente, Sehstörungen, Schmerzen, Allergien) eine Nasenendoskopie sowie in der Folge eine Bildgebung mittels CT der Nasennebenhöhlen. Bei Verdacht auf eine invasive Form sollte eine Augenuntersuchung durchgeführt werden sowie eine MRT zur Beurteilung der Ausbreitung in das umliegende Gewebe. Auch ein Pilznachweis in der Histopathologie bzw. in der Mikrobiologie ist angezeigt. Sollte sich bei einer invasiven Infektion eine negative Mikrobiologie ergeben (Übersiedelung durch Bakterien), liefert ein PCR-Erregernachweis (Blut, Biopsie, Kultur) Genaueres.1, 2
Die Diagnosekriterien für eine invasive Pilzsinusitis beinhalten laut EPOS 2020:2:
Rhinosinusitis in der Bildgebung mit Gewebszerstörung
Histopathologischer Nachweis von Pilzhyphen in der Mukosa, Submukosa, Gefäßen, Knochen
Pathognomonische Symptome: Schmerzen und Schwellung im Gesicht, nasale Obstruktion, Fieber, Sensibilitätsminderung in Gesicht oder Gaumen, Ophthalmoplegie, neurologische Symptome
Endoskopischer Befund: einseitige Nekrose
Serum: Galactomannan-Test oder Test auf β-D-Glucan (Zellwandbestandteil von Schimmelpilzen, welcher bei invasiver Mykose vor Symptomatik im Blut nachweisbar ist.)
Therapie
Während die Behandlung des Pilzballs mit einer vollständigen operativen Sanierung in mehr als 90% der Fälle problemlos und rezidivfrei zu behandeln ist, stellt sich die Therapie der invasiven Nasennebenhöhlenmykose deutlich ko mplexer und langwieriger dar:2, 7
-
Primär empfiehlt sich die chirurgische Sanierung und Débridement von Nekrosen.
-
Es sollte eine Reduktion der Immunsuppression evaluiert werden.
-
Die systemische antimykotische Therapie wird primär mit Amphotericin B parenteral empfohlen.
-
Bei einer Aspergillusinfektion ist Voriconazol zu favorisieren.
-
Die antimykotische Therapie sollte über zumindest 6–12 Wochen erfolgen.
-
Bei fehlendem Ansprechen ist ein Wechsel des Antimykotikums (Echinocandine, andere Triazole) oder eine Kombinationstherapie empfohlen, wobei Echinocandine und Triazole antagonistische Effekte haben können. Eine Resistenzebestimmung sollte erfolgen.
-
Regelmäßige Wirkspiegelbestimmungen sind unter antimykotischer Therapie notwendig.
-
Systemische Kortikosteroide bei orbitaler/intrazerebraler Beteiligung sind je nach Vorerkrankungen abzuwägen, um kontraproduktive Hyperglykämien zu vermeiden.
Transkutane retrobulbäre Injektionen von Amphotericin B zeigten eine Verbesserung des Visus.
Eine prophylaktische systemische fungostatische Therapie bei Fehlen von Invasivitätskriterien wird in der Literatur nicht empfohlen.1, 7
Zusammenfassung
Der beschriebene Patientenfall stellt die Komplexität der Behandlung von invasiven Nasennebenhöhlenmykosen dar. Selten kann es auch bei Patient:innen ohne Immundefekt, wie bei unserem Fall, zu einer invasiven Infektion kommen. Ebenso sind orbitale Komplikationen bei nichtinvasiven Pilzinfektionen beschrieben.
Durch den Anstieg der Zahl der invasiven Nebenhöhlenpilzinfektionen im Rahmen der SARS-CoV-2-Pandemie sind somit in Zukunft weitere schwerwiegende Infektionen zu erwarten.
Fallbeispiel einer invasiven Mykose bei einer 81-jährigen Patientin
Anamnese
Die Patientin wird von der neurologischen Abteilung aufgrund einer progredienten Visusminderung des rechten Auges seit 6 Monaten vorgestellt. Zum Zeitpunkt der Vorstellung besteht bereits eine Amaurose. Zudem bestehen rechtsbetonte Kopfschmerzen.
Diagnostik
Die ophthalmologische Untersuchung ergibt keine Auffälligkeiten, bei der neurologischen Untersuchung zeigt sich zusätzlich eine Augenmuskelparese. Eine MRT des Schädels wird durchgeführt, darin kann ein entzündlicher Prozess mit Beteiligung der Augenmuskulatur und des Nervus opticus ausgehend vom Sinus sphenoidalis mit ossärer Durchwanderung und Lückenbildung in Nahbeziehung zum Canalis opticus und Sinus cavernosus rechts identifiziert werden. Die Patientin wird daraufhin an der HNO-Abteilung des Klinikums vorgestellt. Zur Histologie und Mikrobiologiegewinnung wird eine FESS durchgeführt. Hierbei kann ein Aspergillus fumigatus festgestellt werden. Es wird daher die Diagnose einer invasiven Mykose mit Neuritis des Nervus opticus gestellt. Der Immunstatus der Patientin erweist sich nach eingehender Analyse als kompetent, ein Diabetes mellitus kann ebenfalls ausgeschlossen werden.
Therapieverlauf
Die Patientin wird stationär aufgenommen und es wird eine systemische antimykotische Therapie mit Amphotericin B und Isovuconazol gestartet. Da diese Arzneimittel nur intravenös zu verabreichen sind, bleibt die Patientin für fast zwei Monate im stationären Setting. In einer Kontroll-MRT nach ca. achtwöchiger Therapie muss bedauerlicherweise eine Befundprogredienz mit meningealem Enhancement der Frontobasis festgestellt werden. Die Diagnose wird daraufhin infrage gestellt und eine neuerliche Biopsie der Läsion durchgeführt. Eine komplette Resektion der Läsion wird interdisziplinär mit der Neurochirurgie abgewogen, jedoch aufgrund der Invasivität und der daraus resultierenden Risiken und Folgen verworfen. In der neuerlichen Biopsie können erneut Pilzhyphen festgestellt werden. Die intravenöse Therapie muss jedoch kurz danach abgebrochen werden aufgrund zunehmender Leber- und Nierenwertverschlechterung. Zwischenzeitlich wird die Patientin ausschließlich durch Lokalapplikation von Amphotericin-B-Lösung in die Keilbeinhöhle in Lokalanästhesie therapiert.
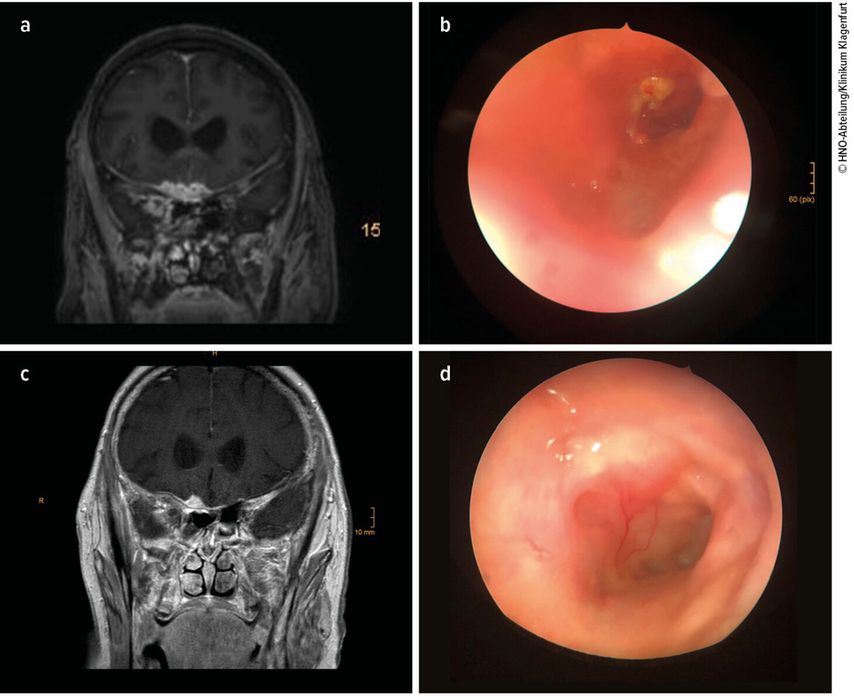
Als es wenige Wochen später auch zu einer Zunahme de r Symptomatik mit Kopfschmerzen, Gleichgewichtsstörung und Verwirrtheitszustand kommt, wird neuerlich eine MRT durchgeführt, in dem sich nun auch ein beginnender Hydrocephalus zeigt (Abb. 3a). Auch nasenendoskopisch kann am Keilbeinhöhlendach eine Vergrößerung der Läsion festgestellt werden (Abb. 3b).
Es wird daraufhin entschieden, eine neuerliche antimykotische Therapie zu starten, diesmal nach den amerikanischen Guidelines mit Voriconazol 300mg 2 x tgl. Dieses Medikament ist oral verfügbar und erfordert daher auch keinen längeren stationären Aufenthalt. Die Patientin wird ambulant in ein- bis dreiwöchigen Intervallen einbestellt, um weiterhin Amphotericin lokal in die Keilbeinhöhle zu applizieren und um die unter der primären Therapie auffälligen Leber- und Nierenwerte zu kontrollieren. Diese zeigen sich unter der Voriconazol-Therapie erfreulicherweise konstant, sodass die Tabletten über einen längeren Zeitraum weiter verordnet werden können.
Der Allgemeinzustand der Patientin verbessert sich nach Einleitung von Voriconazol, auch in der MRT zeigt sich nach drei Monaten eine „stable disease“ und nach sechs Monaten sogar eine Befundbesserung (Abb. 3c). Da sich auch die Läsion in der Keilbeinhöhle zurückbildet (Abb. 3d), kann auf die Lokalapplikationen in der Folge verzichtet werden.
Die Voriconazol-Therapie dauert mittlerweile fast ein Jahr an und die Patientin befindet sich in einem stabilen Zustand. Bis auf die Amaurose existieren keine anderen neurologischen Ausfälle. Regelmäßige Labor- und MRT-Kontrollen werden durchgeführt.
Abb. 3: MRT des Schädels und Lokalbefund der Keilbeinhöhle vor Einleitung der Voriconazol-Therapie (a, b) sowie MRT des Schädels und Lokalbefund der Keilbeinhöhle 6 Monate (c) bzw. 10 Monate (d) nach Einleitung der Voriconazol-Therapie
Literatur:
1 Riechelmann H: Laryngo-Rhino-Otologie 2011; 90(06): 374-84 2 Fokkens WJ et al.: Rhinology 2020; 58(Suppl S29): 1-464 3 Sebastian SK et al.: Eur Arch Otorhinolaryngol 2022; 279(11): 5239-46 4 Seo MY et al.: J Clin Med 2020; 9(2): 600 5 Ishihara R et al.: J Neuroophthalmol 2022; doi: 10.1097/WNO.0000000000001702 6 Singh AK et al.: Diabetes Metab Syndr Clin Res Rev 2021; 15(4): 102146 7 Patterson TF et al.: Clin Infect Dis 2016; 63(4): e1-e60
Das könnte Sie auch interessieren:
„Die HNO hat glücklicherweise keine Nachwuchsprobleme“
Prim. Prof. Dr. Fabian Sommer hat am 1. November 2024 die Leitung der Abteilung für Hals-, Nasen-, Ohrenheilkunde in Feldkirch, Vorarlbergs einziger HNO-Abteilung, übernommen. Im ...
Österreichs HNO-Abteilungen: Teil 5
Und wieder möchten wir – als offizielles Medium der Österreichischen HNO-Gesellschaft – den heimischen HNO-Abteilungen die Möglichkeit geben, sich selbst vorzustellen sowie ihre ...
Der OnkoZert-Zertifizierungsprozess – Erfahrungen aus Innsbruck
Die Qualitätssicherung in der onkologischen Versorgung gewinnt zunehmend an Bedeutung. Auch in der Kopf-Hals-Onkologie ist die Behandlung an zertifizierten Zentren inzwischen in ...