Die Nasen-Hirn-Achse
Autor:
Assoz. Prof. Priv.-Doz. Dr. Peter V. Tomazic, PhD
Facharzt für HNO-Krankheiten
Klinische Abteilung für Allgemeine HNO
Medizinische Universität Graz
E-Mail: peter.tomazic@medunigraz.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Nasen-Hirn-Achse („nose-brain axis“; NBA) steht für den Zusammenhang und wechselseitigen Einfluss der Nase auf das Gehirn. Sie bildet die zentrale Schnittstelle für den Geruchssinn, der sich durch anatomische und physiologische Zusammenhänge von Nase und Gehirn bildet.
Keypoints
-
Die Nase nimmt über den Geruchssinn Einfluss auf das Gehirn.
-
Durch Blockade der Riechrinne kann der Geruchssinn bei Allergikern und Sinusitispatienten beeinträchtigt sein.
-
Dies kann aber auch aufgrund des toxisch-entzündlichen Mikromilieus an der Riechschleimhaut zu irreversiblen Schäden führen.
-
Der Geruchssinn kann als Marker für die Früherkennung von neurodegnerativen Erkrankungen dienen.
-
Riechtrainings können den Krankheitsverlauf positiv beeinflussen.
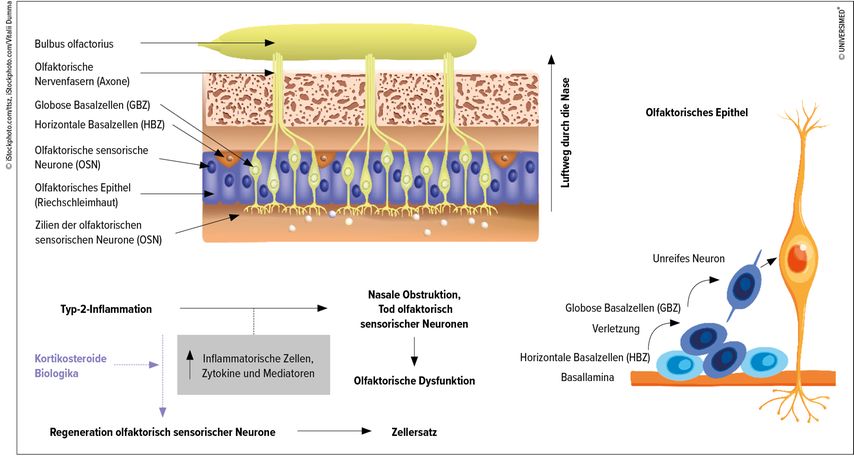
Die Riechschleimhaut befindet sich an den oberen Teilen der Nasenscheidewand sowie an der oberen und obersten (sofern vorhanden) Nasenmuschel. Von dort aus gelangen die Riechfäden über die Lamina cribrosa des Siebbeins zum Bulbus olfactorius, wo die neuronale Weiterleitung ins Gehirn und im Weiteren an den Riechkortex erfolgt. Wie der Name der Lamina cribrosaoder Siebplatte schon sagt, ist sie mit Löchern durchsiebt und erlaubt hier einen fast nahtlosen Übergang zwischen Nase und Gehirn. Des Weiteren sind die Riechaxone direkt mit den Neuronen des Bulbus verbunden, was die enge anatomische Lagebeziehung zwischen Nase und Gehirn vor Augen führt.
Physiologie des Geruchssinns
Riechmoleküle („odorants“) gelangen über die eingeatmete Luft an die Riechspalte oder durch den Mund retrograd über den Epipharynx an die Riechschleimhaut. Hier docken sie an die Riechrezeptoren im Sinne eines Schlüssellochprinzips an, und durch Kombination mehrerer parallel geschalteter Rezeptoren entstehen Millionen von Riecheindrücken, die dann im Gehirn zentral prozessiert werden.
Eine Störung des Geruchssinns wird in Anosmie (kein Geruchssinn), Hyposmie (verminderter Geruchssinn) und Dysosmie (gestörte Wahrnehmung des Geruchs) unterteilt. Dies ist von Geschmacksstörungen im engeren Sinne zu differenzieren, da der Geschmackssinn eigentlich nur die Qualitäten süß, sauer, salzig, bitter und umami umfasst und auf der Zunge wahrgenommen wird. Der Geschmack von Nahrungsmitteln bzw. die Aromen von z.B. Kaffee, Vanille oder Gewürzen werden durch den Geruchssinn vermittelt.
Neben diesen Sinneseindrücken, die erheblich zur Lebensweise und -qualität eines jeden Menschen beitragen, ist der Geruchssinn ein wichtiges Warnsignal und kann uns vor Gefahren schützen, wie beispielsweise die Wahrnehmungen von Chemikalien. Auch Pheromone und dadurch die Fortpflanzung werden über den Geruchssinn vermittelt, was im Tierreich eine besondere Rolle spielt. Auch die Selbstwahrnehmung, inklusive der Wahrnehmung von Ekel, kann über den Geruchssinn direkt unser psychisches Gleichgewicht beeinflussen und zu sozialer Interaktion bis hin zu Depressionen führen.
Die Nasen-Hirn-Achse und das Immunsystem
Bei der allergischen Rhinitis und der chronischen Rhinosinusitis ist die NBA für den HNO-Arzt von besonderem Interesse. Bei beiden Erkrankungen ist die behinderte Nasenatmung bzw. eine verstopfte Nase das Kardinalsymptom. Logischerweise gelangen bei einer verstopften Nase durch die geschwollene Schleimhaut weniger bis gar keine Riechpartikel an die Riechschleimhaut und somit besteht eine mehr oder minder ausgeprägte Geruchsstörung. Bei adäquater Behandlung und Abschwellen der Schleimhäute ist dieser Vorgang reversibel, jedoch bergen auch das entzündliche Mikromilieu und die Zytokinausschüttung sowie Immunzellinfiltrate die Gefahr einer Schädigung des Riechepithels mitsamt seiner Neurone, was in manchen Fällen irreversibel sein kann.
Es konnte gezeigt werden, dass 10% bis 80% der Allergiker an Riechstörungen leiden. Diese breite Schwankung ergibt sich aus der Heterogenität der Studiendesigns und angewandter Riechtests. Zum Teil wurden auch nur Fragebögen bzw. visuelle Analogskalen verwendet. Interessant ist, dass die Riechstörung mit Dauer der Allergie (auf dieLebensdauer bezogen) zunimmt. Die Riechstörungen, die quantitativ erfasst wurden, sind nicht schwerwiegend, nehmen jedoch mit der Schwere der Allergie zu. Bei milder Allergie sind ca. 5% von Riechstörungen betroffen, bei moderater bis schwerer Allergie schon 23% der Betroffenen. Bei Pollenallergikern ist die Riechstörung stärker während der Pollensaison ausgeprägt und bei Milbenallergikern grundsätzlich stärker als bei Ersteren. Differenziert man die Symptome bzw. die Phänotypen der Allergiker in „runners“ (vorherschendes Symptom der rinnenden Nase) und „blockers“ (vorherrschendes Symptom der behinderten Nasenatmung) sind Letztere stärker von einer Riechstörung betroffen.
Bei der chronischen Sinusitis sind ähnliche pathophysiologische Vorgänge wie bei der Allergie für die Schleimhautschwellung und Blockade der Nasenatmung verantwortlich. Besonders aber bei der chronischen Rhinosinusitis mit Nasenpolypen (CRSwNP), die von eosinophilen Granulozyten dominiert sein kann und der ein Th2-Immunprofil zugrunde liegt, kommt es aufgrund der vorherrschenden Zytokine und damit einhergehender Zellschädigungen zu möglichen irreversiblen Schäden an den Neuronen der Riechschleimhaut (Abb.1).
Abb. 1: Inflammatorisches Milieu und Einfluss auf das Riechepithel (modifiziert nach Mullol J et al., 2020)
Die Nase und neurodegenerative Erkrankungen
Am besten lassen sich die Einflüsse der Nase und des Geruchssinns auf das Gehirn anhand neurodegenerativer Erkrankungen darstellen – besonders anhand von Morbus Parkinson (Parkinson’s disease; PD) und Alzheimer (Alzheimer’s disease; AD).
Die Studien zu Alzheimer und Geruchsstörung bezeichnen die Schlüsselregion für die Entstehung bzw. die Modulation der Erkrankung als „brain-nasalcavity“(B-NC). Interessant ist hierbei, dass dieses Gebiet als periphere Region des Zentralnervensystems angesehen wird, das eine geringere Durchflussrate der Hirnflüssigkeit (Liquor cerebrospinalis) aufzeigt, und dadurch weniger Metabolite abtransportiert werden, die dann zu Zelldegeneration führen, da sie mitunter toxisch sind. Dies führt auch zur Ablagerung von Betaamyloid, was typisch für AD ist. Der Zusammenhang aus Blutversorgung, Liquorfluss und Abtransport von Metaboliten wird als „glymphatisches System“ bezeichnet. Eine weitere Theorie besagt, dass durch verminderten Geruchssinn – welcher Ätiologie auch immer – die Riechrinde weniger „gefordert“ wird und dadurch die Blutversorgung reduziert wird, was wiederum zur oben beschriebenen Ablagerung von Betaamyloid und Zelldegneration führt. Bei Mäusen, bei denen experimentell der Bulbus olfactorius reseziert wurde, konnte diese Ablagerung bestätigt werden. Auch finden sich bei AD-Patienten vermehrt „neurofibrillary tangles“ und Zelldetritus im Bulbus olfactorius.
Auf der anderen Seite konnte gezeigt werden, dass Riechtrainings einen positiven Einfluss auf den Krankheitsverlauf nehmen können und eine Geruchsstörung ein früher Marker für AD ist, der für Screenings verwendet werden kann.
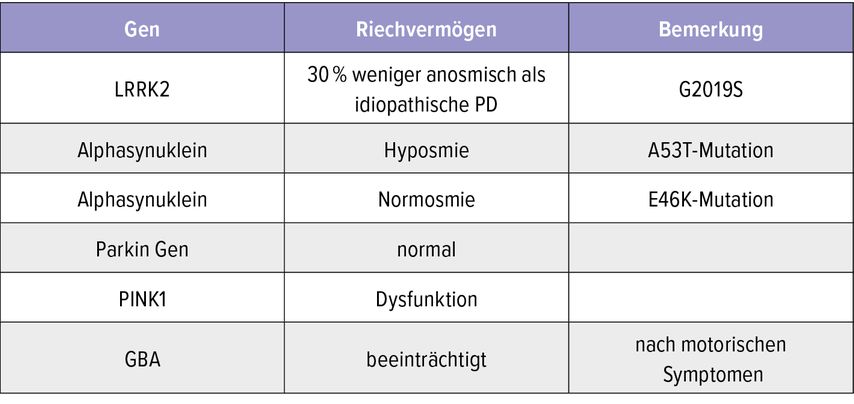
Beim Morbus Parkinson kommt es zum Verlust dopaminerger Neurone und Ablagerung von Alphasynuklein (Lewy-Körperchen) mit der typischen Symptomkonstellation von Bradykinesie, Rigidität, Tremor und Ganginstabilität. Wie bei der AD kommt es auch hier sehr früh oftmals vor motorischen Störungen zu Geruchsstörungen bei 50% bis 96% der Betroffenen. Bei funktionellen MR-Untersuchungen hat man herausgefunden, dass bei PD eine verminderte neuronale Aktivität in der Amygdala und im Hippocampus nach olfaktorischen Reizen zu messen war. Eine Riechstörung bei PD kann nicht nur als Frühsymptom herangezogen werden, sondern gibt auch prognostisch Aufschluss über die kognitive und motorische Verschlechterung bei zunehmender Riechminderung. Interessanterweise verhält sich die Riechstörung unterschiedlich, je nach Endotyp des PD (Tab.1).
Die Nasen-Hirn-Achse und das Mikrobiom
An der Medizinischen Universität Graz untersuchen wir den Einfluss und die Veränderung des nasalen Mikrobioms auf neuronale Plastizität nach Riechtrainings. Die Hypothese ist, dass durch Lymphwege der Nasennebenhöhlen und des Epipharynx Mikrobiota Zugang zum ZNS bekommen und das Mikromilieu so Einfluss auf die neuronale Plastizität nehmen kann. Je nachdem, wie sich das Mikrobiom verändert und dadurch zentralnervöse Veränderungen herbeiführt, könnte die Stärkung der Biodiversität in der Nase als therapeutischer Ansatz bei Erkrankungen des ZNS und bei Riechstörung genutzt werden.
Fazit
Über den Geruchssinn scheint die Nase Einfluss auf das Gehirn zu nehmen. Die neuesten Erkenntnisse darüber können bei der Früherkennung von neurodegnerativen Erkrankungen helfen, durch Riechtrainings den Krankheitsverlauf zu beeinflussen und durch besseres Verständnis der Stoffwechselwege an dieser Schlüsselstelle neue therapeutische Ansätze zu entwickeln. Wie so oft in der Wissenschaft liegt noch ein weiter, wenn auch Erfolgversprechender Weg vor uns. In diesem Sinne: immer der Nase nach.
Literatur:
• Schienle A et al.: Affective personality traits in olfactory dysfunction: the role of dysthymia and arousal. Chemosens Percept 2018; 11(2): 72-6 • Ille R et al.: Disgust-related personality traits in men with olfactory dysfunction. Chem Senses 2016; 41(5): 427-31 • Stuck BA, Hummel T: Olfaction in allergic rhinitis: a systematic review. J Allergy Clin Immunol 2015; 136(6): 1460-70• Klimek L: Sense of smell in allergic rhinitis. Pneumologie 1998; 52(4): 196-202 • Khanna P, Shah A: Categorization of patients with allergic rhinitis: a comparative profile of „sneezers and runners“ and „blockers“. Ann Allergy Asthma Immunol 2005; 94(1): 60-4 • Rhee CS et al.: Prevalence, risk factors and comorbidities of allergic rhinitis in south korea: The fifth korea national health and nutrition examination survey. Am J Rhinol Allergy 2014; 28(2): e107-14 • Mullol J et al.: The sense of smell in chronic rhinosinusitis. J Allergy Clin Immunol 2020; 145(3): 773-6 • Jankovic J, Tan EK: Parkinson’s disease: etiopathogenesis and treatment. J Neurol Neurosurg Psychiatry 2020; 91(8): 795-808 • Reid AT, Evans AC: Structural networks in alzheimer’s disease. Eur Neuropsychopharmacol 2013;23(1): 63-77 • Bell JS et al.: Invited review: from nose to gut - the role of the microbiome in neurological disease. Neuropathol Appl Neurobiol 2019; 45(3): 195-215
Das könnte Sie auch interessieren:
Österreichs HNO-Abteilungen: Teil 2
Auch in dieser Ausgabe möchten wir – als offizielles Medium der Österreichischen HNO-Gesellschaft – den heimischen HNO-Abteilungen die Möglichkeit geben, sich selbst vorzustellen sowie ...
Tonsillopharyngitis: Entscheidungsfindung und Patientenorientierung
Akute Halsschmerzen gehören zu den häufigsten Beratungsanlässen in der allgemeinärztlichen und HNO-ärztlichen Praxis. Die aktuelle S3-Leitlinie „Therapie der akuten Tonsillo-Pharyngitis ...
Osia System: erste Erfahrungen mit einem neuen Knochenleitungsimplantat
Für die Versorgung von kombinierten Schwerhörigkeiten existieren verschiedene implantierbare Hörsysteme wie die aktiven Mittelohrimplantate (z.B. Vibrant Soundbridge) und die passiven ...