Therapie des multiplen Myeloms
Bericht:
Dr. Corina Ringsell
Dank vielfältiger neuer Therapieoptionen verbessert sich die Prognose beim multiplen Myelom (MM) stetig. Die bereits verfügbaren Therapien können oft eine langfristige, zum Teil auch eine dauerhafte Remission einleiten.1 Welche Optionen es gibt und wie die Patient:innen betreut werden, war Thema eines Cancer Updates des CCC Vienna.
Die medikamentöse Behandlung des MM hat sich durch die Zulassung neuer, hochwirksamer Arzneimittel, vor allem der Immuntherapeutika, verändert. Bei einem Rezidiv oder in der Refraktärität ist weniger die Anzahl der vorherigen Therapielinien entscheidend als vielmehr die Substanzklasse der zuvor eingesetzten Medikamente, deren Wirksamkeit und Verträglichkeit.1
Erstlinientherapie des neu diagnostizierten MM
Dr. Eva-Maria Autzinger, Krankenhaus Barmherzige Schwestern Wien, stellte die verschiedenen Therapieoptionen für die drei in der Leitlinie definierten Gruppen von Patient:innen mit neu diagnostiziertem MM vor. Die erste Gruppe umfasst Patient:innen, die für eine autologe Stammzelltransplantation (ASZT) geeignet sind – Personen bis 70 oder 75 Jahre. In der zweiten Gruppe finden sich Menschen über 70 Jahre, die noch fit sind, während die dritte Gruppe unfitte Patient:innen über 75 Jahre umfasst.1 Das Ziel der Therapie sei im Idealfall eine stringente komplette Remission (CR) bzw. eine negative minimale Resterkrankung (MRD), erklärte Autzinger. Das bedeute, dass kein Paraprotein im Serum oder 24-Stunden-Harn nachweisbar sei, im PET/CT keine aktiven Herde oder extramedullären Manifestationen zu finden seien und eine MRD-Negativität von 10–5 oder sogar 10–6 bestehe.
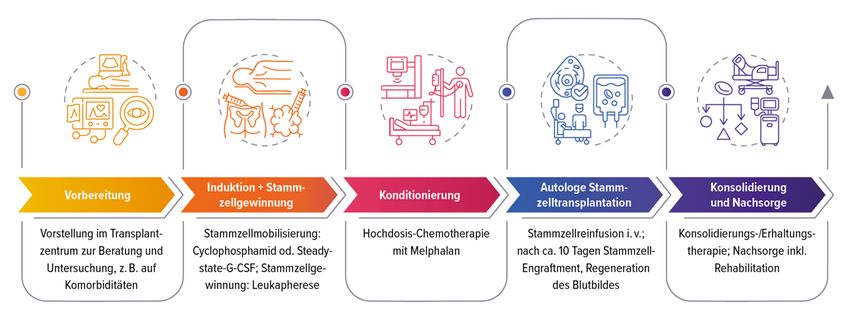
Therapie ASZT-geeigneter Patient:innen
Nach bzw. während der Induktionstherapie erfolgt bei einem guten Ansprechen (mindestens PR) die Stammzellgewinnung mittels Enodoxan oder G-CSF-„steady state“ Mobilisierung. Üblicherweise werden dann noch zwei bis drei Zyklen der Erstlinientherapie verabreicht, bevor die Hochdosischemotherapie mit Melphalan erfolgt. Zwei Tage (24–48h) danach werden die Stammzellen reinfundiert (Abb. 1). In der PERSEUS-Studie wurde für Induktion und Konsolidierung die Viererkombination mit dem Anti-CD38-Antikörper (CD38-AK) Daratumumab, Bortezomib, Lenalidomid, Dexamethason (D-VRd) gegen den Standard VRd getestet. D-VRd erreichte nicht nur höhere Ansprechraten als VRd (84% vs. 68%), sondern auch höhere Raten an MRD-Negativität (75,2% vs. 47,5%).2 Im Verlauf von 36 Monaten nahmen die Remissionstiefe und die Raten der MRD-Negativität noch zu.3 Die bessere Wirksamkeit ging allerdings mit einer stärkeren Hämatotoxizität und vermehrten Infekten, vor allem der Atemwege, einher.2 D-VRd ist als Erstlinientherapie bei neu diagnostiziertem MM zugelassen.
Therapie fitter, nicht ASZT-geeigneter Patient:innen
Auch für MM-Patient:innen, die nicht für eine ASZT infrage kommen, ist eine Viererkombination mit einem CD38-AK für die Erstlinientherapie zugelassen: Isatuximab-VRd. In der IMROZ-Studie erzielte die Kombination im Vergleich zu VRd höhere Raten an kompletter Remission (74,7% vs. 64,1%) und MRD-Negativität (55,5% vs. 40,9%). Nebenwirkungen waren auch hier unter der Viererkombination häufiger. Neben hämatologischen Veränderungen und Infektionen traten auch vermehrt periphere Neuropathien auf.4 Autzinger betonte, dass darauf besonders geachtet werden sollte, da viele Patient:innen dieser Alterskohorte auch an Typ-2-Diabetes leiden.
Therapie älterer, unfitter Patient:innen
Für diese MM-Patient:innen wurde in der MAIA-Studie DRd gegen Rd untersucht. Die Zugabe von Daratumumab zu Rd resultierte in einem verlängerten medianen progressionsfreien Überleben (mPFS) von rund 62 Monaten (vs. 34 Monate) und Gesamtüberleben (mOS) von 90 Monaten (vs. 64 Monate).5 Selbst die Subgruppe der gebrechlichen Patient:innen profitierte von DRd mehr als von Rd.6
Abläufe der ASZT
Vor der Einführung der ASZT in den 1990er-Jahren lag die mediane Überlebenszeit von MM-Patient:innen bei durchschnittlich drei Jahren, wie PD Dr. Alexandra Böhm, Hanusch-Krankenhaus, Wien, erklärte. Neuere Real-World-Daten für ASZT-geeignete Patient:innen zeigen ein mOS von zehn Jahren und mehr.7
Wichtig für eine erfolgreiche ASZT sei die Vorbereitung wie die rechtzeitige Vorstellung der Patient:innen im Transplantationszentrum für die Beratung und Untersuchung, etwa auf Begleitkrankheiten. Die Patient:innen sollten nach der Induktion mindestens eine partielle Remission (PR) zeigen. Die Stammzellgewinnung wird nach zwei bis vier Zyklen der Stammzellmobilisierung empfohlen. Sie erfolgt mittels einer Leukapherese über mehrere Stunden. Dabei können Schwindel, Kältegefühl, Übelkeit, Kreislaufschwäche und Kribbeln an Händen und Füßen auftreten. Die isolierten Stammzellen werden bis zur Reinfusion in flüssigem Stickstoff bei –140°C gelagert.
Für die Transplantation selbst ist ein drei- bis vierwöchiger stationärer Aufenthalt erforderlich. Die früher sehr strengen Auflagen zum Schutz der Patient:innen vor Infektionen seien gelockert worden, sagte die Expertin. Daher seien Besuche durchaus erlaubt, sofern sie für die Betroffenen nicht zu anstrengend sind.
Die kritischste Phase der ASZT sei die Aplasie aufgrund der Melphalangabe mit extrem niedrigen Leukozyten- und Granulozytenzahlen, betonte die Referentin. Daher seien in dieser Zeit bestimmte Hygienevorschriften und Ernährungsempfehlungen einzuhalten. Typische Nebenwirkungen von Melphalan seien unter anderem Übelkeit, Erbrechen, Mukositis, Enteritis, Fieber, Infektionen und Haarausfall.
Was tun beim Rezidiv?
Dr. Martin Schreder, 1. Medizinische Abteilung, Zentrum für Onkologie und Hämatologie mit Palliativstation, Klinik Ottakring, Wien, zeigte die therapeutischen Möglichkeiten bei einem MM-Rezidiv auf und leitete seinen Vortrag mit der guten Nachricht ein: „Wir können aus einem breiten Portfolio auswählen.“ Von 2003 bis 2023 seien 18 neue Medikamente für die MM-Therapie zugelassen worden – und alle zunächst in der Rezidivsituation, sagte er. Der Vorteil sei, dass dadurch bei der Therapiewahl auf die individuellen Bedürfnisse der Patient:innen eingegangen werden könne. So spielen unter anderem Alter, ECOG-Status, Begleitkrankheiten und die Genetik (Hoch- vs. Standardrisiko) sowie die Art des Rezidivs (biochemisch vs. symptomatisch) eine Rolle. Außerdem fließen die Art der Vorbehandlung, Ansprechen und Nebenwirkungen sowie die Präferenzen der Patient:innen ein.1
Eine der wesentlichen Substanzklassen sind die Proteasomhemmer, etwa Bortezomib und Carfilzomib.1 Wichtig sei ein gewissenhafter Blick auf die Komorbiditäten, vor allem älterer Personen, da es unter Carfilzomib zu kardiovaskulären Nebenwirkungen kommen könne, so Schreder. Mittlerweile sind Dreierkombinationen, etwa aus einem Immunmodulator, einem CD38-AK plus Chemotherapie, in der Rezidivtherapie etabliert und den Zweierkombinationen vorzuziehen. Der Vorteil: Die Dosierung der Einzelsubstanzen kann reduziert werden, was auch die Toxizität mindert.1 Außerdem sollte auch zwischen den Substanzklassen gewechselt werden, erklärte Schreder. Die Behandlung wird in der Regel bis zur Progression oder dem Auftreten inakzeptabler Nebenwirkungen fortgesetzt, weshalb sie überwiegend ambulant erfolgt.
Die zweite wichtige Substanzklasse sind die Immunmodulatoren wie Lenalidomid und Revlimid.1 Sie zeichnen sich dadurch aus, dass sie oral und langfristig gegeben werden können sowie gute Kombinationspartner für andere Substanzen sind. Doch auch hier seien die Nebenwirkungen wie Fatigue, Thromboseneigung, gastrointestinale oder hämatologische Symptome der limitierende Faktor für die Behandlung, sagte der Referent.
Trotz der vielfältigen Optionen sei das MM eine tödliche Krankheit mit begrenztem Überleben.8 Daher seien neue Ideen gefragt, betonte er. Neue Substanzen mit anderen Wirkmechanismen sind zum Beispiel der XPO-Inhibitor Selinexor, der ein sehr konsequentes Nebenwirkungsmanagement verlangt, der BCL2-Hemmer Venetoclax, bei dem besonders auf Infektionen zu achten ist, und das gegen BCMA gerichtete Antikörperkonjugat Belantamab Mafodotin.1 Letzteres sei aufgrund der Nebenwirkungen (Sehstörungen) bereits verworfen worden, habe aber in neueren Studien in Kombination mit Vd Ansprechraten von über 80% bei akzeptablen Nebenwirkungen gezeigt. Deshalb sei eine Zulassung zu erwarten, sagte Schreder und schloss mit dem Ausblick: „Die Rezidivtherapie ist nicht am Ende. Sie beginnt jetzt erst.“
Immuntherapien eröffnen neue Perspektiven
Wie bispezifische Antikörper und CAR-T-Zellen die Therapie des MM verändern, erläuterte Prof. PD Dr. Maria Krauth, Universitätsklinik für Innere Medizin I, MedUni Wien/AKH Wien. Die bisher eingesetzten Substanzen einschließlich der CD38-AK hätten als Monotherapie Responseraten bis etwa 30% erreicht. Die neuen bispezifischen Antikörper erzielten als Monotherapie Raten über 60%, die CAR-T-Zell-Produkte sogar 80% bis knapp 100%, sagte sie.
Bispezifische Antikörper
Der erste verfügbare bispezifische Antikörper (AK) war Teclistamab, der gegen BCMA gerichtet ist. In der Studie MajesTEC-1 wurde er bei Patient:innen mit rezidiviertem/refraktärem MM (rrMM) eingesetzt, die zuvor mindestens drei Therapielinien erhalten hatten. In dieser Situation habe man seinerzeit keine wirksamen Alternativen mehr gehabt, so Krauth. Teclistamab erreichte ein Gesamtansprechen (ORR) von 63% und Raten negativer MDR von über 80%.9 Hauptsächliche Nebenwirkungen waren das Zytokin-Release-Syndrom (CRS), allerdings nur leichte Formen, Blutbildveränderungen und besonders Infektionen, da BCMA auch auf Immunzellen exprimiert wird.9 Dies müsse beobachtet und mit der Gabe von Immunglobulinen behandelt werden, betonte die Referentin. Ähnliche Responseraten bei vergleichbaren Nebenwirkungen erzielte Elranatamab, ebenfalls ein gegen BCMA gerichteter AK, in der Studie MagnetisMM-3.10 Ein weiterer bispezifischer AK ist Talquetamab, der gegen den Rezeptor GPRC5D gerichtet ist. GPRC5D findet sich in großer Zahl auf malignen Plasmazellen, aber kaum auf gesunden. Er erreicht eine ORR von etwa 70%, geht aber mit weniger Infektionen einher als die Anti-BCMA-AK. Hier betreffen die Hauptnebenwirkungen Haut, Nägel, Haare und Mundschleimhaut.11 Die Nebenwirkungen seien aber reversibel, so Krauth. Alle drei Substanzen sind in Europa zugelassen für MM-Patient:innen, die zuvor mindestens drei Therapien – nicht Therapielinien wie in den USA – erhalten haben.
CAR-T-Zellen
Das erste verfügbare CAR-T-Zell-Produkt war Ide-cel, das in der KarMMa-Studie nochmals höhere ORR und ein längeres mPFS (20Monate) erreichte als die bispezifischen AK. Da es auch gegen BCMA gerichtet ist, sind die Nebenwirkungen vergleichbar mit den entsprechenden bispezifischen AK.12 Hier müsse man zudem besonders auf eine späte Neurotoxizität achten, betonte Krauth.
Das Gleiche gelte für Cilta-cel, sagte sie. In der CARTITUDE-1-Studie erreichte es eine ORR von rund 98% und bei den Respondern ein mPFS von fast 40 Monaten. Die Nebenwirkungen sind mit jenen von Ide-cel vergleichbar.13 In den Studien KarMMa-3 und CARTITUDE-4 wurden die Substanzen in früheren Therapielinien mit einer Standardtherapie wie DPd, PVd oder DVd verglichen. Auch in diesem Setting verlängerten die CAR-T-Zellen das PFS im Vergleich zur jeweiligen Standardtherapie.14,15 Bei der Jahrestagung 2024 der International Myeloma Society (IMS) wurde ein Update von CARTITUDE-4 mit einer Nachbeobachtungszeit von rund 34 Monaten präsentiert. Verglichen mit der Standardtherapie ergab sich unter Cilta-cel mit einer 30-Monats-OS-Rate von 76% (vs. 64%) ein Überlebensvorteil.16
Die Referentin zeigte aber auch die Neurotoxizität der CAR-T-Zell-Produkte auf, die zum Teil bisher nicht beobachtete Symptome verursacht, etwa Hirnnervenlähmungen oder Motoneurontoxizität (Parkinsonismus) als Spätkomplikationen.16 Zwar entwickele nur ein sehr geringer Teil der Patient:innen solche Komplikationen, aber man müsse wissen, dass es sie gibt, betonte Krauth.
Literatur:
1 Onkopedia-Leitlinie „Multiples Myelom“, Stand 10/2024 ( www.onkopedia.com ) 2 Sonneveld P et al.: N Engl J Med 2024; 390(4): 301-3 3 Rodríguez-Otero P: ASCO-Kongress 2024, Abstr. #7502 4 Facon T et al.: N Engl J Med 2024; 391(17): 1597-609 5 Facon T et al.: Leukemia 2025; doi: 10.1038/s41375-024-02505-2 (online ahead of print) 6 Facon T et al.: Leukemia 2022; 36(4): 1066-77 7 Rajkumar SV: Am J Hematol 2024; 99(9): 1802-24 8 Gandhi UH et al.: Leukemia 2019; 33(9): 2266-75 9 Moreau P et al.: N Engl J Med 2022; 387(6): 495-505 10 Lesokhin AM et al.: Nat Med 2023; 29(9): 2259-67 11 Chari A et al.: Lancet Haematol 2025; S2352-3026(24)00385-5 (online ahead of print) 12 Munshi NC et al.: N Engl J Med 2021; 384(8): 705-16 13 Berdeja JG et al.: Lancet 2021; 398(10297): 314-24 14 Rodriguez-Otero P et al.: N Engl J Med 2023; 388(11): 1002-14 15 Dhakal B et al.: J Clin Oncol 2023; 41(Suppl): Abstr. #LBA 106 16 Mateos MV: Abstr. #OA–65. 21st IMS Annual Meeting 2024, Rio de Janeiro/Brazil
Das könnte Sie auch interessieren:
SOC in Diagnose und Management
Unter dem Vorsitz von Prim. Priv.-Doz. Dr. Birgit Volgger, Bezirkskrankenhaus Lienz, und Univ.-Prof. Dr. Christian Marth, MedUni Innsbruck, fand am 10. Mai 2025 im Rahmen der ...
Hautmanifestationen bei onkologischen Erkrankungen
Krebserkrankungen verschiedener Organsysteme können auch mit Symptomen an der Haut einhergehen, die manchmal bereits als frühe Warnzeichen auftreten. Dazu zählt ausgeprägter Pruritus. ...
Neues zur GVHD-Prophylaxe und Risikobewertung bei Myelofibrose
Die Prophylaxe der Graft-versus-Host-Krankheit (GVHD) bleibt eine zentrale Herausforderung nach allogener Stammzelltransplantation. Auf dem diesjährigen EBMT-Kongress wurden dazu neue ...