Neue Therapieoptionen bei Hämophilie
In den letzten Jahren kam es in der Behandlung von Patienten mit Hämophilie zu deutlichen Fortschritten und zur Entwicklung neuer Therapiemöglichkeiten – unabhängig von der herkömmlichen Faktorensubstitution – bis hin zur erfolgreichen Gentherapie. Angepasst an die individuellen Bedürfnisse der Patienten wird es in Zukunft sehr unterschiedliche Behandlungsoptionen in der Hämophilie geben.
Keypoints
-
Die prophylaktische Faktorensubstitution ist sicher und kann Gelenksblutungen und die Entwicklung einer hämophilen Arthropathie verhindern bzw. zumindest verzögern.
-
Der subkutan verabreichte bispezifische Antikörper Emicizumab stellt schon jetzt eine Alternative zur bisherigen Faktorensubstitution dar.
-
Vielversprechende Daten zur Gentherapie von Hämophilie- A- und Hämophilie-B-Patienten zeigen einen andauernden Anstieg von Faktor VIII bzw. Faktor IX.
Durch das vollständige oder teilweise Fehlen der Gerinnungsfaktoren VIII (FVIII; Hämophilie A) oder IX (FIX; Hämophilie B) besteht bei Patienten mit Hämophilie ein erhöhtes Risiko für Blutungen. Diese treten spontan oder nach geringen Belastungen vor allem als Gelenks- und Muskelblutungen auf und konnten bisher nur durch eine regelmäßige intravenöse Faktorensubstitution suffizient behandelt werden. Ziel der Therapie ist jedoch nicht nur die Verhinderung von Blutungen, sondern auch den Patienten durch eine adäquate Behandlung ein aktives Leben ohne Angst vor Spätkomplikationen zu ermöglichen.
Prophylaxe mit rekombinanten/plasmatischen Faktoren
Standardtherapie zur Verhinderung von Gelenksblutungen und Ausbildung einer hämophilen Arthropathie ist die frühzeitige, bereits im Kindesalter begonnene, regelmäßige prophylaktische Faktorensubstitution. Die individuell unterschiedlichen, jedoch generell kurzen Halbwertszeiten der FVIII/IX-Präparate machen jedoch entsprechend den geltenden Richtlinien regelmäßige intravenöse Gaben alle 2–3 Tage notwendig.1 Nur durch eine lebenslange Faktorensubstitution, mit einer an das Körpergewicht und die Patienten-abhängigen Bedürfnisse angepassten Dosierung und Therapieregime, kann es gelingen, Gelenksblutungen möglichst zu verhindern und die Entwicklung einer hämophilen Arthropathie zu vermeiden.2 Dennoch entscheiden sich aus unterschiedlichen Gründen noch immer besonders ältere Patienten für eine Bedarfsbehandlung mit einer Substitution nur im Rahmen von besonderen Belastungen oder bei Blutungen. Eine anhaltende Diskussion besteht zudem über das Risiko einer Hemmkörperentwicklung durch die Verwendung von rekombinanten FVIII-Präparaten. Mehrere Publikationen konnten diese Frage nicht eindeutig klären. Die bisher größte prospektive Studie (der sogenannte SIPPETtrial) zu diesem Thema bei zuvor unbehandelten Kindern zeigte eine geringere Rate von Hemmkörpern im Rahmen der Behandlung mit plasmatischen FVIII-Produkten im Vergleich zu rekombinanten FVIII-Präparaten.3
Produkte mit verlängerter Halbwertszeit
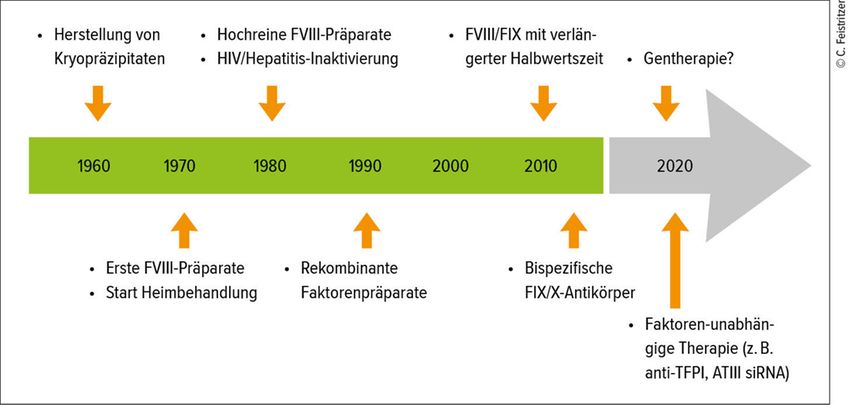
In der Entwicklung der Hämophilietherapie kam es in den letzten Jahren zu erfreulichen Entwicklungen (Abb. 1). Der erste große Fortschritt wurde ab dem Jahr 2016 durch gentechnische und chemische Modifikationen der Gerinnungsfaktoren mittels PEGylierung bzw. Fusion mit einer Fc-Domäne oder Albumin gemacht.4 Speziell für entsprechende FIX-Präparate ergaben diese Modifikationen eine Verlängerung der Halbwertszeit um das bis zu 5-Fache auf über 100 Stunden. Die Substitutionsintervalle können dadurch – angepasst an den Lebensstil des Patienten – auf bis zu 2 Wochen verlängert werden. Jedoch stellt die adäquate Bestimmung der FIX-Spiegel bei Produkten mit verlängerter Halbwertszeit speziell in Notfallsituationen eine Herausforderung dar und bedarf einer guten Zusammenarbeit mit der Labormedizin. Beim FVIII hingegen führt die Interaktion mit dem Von-Willebrand-Faktor dazu, dass die gleichen Modifikationen lediglich zu einer Verlängerung der Halbwertszeit um das ca. 1,5-Fache und somit im Schnitt auf 18–19 Stunden führen. Im Sinne einer Individualisierung und Anpassung der Therapie an die Bedürfnisse des Patienten können diese Präparate genutzt werden, um bei Beibehaltung des ursprünglichen Dosierungsschemas höhere Talspiegel zu erreichen oder das Substitutionsintervall um Tage zu verlängern.5 Eine wesentliche Verlängerung der Halbwertszeit konnte in Studien mit dem Molekül BIVV001 (rFVIIIFc-VWF-XTEN) gezeigt werden, wobei ein rFVIII mit einem VWF-D‘D3-Anteil durch IgG1-Fc-Domänen und zwei XTEN®-Polypeptiden fusioniert wird.6 Bereits präsentierte Daten der Phase-I/II-Studie zeigten eine Halbwertszeit von bis zu 40 Stunden. Eine Phase-III-Studie ist bereits in Planung, Daten zur Immunogenität des Moleküls sind noch ausständig.
FVIII/IX-unabhängige Therapieansätze
Innovative Therapieansätze in der Behandlung der Hämophilie zielen auf ein neues Gleichgewicht in der Gerinnung unabhängig von einer spezifischen Faktorensubstitution ab. Zugelassen in der Behandlung von Patienten mit einer Hämophilie A ist die Therapie mit Emicizumab (Hemlibra), einem bispezifischen, humanisierten monoklonalen Antikörper. Dieser verbindet den aktivierten FIX und den Gerinnungsfaktor X und ahmt dadurch die Funktion des bei Patienten mit schwerer Hämophilie A fehlenden aktivierten FVIII nach. Die Effektivität von Emicizumab ist geringer als der FVIII, sodass im Rahmen von Operationen und Blutungen weiterhin eine Faktorensubstitution notwendig sein wird. Emicizumab wird bei einer mittleren Halbwertszeit von 28 Tagen in max. 4-wöchentlichen Abständen subkutan verabreicht. Da die Wirkung unabhängig von möglichen Hemmkörpern ist, kann Emicizumab auch bei Patienten mit Inhibitoren eingesetzt werden. Die bisher publizierten Zulassungsstudien im HAVEN-Studienprogramm zeigten prinzipiell eine sehr gute Wirksamkeit in der Vermeidung von Blutungen bei Jugendlichen über 12 Jahre und Erwachsenen sowohl mit als auch ohne Hemmkörper7, 8 sowie bei Kindern mit Inhibitoren9. Der Vergleich der Effektivität der Behandlung wurde primär gegen eine FVIII-Bedarfsbehandlung untersucht, eine direkte Gegenüberstellung zur prophylaktischen FVIII-Substitution wurde lediglich in einer Subgruppenanalyse zu HAVEN 3 publiziert.10 Zu Beginn der Studien traten schwerwiegende Nebenwirkungen im Sinne von thromboembolischen Komplikationen und thrombotischen Mikroangiopathien bei gleichzeitiger Behandlung mit dem Bypassing-Medikament FEIBA® (Faktor-VIII-Inhibitor-Bypass-Aktivität) auf. Dennoch reißt die Diskussion über mögliche gravierende Nebenwirkungen und Todesfälle im Rahmen der Therapie mit Emicizumab nicht ab,11 auch wenn ein direkter Zusammenhang mit dem Medikament nicht gezeigt wurde!
Mit Fitusiran, einem synthetischen „small interfering“ RNA(siRNA)-Oligonukleotid gegen Antithrombin III, oder Concizumab, einem Anti-Tissue-Factor-Pathway-Inhibitor(TFPI)-Antikörper, wird in alternativen Therapiekonzepten versucht, durch die Hemmung von endogenen anti-koagulatorischen Faktoren einen Ausgleich in der Gerinnungskaskade zu schaffen. Diese Medikamente sind subkutan sowohl bei Hämophilie A als auch B und unabhängig vom Hemmkörperstatus anwendbar. Bisher sind jedoch nur Ergebnisse von Phase-I- und -II-Studien publiziert,12, 13 Langzeitergebnisse zur Sicherheit und Effektivität dieser Therapien bleiben abzuwarten.
Gentherapie vor dem Durchbruch
Die bereits publizierten Daten zeigen erfreulicherweise sowohl bei der Hämophilie A als auch bei der Hämophilie B eine sehr positive Entwicklung. Die einmalige Gabe eines mittels eines Adeno-assoziierten Virus-Serotyp-5(AAV5)-Vektors transferierten B-Domain-deletierten humanen FVIII (AAV5-hFVIII-SQ – Valoctocogene Roxaparvovec) führte in der Hochdosis-gruppe (6x1013vg/kg) bei 6 von 7 Patienten zu einer FVIII-Expression im Beobachtungszeitraum von 12 Monaten von über 50IE/dl.14 Im Follow-up der Studie nach insgesamt 3 Jahren wurden in dieser Kohorte die mittleren FVIII-Spiegel mit 64IU/dl (nach Jahr 1), 36IU/dl (nach Jahr 2) und 33IU/dl (nach Jahr 3) gemessen, der weitere Status der FVIII-Spiegel bleibt abzuwarten. 6 Patienten hatten 3 Jahre nach Einschluss in die Studie keine Gelenksblutungen mehr angegeben. Weitere 6 Patienten wurden zwischenzeitlich in die Studie eingeschlossen, sodass nun insgesamt 15 Patienten mit dieser Therapie behandelt wurden. Milde Nebenwirkungen, vor allem die Erhöhung der Leberenzyme, konnten mit Kortikosteroiden gut behandelt werden. Aufgrund dieser Daten erhielt Valoctocogene Roxaparvovec vorKurzem das Approval durch die FDA. Auch für Patienten mit Hämophilie B könnte der ebenfalls AAV-Vektor-vermittelte Gentransfer des FIX mit einer „Gain-of-function“-Mutation FIX-Padua (Factor IX-R338L) den möglichen Durchbruch bringen. In der 2017 publizierten Studie mit 10 Patienten mit schwerer Hämophilie B konnte nach dem Gentransfer ein über den Beobachtungszeitraum von 28–78 Wochen anhaltender mittlerer FIX-Spiegel von 34% (14–81%) gemessen werden.
Autor:
Ass.-Prof. Priv.-Doz. Dr. Clemens Feistritzer
Universitätsklinik für Innere Medizin V – Hämatologie und Onkologie
Medizinische Universität Innsbruck
E-Mail: Clemens.feistritzer@i-med.ac.at
Literatur:
1 Pabinger I et al.: Wien Klin Wochenschr 2015; 127(Suppl 3): S115-302 Nijdam A et al.: Thromb Haemost 2016; 115(5): 931-8 3 Peyvandi F et al.: N Engl J Med 2016; 374(21): 2054-64 4 Mancuso ME et al.: J Clin Med 2017; 6(4) 5 Peyvandi F et al.: Haemophilia 2019; 25(6): 946-52 6 Dong X et al.: Blood 2019; 133(14): 1523-33 7 Oldenburg J et al.: N Engl J Med 2017; 377(9): 809-18 8 Mahlangu J et al.: N Engl J Med 2018; 379(9): 811-22 9 Young G et al.: Blood 2019; 134(24): 2127-38 10 Reyes A et al.: Curr Med Res Opin 2019; 35(12): 2079-87 11 Aledort LM: N Engl J Med 2019; 381(19): 1878-9 12 Pasi KJ et al.: N Engl J Med 2017; 377(9): 819-28 13 Chowdary P et al.: J Thromb Haemost 2015; 13(5): 743-54 14 Rangarajan S et al.: N Engl J Med 2017; 377(26): 2519-30 15 Pasi KJ et al.: N Engl J Med 2020; 382(1): 29-40 16 George LA el al.: N Engl J Med 2017; 377(23): 2215-27
Das könnte Sie auch interessieren:
Die Thalassämie nimmt hierzulande an Bedeutung zu
Die medizinische Betreuung von Thalassämiepatient:innen hat sich in den letzten Jahrzehnten deutlich gebessert und benötigt insbesondere bei symptomatischen Patient:innen eine ...
Interessante Daten zu neuen Therapieoptionen
Am hämatologischen Jahreskongress der American Society of Hematology (ASH) wurden Updates von Studien wie TRIANGLE und POLARIX präsentiert, ohne dass sich hierbei grundlegende neue ...
Therapie des multiplen Myeloms
Dank vielfältiger neuer Therapieoptionen verbessert sich die Prognose beim multiplen Myelom (MM) stetig. Die bereits verfügbaren Therapien können oft eine langfristige, zum Teil auch ...